杂交蛋白氧载体光动力治疗诱导免疫原性细胞死亡的研究
陈志宽 刘兰兰 梁锐晶 何华美 郑明彬,3 蔡林涛
1(中国科学院深圳先进技术研究院 深圳 518055)
2(中国科学院大学 北京 100049)
3(广东医科大学 东莞 523808)
1 引 言
光动力治疗(Photodynamic Therapy,PDT)因其毒副作用小、非侵袭性、高度时空选择性等优点而被广泛应用于鳞状细胞癌、食管癌、膀胱癌等多种癌症的治疗,是一种具有重要临床应用前景的肿瘤治疗策略[1]。光敏剂被激光激发后将氧气转化成具有细胞毒性的活性氧,从而产生高效的肿瘤细胞杀伤效果[2]。尽管 PDT 在肿瘤治疗中展现了巨大的优势,但仍然存在许多不足。一方面,大部分光敏剂难溶于水,生物利用率差和肿瘤富集量低[3]。另一方面,实体瘤严重缺氧,使得 PDT 效果受到了限制[4,5]。因此,开发能高效包载光敏剂并具有自供氧能力的药物递送体系,对增强 PDT 疗效具有重要意义。
蛋白质具有良好的生物相容性、生物稳定性、功能与结构多样性,已成为载药、增氧、靶向等纳米药物递送平台的重要材料[6-8]。人血清白蛋白(Human Serum Albumin,HSA)作为人体内源性蛋白,已被美国食品药品监督管理局(FDA)批准应用于临床。该蛋白具有药物分子结合能力强、安全性高、主动靶向性强、体内循环稳定性好且半衰期长等优点,在众多纳米载药系统中具有巨大的优势[8,9]。血红蛋白(Hemoglobin,Hb)作为血液中红细胞的主要组成成分,负责氧气的运载,为机体的组织和细胞供氧。得益于 Hb 天然的载氧能力和良好的生物相容性,Hb 类氧载体作为一类血液替代品已应用于临床[10],其在肿瘤治疗的应用也日益受到关注[11,12]。据报道,将两种功能各异的蛋白质合成杂交蛋白纳米组装体,能在一个体系中同时实现两种蛋白质分子生物功能[13,14]。因此,构建包载光敏剂的 HSA/Hb 杂交蛋白纳米氧载体有望成为一种能实现肿瘤靶向和增强 PDT 疗效的新策略。
研究发现,放射治疗、光动力治疗、某些化疗药物(如蒽环类药物)能诱导肿瘤细胞发生“免疫原性细胞死亡”。其中,免疫原性细胞死亡依赖一类被称作“损伤相关分子模式”的免疫刺激信号分子(如钙网蛋白、高迁移率族蛋白 B1 和三磷酸腺苷等)的释放来激活和募集抗原递呈细胞,随后活化 T 细胞产生特异性抗肿瘤免疫应答[15]。研究癌症疗法的免疫原性细胞死亡诱导情况,对评估癌症治疗疗效、优化治疗策略具有重要意义。因此,本研究利用性能优异的 HSA、天然载氧蛋白 Hb 以及光敏剂 Ce6 为材料,通过二硫键共价偶联的方法构建包载 Ce6 的杂交蛋白氧载体(C@Hb/HSA),并以结肠癌细胞系(CT26.WT)为研究模型,考察其体外 PDT 效应,探讨 C@Hb/HSA 介导的PDT 能否诱导 CT26.WT 细胞产生免疫原性细胞死亡。
2 材料与方法
2.1 材料
人血清白蛋白(HSA)购自美国 Sigma 公司;血红蛋白(Hb)和谷胱甘肽均购自合肥博美生物科技有限责任公司;光敏剂 Ce6 购自北京百灵威科技有限公司;鼠源结肠癌细胞(CT26.WT)购自中国科学院典型培养物保藏委员会细胞库;RPMI-1640 培养基、磷酸盐缓冲液均购自美国 Hyclone公司;X-Vivo15 培养基购自瑞士 Lonza 公司;粒细胞巨噬细胞刺激因子、白细胞介素-4 均购自美国 PeproTech 公司;胰酶、胎牛血清、青霉素和链霉素均购自美国 Gibco 公司;活性氧荧光探针(2′, 7′-二氯二氢荧光素二乙酸酯,DCFHDA)购自美国 Sigma-Aldrich 公司;CCK-8 试剂盒购自上海碧云天生物技术公司;兔源的 antimouse calreticulin、anti-rabbit-Alexa Fluor 488 抗体均购自美国 Life technologies 公司;anti-mouse MHC II-PE、anti-mouse CD86-Percp 抗体均购自美国 eBioscience 公司;6 周龄 BALB/c 小鼠购自北京维通利华实验动物中心。所有操作均符合中国科学院深圳先进技术研究院动物伦理管理协议(SIAT-IRB-160223-YYS-ZMB-A0185)的要求。
2.2 实验方法
2.2.1 C@Hb/HSA 纳米颗粒的制备
首先,将 HSA 与还原剂——谷胱甘肽按3∶1 的质量比共溶于去离子水中(HSA 的浓度为 60 mg/mL),在室温下搅拌反应 1 h。然后,采用透析法除去反应溶液中过量的谷胱甘肽分子,得到还原后的 HSA 溶液。接着,将还原后的 HSA 溶液与预处理的 Hb 溶液、Ce6 溶液(溶于二甲基亚砜)混合,使 HSA、Hb、Ce6 的质量比为 50∶9∶1。溶液充分混合后,将 pH 调节至8.0,在剧烈搅拌的条件下,迅速加入 1.5 倍体积的无水乙醇溶液,室温搅拌反应 30 min。最后,反应溶液通过超滤法(超滤膜截留分子量为 100 kD,离心转速为 4 500 rpm)除去乙醇、游离的 Ce6、Hb 和 HSA,即得 C@Hb/HSA 纳米颗粒。
2.2.2 C@Hb/HSA 纳米颗粒的表征
C@Hb/HSA 的粒径分布、表面电位由Zetasizer Nano ZS 粒度仪(Malvern)在室温下测得。C@Hb/HSA 的形貌通过透射电子显微镜(FEI Tecnai G2 F20 S-Twin)进行表征。采用紫外/可见分光光度计(Perkin-Elmer Lambda25)测定C@Hb/HSA 的紫外-可见吸收光谱。C@Hb/HSA的氧释放曲线测定方法如下:C@Hb/HSA 充氧后,将 1 mL 的 C@Hb/HSA (相应 Hb 浓度为4 mg/mL)注入体积为 10 mL 的低氧水溶液中,插入溶氧仪探头(Mettler Toledo)后立刻用乙酸乙酯液封,记录不同时间点测得的溶氧浓度,并计算其与本底溶氧浓度的差值。
2.2.3 小鼠 CT26.WT 细胞的培养
选用鼠源的结肠癌细胞系 CT26.WT 来开展细胞实验,CT26.WT 细胞用 RPMI-1640 完全培养基(含有 10% 胎牛血清,1% 双抗)进行培养,培养条件为 37℃、5% CO2。
2.2.4 小鼠树突状细胞的分离与培养
BALB/c 小鼠采用颈椎脱臼处死,用 75% 乙醇浸泡消毒后,无菌条件下,取出小鼠的胫骨和股骨,置于含有 2% 胎牛血清的磷酸盐缓冲液中,并用 1 mL 注射器吸取含血清的磷酸盐缓冲液将胫骨和股骨内的骨髓细胞吹出。细胞吹散后,用 200 目的筛网过滤并收集于 15 mL 的离心管内,4℃、1 400 rpm 下离心 5 min,往细胞沉淀中加入 1 mL 红细胞裂解液,室温裂解 1 min,然后加入 3 mL RPMI-1640 培养基终止反应。低速离心后,细胞置于含 10% 胎牛血清、钙镁离子的 RPMI-1640 中贴壁 6 h。收集未贴壁细胞,低速离心后,细胞重悬于 X-Vivo15 培养基(含 10 ng/mL 白细胞介素-4、20 ng/mL 粒细胞巨噬细胞刺激因子、20% 肿瘤细胞培养上清),并接种到 24 孔板中培养。培养至第 4 天时,用新鲜的 X-Vivo15 培养基进行半量换液。培养至第6 天时,收集悬浮未贴壁的细胞,即为小鼠未成熟的树突状细胞。补充新鲜的培养基,重新接种后,便可用于后续实验。
2.2.5 细胞毒性实验
为了研究 C@Hb/HSA 的体外 PDT 效果,CT26.WT 细胞以 8×103个/孔的密度接种于 96孔板中,培养 12 h 后更换培养基,分别加入不同剂量的游离 Ce6 和 C@Hb/HSA 纳米颗粒(0~1.0 μg/mL)。密封孵育 2 h 后,660 nm 激光照射 2 min (100 mW/cm2),同时设置没有激光处理的对照组。继续培养 24 h 后,余下步骤按照CCK-8 试剂盒的说明书进行操作,最后用酶标仪(BioTek)测定各孔在 450 nm 处的吸光度值。
2.2.6 细胞流式实验
(1)细胞内活性氧的检测
首先,将 CT26.WT 细胞接种于 24 孔板(5×104个/孔)中,培养 12 h,使细胞充分贴壁生长。细胞的培养基分别替换为 RPMI-1640 培养基、含游离 Ce6(1.0 μg/mL Ce6)或 C@Hb/HSA(1.0 μg/mL Ce6)的培养基。然后,密封孵育 2 h,660 nm 激光照射 2 min (100 mW/cm2),同时设置没有激光照射的 C@Hb/HSA 组作对照。最后,快速加入活性氧检测探针 DCFH-DA(20 μM),继续孵育 30 min 后,收集细胞并使用流式细胞分析仪(FACS CANTO II,BD)分析细胞中活性氧的产生情况。
(2)细胞表面钙网蛋白的暴露
将 CT26.WT 细胞以 5×104个/孔的密度,接种于 24 孔板中。培养 12 h 后,分别更换为RPMI-1640 培养基、含游离 Ce6(1.0 μg/mL Ce6)或 C@Hb/HSA(1.0 μg/mL Ce6)的培养基,密封孵育 2 h 后,100 mW/cm2的 660 nm 激光照射2 min,同时设置没有激光处理的 C@Hb/HSA 组作对照。继续培养 24 h 后,收集细胞,先加入抗小鼠钙网蛋白抗体(Anti-mouse Calreticulin),在4℃ 避光孵育 2 h。随后,细胞经过洗涤后,加入 anti-rabbit-Alexa Fluor 488 抗体,孵育 1 h。最后,经缓冲液洗涤后,采用流式细胞分析仪分析各组细胞的钙网蛋白暴露水平。
(3)树突状细胞的体外成熟诱导
CT26.WT 细胞接种在 24 孔板中,细胞数为5×104个/孔。培养 12 h 后,分别替换为不加药物的培养基、含 1.0 μg/mL Ce6 或载有 1.0 μg/mL Ce6的 C@Hb/HSA 的培养基,密封孵育 2 h 后,660 nm 激光处理(100 mW/cm2,2 min)细胞,同时设置没有激光处理的 C@Hb/HSA 组作对照。继续培养 24 h 后,各组细胞与分离后培养到第 6 天状态良好的小鼠未成熟树突状细胞(5×105个/孔)共培养。24 h 后,收集树突状细胞,加入 anti-mouse MHC II-PE、anti-mouse CD86-Percp 抗体,4℃ 避光孵育 30 min。洗涤细胞后,采用流式细胞分析仪分析各组树突状细胞表面分子 MHC II、CD86 的表达情况。
2.2.7 统计分析
使用 Origin2015 软件处理实验数据,实验结果均以“平均值±标准差”(n=3)表示。组间差异采用单因素方差分析(One-way ANOVA)和Tukey 检验进行分析。其中,P<0.001 表示有极其显著的统计学差异。
3 结果与分析
3.1 C@Hb/HSA 纳米颗粒的表征
本文采用分子间二硫键共价偶联方法将Hb 与 HSA 进行杂交结合,构建包载 Ce6 的C@Hb/HSA 纳米颗粒。C@Hb/HSA 的透射电镜图显示纳米颗粒呈近似球形,分散性较好(图1(a)中的插图)。纳米颗粒的粒径分布图如图 1(a)所示,通过粒度仪测得纳米颗粒的平均粒径为(25.8±5.0)nm,Zeta 电位为(-30.9±0.9)mV。由图 1(b)紫外-可见吸收光图谱可知,C@Hb/HSA的特征吸收峰与游离 Ce6 基本一致,仅在 662 nm处有 2 nm 的红移,表明 Ce6 被包载后,基本保持其光学特性。为了评价 C@Hb/HSA 的携氧能力,本文测定了其在低氧水溶液中的氧释放曲线,结果如图 1(c)所示。C@Hb/HSA 在 20 min内氧气快速释放,随后进入缓释状态;在 60 min时,溶氧浓度差达 3.3 mg/L,表明 C@Hb/HSA能够实现长期持续的供氧。
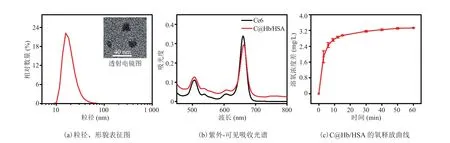
图1 C@Hb/HSA 纳米颗粒的表征Fig. 1 The characterization of C@Hb/HSA nanoparticles
3.2 C@Hb/HSA 纳米颗粒的体外 PDT 效果评价
活性氧作为 PDT 中直接杀伤肿瘤细胞的关键物质,其产生水平与 PDT 效果直接相关。因此,本文以 DCFH-DA 分子作为活性氧的检测探针,流式定量分析各组细胞的活性氧产生水平(DCFH-DA 被活性氧分子氧化成具有荧光信号的DCF(二氯荧光素))。如图 2 所示,C@Hb/HSA给药的细胞(C@Hb/HSA(+)组)经激光照射后,其 DCF 的平均荧光强度分别为 Control(+)组(光照处理无药物)、Ce6(+)组、C@Hb/HSA 组(无激光照射)的 2.9、2.8、3.2 倍。以上结果表明,在激光照射且较低的药物浓度(1.0 μg/mL Ce6)下,Ce6 经过杂交蛋白氧载体包载后,通过增氧能显著增强其在 CT26.WT 细胞的活性氧产生水平。
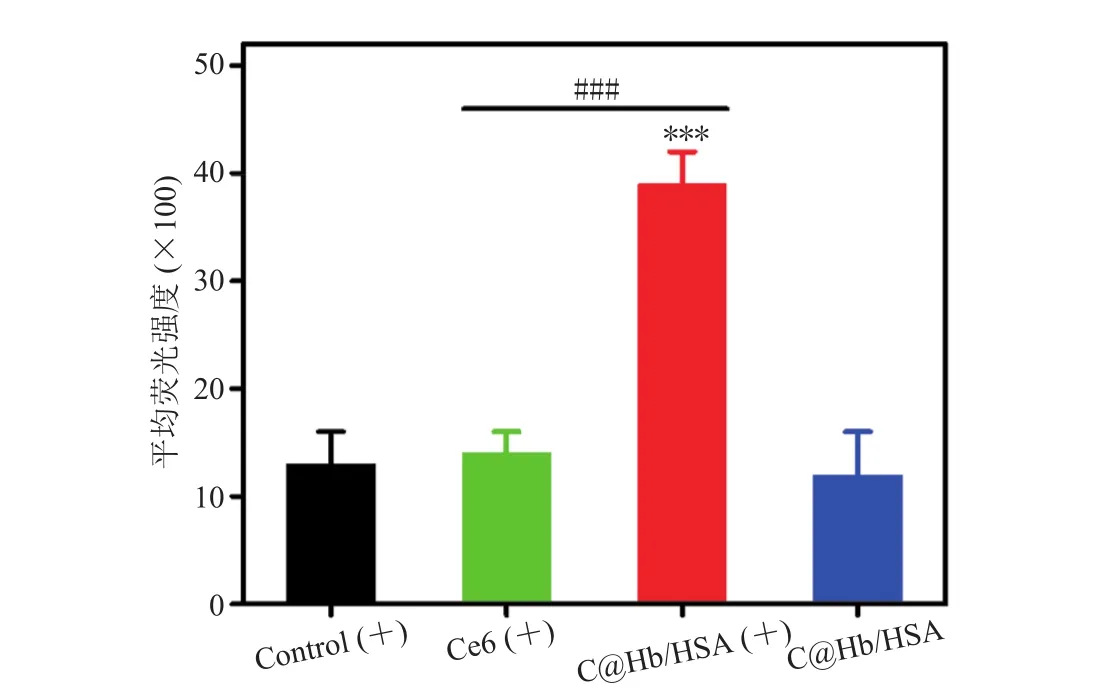
图2 不同处理组的细胞内活性氧产生水平Fig. 2 Intracellular reactive oxygen species generation of different treated groups
C@Hb/HSA 在光照条件下对 CT26.WT 细胞的杀伤效果采用 CCK-8 试剂盒进行测定。由图 3(a)可知,当 Ce6 浓度为 1.0 μg/mL 时,C@Hb/HSA(+)组的细胞存活率仅为(17.8±5.5)%,而 Ce6(+)组则高达(82.6±3.0)%。然而,当没有激光照射、C@Hb/HSA 在 Ce6 浓度小于 1.0 g/mL时,对 CT26.WT 细胞的存活率没有影响(图3(b))。以上结果表明,在较低的药物浓度(Ce6为 1.0 μg/mL)下,自供氧 C@Hb/HSA 在体外水平能显著增强 PDT 效果,且在没激光照射时表现出优良的生物相容性。
3.3 免疫原性细胞死亡标志分子——钙网蛋白的暴露

图3 C@Hb/HSA 对 CT26.WT 细胞的 PDT 效果与生物相容性评价Fig. 3 PDT eff i cacy and biocompatibility evaluation of C@Hb/HSA in CT26.WT cells
钙网蛋白(Calreticulin,CRT)作为免疫原性细胞死亡的一种关键生物标志分子。在肿瘤细胞发生免疫原性细胞死亡时,钙网蛋白会外翻暴露于细胞的表面,产生“吃我”的信号,刺激抗原递呈细胞对肿瘤细胞的识别与吞噬[16]。因此,为了探讨 C@Hb/HSA 介导 PDT 的免疫原性细胞死亡诱导效果,CT26.WT 细胞与C@Hb/HSA 孵育加以激光照射后,采用流式细胞仪分析钙网蛋白阳性细胞比例。图 4(a)、(b)显示,CT26.WT 细胞在经过 C@Hb/HSA加激光处理(C@Hb/HSA(+)组)后,其钙网蛋白阳性细胞的比例高达(72.0±15.4)%,分别为Ce6(+)组、Control(+)组、C@Hb/HSA 组(无激光照射)的 20.0、22.5、21.8 倍。以上结果表明,C@Hb/HSA 介导的 PDT 能显著促进钙网蛋白的细胞表面暴露,增强 CT26.WT 细胞的免疫原性。
3.4 树突状细胞的体外成熟诱导
树突状细胞作为一种重要的抗原递呈细胞,其成熟是肿瘤细胞发生免疫原性细胞死亡,诱导抗肿瘤免疫效应的关键[17]。CT26.WT 细胞与C@Hb/HSA 孵育并加以激光照射后,与未成熟的树突状细胞共培养,随后通过流式细胞仪分析树突状细胞表面的 MHC II、CD86 的表达来反映树突状细胞的成熟情况。如图 5(a)、(b)所示,C@Hb/HSA 加激光处理的 CT26.WT 细胞(C@Hb/HSA(+)组)能够诱导(42.5±5.1)% 的树突状细胞成熟,明显高于 Ce6(+)组的(22.5±0.7)%、Control(+)组的(20.1±0.4)% 以及 C@Hb/HSA组(无激光照射)的(19.1±3.1)%。以上结果表明,C@Hb/HSA 介导的 PDT 所诱导的 CT26.WT细胞死亡,表现出较强的免疫原性,能够在体外水平促进树突状细胞成熟。
4 讨 论
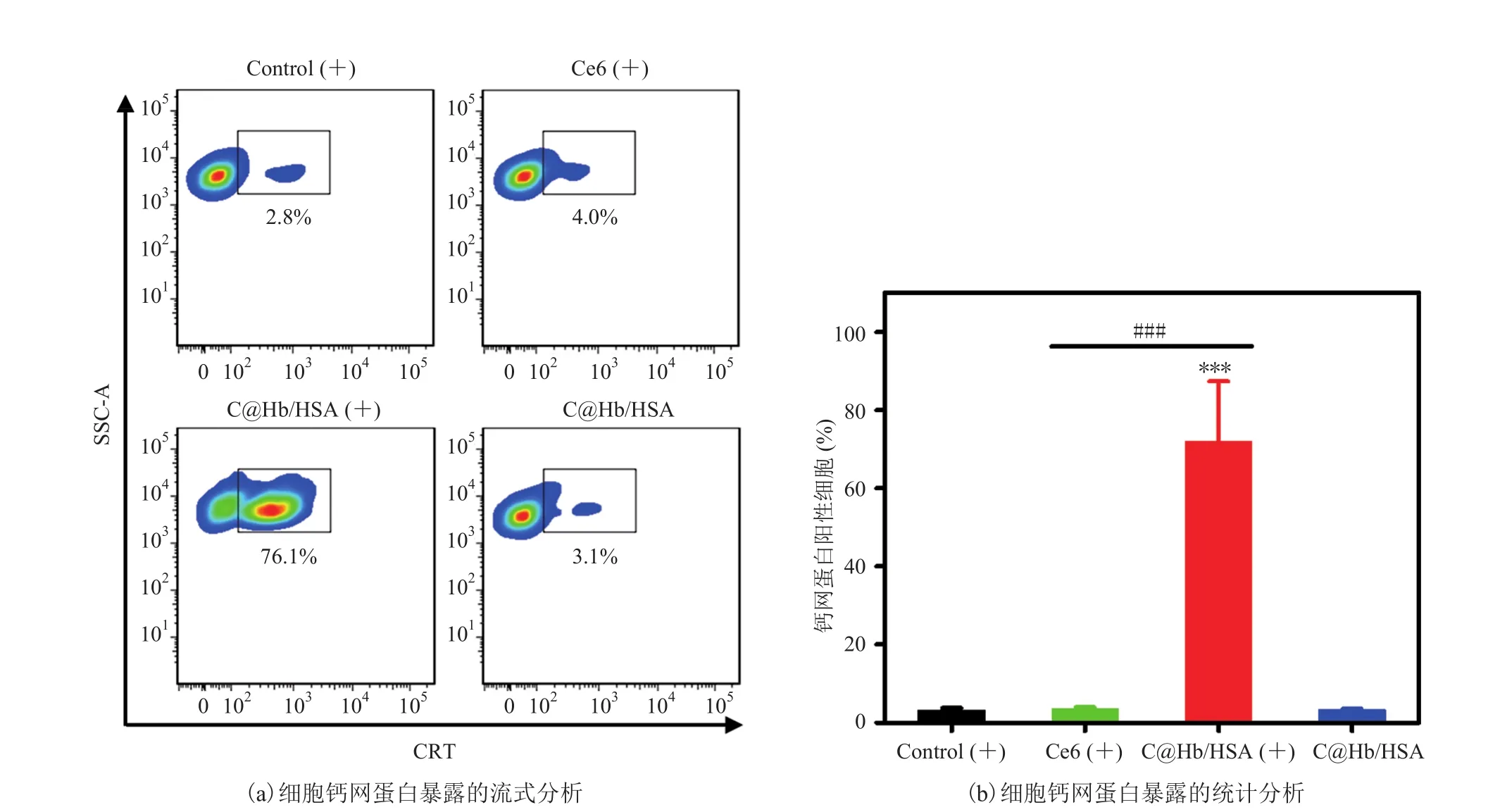
图4 CT26.WT 细胞经过不同处理后的钙网蛋白暴露评估Fig. 4 The assessment of calreticulin (CRT) exposure on CT26.WT cells after various treatments
近年来,Hb 类氧载体展现出增强肿瘤 PDT疗效的潜能。Wang 等[7]利用聚合物胶束偶联的 Hb 氧载体包裹光敏剂 ZnPc 后在细胞水平上表现出较强的光毒性。随后,本文作者课题组采用聚合物(PLGA)包载光敏剂 ICG-Hb 复合物,并覆盖磷脂层,构建了具备稳定供氧功能的“纳米人工红细胞”,并在动物水平上证明其能有效增强肿瘤 PDT 疗效[18]。然而,磷脂、聚合物作为外源物质且不具主动靶向性,因而聚合物偶联或包载的纳米颗粒容易被机体的肝、肾等组织清除而降低纳米颗粒的肿瘤富集效率,最终影响了治疗效果[19]。本研究构建了包载光敏剂 Ce6 的杂交蛋白氧载体(C@Hb/HSA)。细胞实验表明,Ce6 经过杂交蛋白氧载体包载后,其体外 PDT 效果因为增氧得到了显著的提升,展现了杂交蛋白氧载体的优良供氧性能。此外,基于HSA 良好的载药能力、生物相容性以及主动靶向性[8,20],杂交蛋白氧载体可能具有实现药物和氧气肿瘤靶向递送的潜力,这有待进一步研究。
研究发现,PDT 不仅能通过活性氧直接杀伤肿瘤细胞、损伤肿瘤血管的方式消除肿瘤,而且能通过触发免疫反应和炎症达到二次杀伤效果[21],但其抗肿瘤免疫的详细机制仍没有完全了解。免疫原性细胞死亡概念的提出,解释了许多癌症疗法所产生的抗肿瘤免疫效应,可为肿瘤治疗提供新的依据和方向[22]。研究表明,在免疫原性细胞死亡过程中,活性氧能以刺激肿瘤细胞产生内质网应激而暴露钙网蛋白的方式增加肿瘤细胞的免疫原性,引发抗肿瘤免疫响应[16,23]。本研究发现,CT26.WT 细胞经过 C@Hb/HSA 介导的 PDT 处理后,细胞内的活性氧水平显著上升,并且与后续的细胞表面钙网蛋白的暴露趋势一致。随后的树突状细胞体外成熟实验进一步证明了 C@Hb/HSA 介导的 PDT 能增强 CT26.WT细胞的免疫原性。这表明 C@Hb/HSA 介导的PDT 不仅能直接增强肿瘤细胞的杀伤,而且可能以触发特异性抗肿瘤免疫应答的方式进一步杀伤肿瘤,抑制转移和复发,后续动物实验将进一步评价。
5 结 论
本研究以 HSA、Hb 为材料,通过二硫键偶联的方法,成功构建了具备包载光敏剂和良好供氧能力的杂交蛋白氧载体(C@Hb/HSA)。杂交蛋白氧载体能显著提升 Ce6 分子在细胞内的活性氧产生水平,并且在较低的药物浓度(Ce6为 1.0 μg/mL 时)下能够有效杀伤 CT26.WT 细胞。通过细胞表面钙网蛋白的暴露实验发现,C@Hb/HSA 在增强 PDT 效果的同时也能显著增强细胞表面钙网蛋白的暴露,钙网蛋白阳性细胞比例高达 (72.0±15.4)%。同时,CT26.WT 细胞经 C@Hb/HSA 介导的 PDT 处理后,能够在体外水平促进树突状细胞成熟,证明 C@Hb/HSA 介导的 PDT 能够增强 CT26.WT 细胞的免疫原性。

