超声波在干细胞治疗中的应用进展
陈俊林 王 嫣
1(重庆医科大学生物医学工程学院 重庆 400016)
2(省部共建国家重点实验室培育基地——重庆市超声医学工程重点实验室,重庆市生物医学工程学重点实验室,重庆市微无创医学协同创新中心 重庆 400016)
1 引 言
干细胞治疗即通过工程化手段将具有分化潜能的胚胎干细胞或成体干细胞大量扩增,使其可适应机体生化和生理条件进行迁移、增殖和分化,进而代替病变组织的一种治疗方式。干细胞治疗是目前再生医学中重要且有效的治疗手段,其研究包括机体内的迁移、增殖、分化、解剖分布和作用机制等。研究显示,与胚胎干细胞相比,成体干细胞(在已经分化的组织中存在的具有自我更新和多能性的一类细胞)具有来源广泛、免疫排斥反应弱、致瘤风险低、伦理学争议较少等优势[1],在干细胞治疗领域具有更好的应用前景。然而,无论是胚胎干细胞还是成体干细胞,单独的干细胞治疗均存在组织内细胞活性降低、流失、扩散等问题,较难达到预期的治疗效果[2]。随着生物工程技术的发展,联合其他工程技术如超声波[3]、极低频电磁场[4]、激光[5]等以增强干细胞治疗效果的研究逐渐受到关注。超声波作为一种机械波,振动频率在 20 kHz 以上。研究发现,低强度(<3 W/cm2)超声波能够刺激体外培养的人成纤维细胞蛋白质合成及促进腿部静脉性溃疡的肉芽组织的形成[6],该发现使低强度超声波在干细胞治疗领域的研究热潮兴起并愈来愈深入。随着研究的不断进展,低强度超声波具有无创、安全、简便、费用低廉等特点已广为人知,在干细胞治疗领域的应用前景也越来越被看好,已逐渐发展成为促进干细胞治疗疗效的有效技术手段。以下将针对低强度超声波在干细胞治疗领域的研究进展做相关介绍。
2 低强度超声波的干细胞生物学效应
超声波作用于干细胞的物理机制为:超声波在介质中传播时,介质质点在其平衡位置附近作往复运动,使介质内部发生有节律的疏密变化,这种疏密变化形成了压力变化,能对细胞产生微细按摩作用。这种对细胞的微细按摩作用可以改变细胞的体积和膜的通透性,促进代谢物质的交换,从而调节细胞的功能[7]。干细胞的功能发生改变则会产生相对应的组织生物学效应,具体表现在对干细胞增殖、迁移、分化及活性的影响。
2.1 对干细胞增殖的影响
干细胞作为适于组织、器官替代治疗需要的良好种子细胞,其研究仍面临着如何有效和大规模的体外扩增培养以获取足够数量的细胞来源、维持干细胞的增殖能力和传代次数等问题。间充质干细胞(Mesenchymal Stem Cells,MSCs)是一种能分化为成纤维细胞、成骨细胞、软骨细胞、脂肪细胞、肌肉细胞、内皮细胞等多种细胞系的多能干细胞,来源广泛并易于体外培养,被认为具有良好的临床应用潜力[8]。于海生等[9]证实了低强度超声波辐照一定时间后能够促进骨髓间充质干细胞(Bone Marrow Mesenchymal Stem Cells,BMSCs)增殖,接种密度为 2×104/mL 细胞增殖活性曲线更加稳定。不同的辐照强度和辐照时间促进增殖的效应不同。其中,当强度为 0.2 W/cm2、辐照 10 min 时,促进增殖效果最佳[10]。诱导多能干细胞源性神经嵴干细胞(Induced Pluripotent Stem Cell-Derived Neural Crest Stem Cells,iPSCs-NCSCs)能分化为神经细胞、神经胶质细胞、雪旺细胞等,患者自身来源的 iPSCs-NCSCs 免疫排斥反应低,道德伦理争议少,可以作为神经细胞再生的重要细胞来源[11]。Lv 等[12]采用频率为 1 MHz,强度分别为500 mW/cm2、1 500 mW/cm2的低强度超声波辐照 EdU+细胞 10 min/d。4 天后发现,当强度为500 mW/cm2时,能显著促进 EdU+细胞数量增多;但当强度提升为 1 500 mW/cm2时,EdU+细胞数目反而减少。这说明低强度超声波能促进iPSCs-NCSCs 增殖,但增殖效应因超声剂量不同而异。随着研究的不断深入,研究者对低强度超声波促进干细胞增殖机制的认识也不断加深。Bmi-1 基因是维持成体干细胞、神经干细胞等祖细胞增殖所必需的一种重要基因,其表达量对干细胞自我增殖效率方面的影响较大。胡帅[13]检测了低强度超声波辐照前后 Bmi-1 基因的表达情况。结果显示,不同培养体系中经低强度超声波辐照后的 Bmi-1 基因表达均高于空白对照组,同时也明显高于原代细胞。证实了低强度超声波能有效提高 Bmi-1 基因的表达,即从分子水平上调控细胞的增殖。Ling 等[14]研究表明,低强度超声波辐照后能促进人羊膜来源间充质干细胞从G0/G1 期进入 S 期和 G2/M 期,激活 ERK1/2 和Akt 通路并促使其磷酸化,同时上调 cyclin D1、cyclin E1、cyclin A2、cyclin B1 表达,从而促进细胞的增殖。综上,低强度超声波促进干细胞增殖的效果毋庸置疑,但干细胞在超声的作用下会不会无限制地增殖直至成瘤,至今未见报道。干细胞的致瘤性也是限制其临床应用的重要风险因素。未来,研究者可针对超声波对成体干细胞的致瘤风险展开深入研究及评估。
2.2 对干细胞分化的影响
在 MSCs、iPSCs-NCSCs 等干细胞修复组织的研究中,不仅要促进其扩增,而且更重要的是要诱导其向特定组织分化。干细胞分化的本质是细胞在基因表达上的时空差异。这种基因表达的差异除了由细胞内在的发育程序决定外,还受细胞外环境的影响和调控,且有时这种外部控制条件或环境对形成特定细胞有着决定性作用[15]。在软骨分化研究中发现,低强度超声波:可提高细胞生长因子 TGF-β 介导的人MSCs 的蛋白多糖沉积从而促进人 MSCs 向软骨分化的效率[16];能够刺激海藻酸钠凝胶培养的兔MSCs 向软骨分化[17];可联合纤维蛋白透明质酸(fibrin-Hyaluronic Acid,fibrin-HA)使 MSCs 分化成高质量的软骨组织[18]。研究表明机械信号的缺乏会抑制 MSCs 向成骨细胞分化[19],因此Uddin 和 Qin[20]将 MSCs 在 1D 回旋器中模拟微重力条件进行培养,采用强度为 30 mW/cm2的低强度超声波每天辐照 20 min 发现,与对照组对比,超声组中 ALP、OSX、RANKL、RUNX2的表达提高,而 OPG 的表达减少,恢复了约22% 的 ALP 阳性细胞数。证明低强度超声波刺激的效果等同于正常重力条件下的效应,能促进 MSCs 成骨分化,从而修正体内成骨分化不正常的现象。Kusuyama 等[21]进一步研究认为低强度超声波在促进 MSCs 成骨分化的同时抑制脂肪细胞的分化。何瑞欣[22]则发现低强度超声波可以加速 BMSCs 向成骨和血管内皮方向分化,使其更快生成骨组织和血管组织。在双向同时诱导条件下,低强度超声波对 BMSCs 分化率的提高作用最明显。神经细胞分化研究中,以神经干/祖细胞(Neural Stem/Progenitor Cells,NSPCs)以及 iPSCs-NCSCs 为研究对象,研究者期望将体外扩增的干细胞(如 iPSCs-NCSCs)移植到损伤部位以替代和补充死亡的神经元及施旺细胞。Lee 等[23]发现低强度超声波能促进 NSPCs 向神经元细胞分化,诱导神经轴突生长并调节小分子神经递质一氧化氮的生成。Lv 等[12]研究结果显示,经强度为 500 mW/cm2的低强度超声波辐照后,iPSCs-NCSCs 中神经元标志物(NFM、Tuj1)的 mRNA 和蛋白表达量在第 4 天均上升;施旺细胞标志物(S100β、GFAP)的 mRNA 和蛋白表达量在第 4、7 天均上调。表明低强度超声波可促进 iPSCs-NCSCs 向神经元和施旺细胞分化。可见,低强度超声波在合适的条件下可作为诱导细胞分化的外部控制条件协同细胞分化相关因子产生效应,提高干细胞分化效率。但在超声波的影响下,干细胞是否就只向指定方向分化,没有分化的那部分干细胞是否会出现异常反应?超声波的剂量、辐照持续时间以及分化诱导剂的使用以哪种比例设计对促进干细胞的分化效果最佳?以上问题还有待更深入的研究。
2.3 对干细胞迁移的影响
干细胞在机体内迁移归巢到病变部位的能力是干细胞治疗的关键步骤之一。超声波可以影响干细胞迁移,如在超声波作用下血脑屏障的通透性一过性增加,有利于移植干细胞进入脑内发挥治疗作用[24]。范国峰等[25]采用频率 1 MHz、强度 1 W/cm2,进行脉冲超声辐照 2 min 以及加入微泡干预 BMSCs,并通过 Transwell 小室培养法检测其迁移能力。结果显示,空白对照组、单纯微泡组 BMSCs 的迁移能力较低,超声联合微泡组和单纯超声组细胞的迁移能力与空白对照组、单纯微泡组间具有显著差异,提示超声及超声联合微泡作用能明显增强 BMSCs 的迁移能力。趋化因子、生长因子及黏附分子是 MSCs 归巢过程中重要的相关因子。其中,趋化因子基质细胞衍生因子 1/CXCR4 轴是促进 MSCs 向损伤组织归巢最重要的生物轴[26];超声联合微泡协同脂质体能够安全、有效地提高 CXCR4 在 BMSCs 中的表达[27]。Jang 等[28]将低强度超声波与两种已知的趋化因子(fMLF、HMGB1 蛋白)对细胞迁移能力进行对比。Transwell 试验和单层划痕试验检测结果表明,低强度超声波能够显著提高内皮祖细胞的迁移能力,其机制可能与黏着斑激酶的活性相关。目前也有动物实验显示,超声联合微泡能够提高移植干细胞在心肌缺血区归巢率[29-32],但其作用机制仍然不明确。由于干细胞迁移受营养、局部微环境等多种因素调控,膜内信号网络与调控机制非常复杂,低强度超声波促进干细胞体内迁移和归巢的确切机制仍不清楚,因此需要更多的深入研究提供理论依据。
超声靶向微泡破坏技术(Ultrasound-Targeted Microbubble Destruction,UTMD)是近年来新兴的靶向传输技术,目前已成功应用于干细胞归巢、药物传输及基因转染方面的研究。UTMD 以体内或体外的单纯微泡作为药物和基因传送的载体微泡为基础,通过使用合适条件的超声进行辐照,基于超声波的空化效应,微泡被活化破灭释放能量造成细胞或内皮屏障可逆性损伤,增强了细胞膜的通透性以达到靶向传输目的[33,34],具体作用原理如图 1 所示。局部炎症反应以及组织微循环的改善也被认为是 UTMD 促进干细胞移植的原因,但具体的分子机制还需要进一步研究[35]。
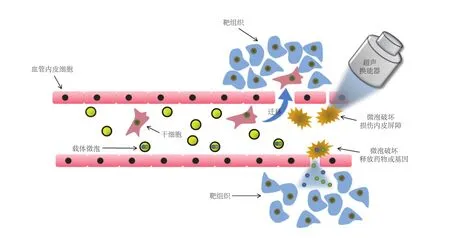
图1 超声靶向微泡破坏技术作用原理Fig. 1 The schematic diagram of ultrasound-targeted microbubble destruction
2.4 对干细胞活性的影响
超声波的强度对细胞活性的影响非常大,如超声波以一定强度在生物体内传播时可引起生物体结构或功能的变化。其中,高强度超声波对机体组织器官起破坏或损伤的作用,而低强度、小剂量则起调节刺激的作用[36,37]。虽然众多研究已经证实参数合适的超声波能促进干细胞增殖和分化,但超声对干细胞活力的影响研究则较少。NSPCs 体外培养需充足的环境条件,Lee 等[23]认为应用强度从 0.1~0.5 W/cm2的低强度超声波辐照能维持 NSPCs 细胞活力,且低强度超声波联合神经生长因子能显著提高NSPCs 存活率。Lim 等[38]指出使用占空比为20% 与 50% 的低强度超声波辐照对人牙槽骨来源 MSCs 的细胞活力无明显差异,但显著高于对照组的 MSCs,提示低强度超声波能增强人牙槽骨来源 MSCs 的细胞活力。Lee 等[39]观察到 3D 海藻酸钠凝胶与 TGF-β 培养的人 MSCs向软骨诱导分化 2 周后,会导致细胞凋亡所介导的细胞活力下降。在同样的条件下,采用频率为 1 MHz、强度为 0.2 W/cm2的连续超声波辐照后,能显著增强人 MSCs 的活力,并影响其 p53、bax、bcl-2、PCNA 等凋亡与存活的相关基因的表达。Peng 等[40]使用低强度超声波刺激造血干/祖细胞(Hematopoietic Stem/Progenitor Cell,HSPC)发现,低强度超声波能增强 HSPC增殖,维持低温保存的 HSPC 体外活性且不影响 CD34 与 CD14 阳性细胞比例。因此,我们认为低强度超声波刺激有望能提高 HSPC 临床移植和细胞治疗的效率。随着生物材料和新型药物研究的不断深入,联合应用超声波治疗可能会成为解决干细胞活力不足的最具潜力手段。
以往研究认为中、小剂量(0.1~2 W/cm2)的超声波是正性细胞调节作用,故把恶性肿瘤列为临床低强度超声波治疗禁忌症[7]。随着肿瘤干细胞学说[41]的提出,低强度超声波对肿瘤干细胞的生物学效应获得深入研究。金成兵[42]发现低强度超声波可以抑制 Wnt/β-catenin 通路中关键因子 β-catenin 的产生,干扰该信号传导途径激活,阻止其激活相关靶基因,从而抑制肝癌干细胞样细胞的增殖、更新、分化。此外,低强度超声波可能会通过下调 MDR1 基因及其相关产物来改善具有干细胞样特点的 CD133+肝癌细胞,有效逆转肝癌干细胞样细胞的多重耐药性。UTMD 研究的不断深入,可对肿瘤干细胞进行靶向性治疗,有利于阻断肿瘤发生、发展及复发转移。Shi 等[43]通过制作新型的载表柔比星联合 ABCG2 抗体微泡,利用 UTMD抑制多发性骨髓瘤干细胞增殖、迁移和侵袭能力,并促进其凋亡。此外,Liu 等[44]研究表明UTMD 介导的 CD133-shRNA 转染后能显著下调 CD133+肝癌干细胞 CD133 的表达,并抑制其增殖、侵袭及成瘤能力。鉴于肿瘤干细胞的异质性,超声波治疗对肿瘤细胞与肿瘤干细胞的生物学效应不尽相同,其是否能通过对肿瘤干细胞的抑制作用而对肿瘤治疗起到辅助效果有待更深入的研究。
3 低强度超声波联合干细胞治疗的研究进展
目前,干细胞研究已经进入由基础实验研究向临床治疗转化的关键阶段。超声联合干细胞治疗的在体研究如雨后春笋般涌现。
3.1 低强度超声波联合干细胞治疗肌肉骨骼疾病
美国食品与药品监督委员会(Food and Drug Administration,FDA)分别于 1994 年、2000 年批准了低强度超声波用于新鲜骨折和骨不连的临床治疗。通过联合干细胞,有望增加低强度超声波对骨科疾病的疗效。低强度超声波可通过增强 MSCs 内 SDF-1、CXCR4、BMP-2 的表达促进 MSCs 在损伤部位的募集能力以及成骨分化,从而促使骨折愈合[45,46]。He 等[47]手术制作股骨缺陷 SD 大鼠模型,然后使用海藻酸钠凝胶培养的 MSCs 填充骨缺损部位并以强度为 0.2 W/cm2的低强度超声波进行辐照,超声治疗有效地促进 MSCs 从静止期进入成长/分裂期,增强了细胞的增殖,从而促进骨缺损愈合。Cui 等[48]把兔MSCs 接种于聚乙醇酸(Polyglycolic Acid,PGA)无纺网后置于软骨分化培养基体外培养 1 周后,PGA/MSCs 被植入裸鼠背部皮下。之后超声组采用频率 0.8 MHz、强度为 0.2 W/cm2的超声辐照,1 周后与 4 周后总胶原和糖胺聚糖含量均显著高于对照组,且力学试验结果显示抗压强度也显著增高。Burks 等[49]则认为重复多次联合应用脉冲聚焦超声与干细胞(MSCs、EPC)能提高干细胞向肌肉归巢量。白园园等[50]进一步利用UTMD 提高 MSCs 静脉移植的效率,给大鼠颈静脉输注微泡及 Brdu 标记的 MSCs,在下肢给予 1.9 W/cm2超声辐照 180 s 发现,血管壁及血管外可见更多的 Brdu 阳性细胞。但因肌肉骨骼损伤的修复是一个长期的过程,UTMD 技术向临床应用过渡还需要更长时间的随访及更完善的安全性评估。
3.2 超声波联合干细胞治疗心血管疾病
目前已知移植干细胞到达心脏能发挥治疗作用,通过紧密连接的血管内皮层是其关键[51]。UTMD 技术能提高干细胞移植中的靶向归巢、促进心功能改善。UTMD 在大鼠[29]、杂交犬[30]、新西兰兔[31,32]的心肌梗死模型的应用中,均能显著提高 MSCs 向心肌靶向归巢的效率。此外,虽然 UTMD 对 MSCs 的增殖和凋亡活动无影响,但却能显著提高 CXCR4、SDF-1、VEGF 等相关迁移因子的表达,促使毛细血管密度增加和心脏功能改善[29]。Kuliszewski 等[52]在慢性下肢缺血的大鼠模型中应用超声介导载 SDF-1 质粒微泡破坏能靶向传递 EPCs 到血管内皮,提高 EPCs 的局部移植成活率。UTMD 介导 SDF-1 基因转染与 EPCs 联合显著改善血管灌注与毛细血管的密度,为基因治疗提供了新的治疗策略。
3.3 超声波联合干细胞治疗泌尿系统疾病
由于活体动物肾脏血供丰富,血流的“散热效应”会带走由超声波热效应所产生的热量,导致活体肾组织对超声能量的反应与离体组织比较可能有明显的差别[53]。有研究表明,采用无创脉冲聚焦超声对小鼠的一侧肾脏进行辐照时,对组织所产生的机械效应会引起局灶性、暂时性趋化因子的升高。而脉冲聚焦超声引起的细胞因子的上调会在治疗后约 1 天出现,3 天后恢复到对侧肾的水平,合理利用此时间窗进行 MSCs静脉注射能显著提高其靶向归巢的能力[54]。另外,MSCs 移植直接分化成肾小管上皮细胞、促进肾小管坏死后上皮细胞的修复与再生的作用可能有限[55]。而 UTMD 技术能改变肾脏局部微环境,使细胞膜通透性增加及内皮细胞间隙增宽,MSCs 可通过破裂的微血管和细胞间隙到达组织细胞内,从而提高肾脏靶向传输 MSCs的能力。在活体研究中,UTMD 对急性肾小管坏死[56]、糖尿病肾病[57,58]均具有较好的治疗效果,而在治疗慢性细菌性前列腺炎[59]中也有相关研究。
3.4 超声波联合干细胞治疗神经系统疾病
有报道[60]指出,低强度超声能通过刺激雪旺细胞的增殖及髓鞘的再生而间接促进外周神经损伤的再生和神经功能的恢复,联合 iPSCs-NCSCs或其他生物材料为治愈周围神经损伤带来可能。翟翠静等[61]通过剪断 T8 脊髓制作 SD 大鼠脊髓损伤模型,NSCs 移植联合应用低强度超声波能促进损伤脊髓运动和传导功能的部分恢复。可能是低强度超声波通过改善损伤脊髓局部微环境,创造利于 NSCs 生长分化的条件而促进了大鼠损伤脊髓功能的部分恢复。但结果远未达到正常状态水平,提示在脊髓损伤的神经干细胞移植方面还需要更深、更细的进一步研究。
4 超声成像在干细胞治疗中的应用进展
干细胞成像对于再生医学中的监测和评价疗效过程是不可或缺的。目前干细胞成像的方法主要包括磁共振成像、单光子发射性计算机断层显像、光学成像(亮子点、荧光成像和生物发光)以及超声成像等。在超声成像中,靶组织相对于背景的低对比度是一个关键限制因素。Chen 等[62]描述了一种新型的杯形二氧化硅(SiO2)纳米粒子,可在再生医学成像中对标记的干细胞有显著的超声阻抗不匹配现象。通过将这种新结构与超声中使用的其他二氧化硅结构进行比较,发现外泌体样二氧化硅纳米粒子会造成增强的干细胞超声信号应答,且标记的浓度下并没有检测到细胞毒性。其中,外泌体样二氧化硅纳米粒子有可能在干细胞示踪中得到广泛应用。当前干细胞在体内迁移、作用的动态可视化依然具有很大挑战。光声成像技术是一种新兴的、无损的光学技术与超声技术相结合的检测技术,具有较大的穿透深度、较高的图像对比度和分辨率[63]。Kim 等[64]使用普鲁士蓝纳米颗粒有效标记人体间充质干细胞(如图 2),使其具有更好的光声对比,体内移植实验可实现长达两周的持续成像。在体研究[65]表明,治疗创伤性脑损伤中应用经修饰过的普鲁士蓝标记的骨髓造血干细胞能够成功追踪干细胞在创伤恢复过程中的迁移,过程中脑部出血情况可被光声成像技术清晰显像及持续性监测。Qin等[66]成功设计了一种具有光声效应的有机半导体纳米粒子,并将该纳米粒子用于诱导性多能干细胞分化的心肌细胞的活体细胞标记,成功解决了其难以被标记的难题。由于光声模式具有非常高的成像信噪比和对比度,该技术可以准确判断和量化移植成功的干细胞,而普通超声成像则不具备这种能力。在未来,加强对超声成像与其他工程技术结合的研究,将会成为突破干细胞示踪研究的关键。
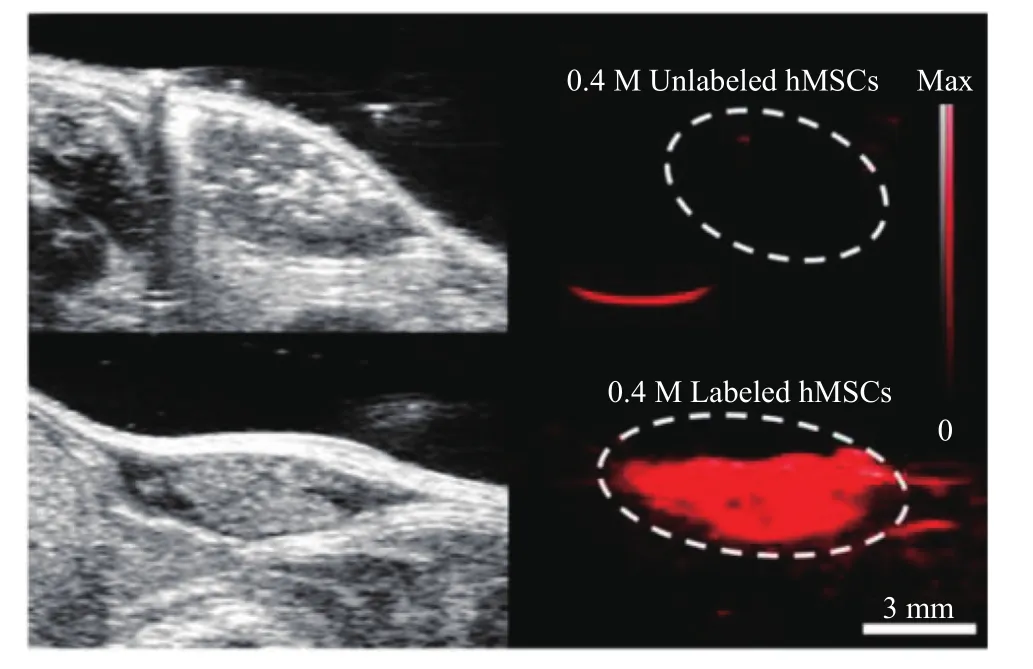
图2 光声成像体内普鲁士蓝纳米颗粒标记的间充质干细胞[64]Fig. 2 Photoacoustic imaging of mesenchymal stem cells labeled with prussian blue nanoparticles in vivo[64]
5 超声在干细胞治疗中参数应用参考
根据现有报道,将联合干细胞治疗中不同参数的超声总结在表 1 中供读者参考。
6 结论和展望
综上所述,超声波可刺激体外培养的干细胞,促进其增殖、分化、迁移以及维持细胞活性,缓解种子细胞来源不足、分化成熟和移植效率低等问题。超声靶向微泡破坏技术(UTMD)作为近年来新兴的技术,在干细胞移植、靶向药物递送以及基因转染的研究中具有较好的应用前景。
但超声波在干细胞治疗中要从基础研究走到大规模临床应用,还有很长的路要走。该研究领域目前还存在以下问题:(1)上述低强度超声波对 MSCs 与肿瘤干细胞的效应各异,说明低强度超声波对干细胞的生物学效应未被充分了解,其应用于干细胞治疗还需要对分子、通路、基因等更深层次的机制进行研究;(2)联合超声与干细胞治疗的研究尚处于初步阶段,文献报道的质量参差不齐,需要更多的活体或大型动物疾病模型进行研究,逐步向临床应用过渡;(3)超声波强度不同对干细胞产生的影响也不同,因此超声波的参数选择是有效治疗的关键,而各文献中报道的参数应用不一致,超声波仪器生产厂商亦各不同,尚待更多参数优化的研究,为超声联合干细胞治疗提供指导;(4)超声波对干细胞免疫调节能力的影响报道较少,尚无足够证据证明长期应用超声波辐照移植干细胞不产生体内免疫排斥反应,所以这方面研究亟待深入;(5)UTMD 的安全性尚存在争议,有研究[67]报道超声介导微泡破坏的参数选择过高导致心功能障碍伴 ST 段抬高,在增强靶向性和减少不良反应发生的前提下,该技术需要进一步研究优化。

表1 超声在干细胞治疗学中参数选择参考Table 1 The reference of ultrasonic parameter selection in stem cell therapy
相信随着研究的深入,超声波在干细胞治疗学中的应用将越来越广泛,成为辅助干细胞治疗的有用工具,甚至可以与其他工程技术结合以获得更好的疗效。

