阿卡波糖产生菌的选育和发酵工艺优化
黄建平,郑燕
阿卡波糖产生菌的选育和发酵工艺优化
黄建平,郑燕
(杭州中美华东制药有限公司,浙江 杭州 310000)
通过实验分析对阿卡波糖产生菌的选育与发酵工艺优化进行了研究。实验结果显示,在对阿卡波糖产生菌采取紫外以及NTG等诱变处理后进行杂质组分较低的高产突变株SIPI-AK筛选,其发酵水平能够明显提升约36%,并且在对罐上补料工艺进行优化后,能够达到质量浓度在3 100 μg/ mL以上的发酵工艺效果,同时,对杂质C组分生成具有抑制作用,效果十分明显。
阿卡波糖;生产菌;工艺优化;糖尿病
阿卡波糖作为有效的α-葡糖苷酶抑制剂,在Ⅱ型糖尿病临床治疗中应用较多。值得注意的是,阿卡波糖产生菌选育发酵过程中,游动放线菌在实现阿卡波糖发酵生产的同时,也会产生一系列异构体杂质,而药典中对阿卡波糖杂质的限度是有明确的规定,一般要求其发酵生产中产生的A,B,C,D,E,F等异构体组分杂质含量不高于0.6%,0.5%,1.5%,1.0%,0.2%,0.3%等,同时,其他组分杂质含量均应低于0.2%.其中,由于阿卡波糖发酵生产中,杂质组分A与C的分离较为困难,在提高阿卡波糖发酵生产单位的同时,需要确保对其组分杂质含量进行控制,以保证阿卡波糖发酵的质量。针对这种情况,通过实验分析方式对阿卡波糖产生菌的选育和发酵工艺优化进行分析,以达到其发酵生产中发酵单位提升、控制杂质组分含量的目的。
1 实验试剂与条件
1.1 仪器与材料
本次实验所使用阿卡波糖对照品为浙江省药品检验所提供,对照品纯度为99%;实验中所使用的水为蒸馏水。此外,实验中所使用的游动放线菌(LA-H6)为本实验室保藏菌种,斜面培养基以及种子培养基、发酵培养基的具体培养过程如下。
斜面培养基培养使用质量浓度为30 g/L的淀粉水解液与质量浓度为5 g/L的蛋白胨、质量浓度为0.5 g/L的K2HPO4·3H2O与MgSO4·7H2O、质量浓度为16 g/L的琼脂,通过消前调整pH值为7.0进行培养试验;种子培养基的培养采用质量浓度为10 g/L的淀粉与质量浓度为20 g/L的甘油、质量浓度为20 g/L的黄豆饼粉、质量浓度为2 g/L的CaCO3,通过消前调整pH值为6.8进行培养形成;发酵培养基培养按照质量浓度为40 g/L淀粉的水解液、质量浓度为30 g/L的葡萄糖、质量浓度为5 g/L的黄豆饼粉、质量浓度为10 g/L的酵母粉、质量浓度为5 g/L的谷氨酸钠与质量浓度为0.1 g/L的FeCl3·6H2O、质量浓度为1 g/L的NH4Cl与K2HPO4·3H2O、质量浓度为3 g/L的CaCO3,通过消前调整pH值为6.8进行培养形成。
1.2 样品制备
对发酵液进行离心处理约15 min后,提取上清液,与1 mL水、2 mL乙腈进行充分混合后,再进行离心处理约15 min,并提取上清液采用微孔滤膜进行过滤后,作为试验样品溶液进行备用,同时精密量取阿卡波糖对照品后,加入是适量水后制成对照品溶液,确保对照品溶液的标准质量浓度为800 μg/mL,以进行实验分析使用。
1.3 色谱条件
实验中,HPLC色谱法按照色谱柱4.6 mm×2.5 mm,5 μm;流动相为物质的量浓度为0.01 mol/L的磷酸缓冲液-乙腈(其中,磷酸缓冲液pH值为7.0,乙腈为27∶43);检测波长为210 nm,流速为0.8 mL/min;进样量保持为20 μL,柱温设置为35 ℃的条件进行检测分析。
此外,对发酵液中还原糖以及总糖含量测定,采用3,5-二硝基水杨酸比色法进行检测分析,具体方法为量取5 mL发酵液,5 mL的物质的量浓度为5 mol/L的盐酸在沸水中坐浴约15 min完成水解后,进行测量分析。对氨基氮检测采用甲醛法进行。
2 实验方法及结果
2.1 诱变方法
对UV和亚硝基胍的复合诱变通过在出发菌株斜面进行菌丝刮取,并装置在玻璃珠的无菌试管内,然后把质量分数为0.9%的氯化锂溶液加入,通过振荡分散制成菌丝悬浮液后,提取5 mL放置在无菌平皿中,采用紫外线照射方式,以30 W、20 cm的照射距离在254 nm的波长下进行照射约2~5 min后,进行诱变后的菌丝悬浮液收集,并进行离心处理约15 min后倾掉上清液,与1 mL的质量浓度为1 mg/mL的亚硝基胍溶液进行混合,在0~4 ℃温度条件下进行处理40~60 min,并进行离心处理,使用无菌水进行洗涤沉淀2次,以进行试验分析备用。
进行硫酸二乙酯诱变处理,按照将硫酸二乙酯原液使用物质的量浓度为0.1 mol/L的硫酸缓冲液进行配制形成质量分数为2%的试验溶液,然后提取5 mL菌丝悬浮液与5 mL的质量分数为2%的硫酸二乙酯溶液进行混合,在28 ℃条件下按照220 r/min速率进行振荡处理40~60 min后,加入0.5 mL的质量分数为2%的硫代硫酸钠溶液进行终止反应,最后经离心处理后使用无菌水进行洗涤沉淀2次,以进行试验分析备用。
亚硝酸诱变处理中,将物质的量浓度为0.1 mol/L的亚硝酸钠作为诱变剂,进行诱变处理40~60 min后,通过离心处理并使用无菌水进行洗涤沉淀2次,用于试验分析备用。
2.2 突变株筛选
根据上述诱变方式,将进行诱变处理后的菌丝悬浮液均匀地涂在分离平板上,在28 ℃温度条件下培养5~10 d后,以菌落形态变化较为明显的突变株与装有30 mL种子培养基的摇瓶进行接入,在28 ℃条件下按照220 r/min速率进行振荡后培养2 d,然后按照5%的接种量与装有150 mL的发酵培养基摇瓶进行接入,按照260 r/min速率在28 ℃条件中进行培养6 d,完成后,即可按照上述HPLC色谱条件进行阿卡波糖发酵单位及其组分含量测定分析。
需要注意的是,通过上述方法对出发菌株游动放线菌LA-H6的阿卡波糖发酵单位进行测量分析显示高于2 110 μg/mL,并且在对游动放线菌进行UV-亚硝基胍复合诱变与二次筛选处理后,所得到的高产突变株,其阿卡波糖发酵单位达到质量浓度2 510 μg/ mL以上,同时,该突变株进行阿卡波糖发酵生产过程中后期会生成杂质组分A与C,并且杂质组分A与C的含量较多。根据这一情况,通过将上述筛选获取的突变株(即UN-26)作为出发菌,进行诱变分析与筛选处理后,再次获得阿卡波糖纯度较高的突变株,即高产突变株(SIPI-AK),该突变株的阿卡波糖发酵生产单位达到质量浓度2 850 μg/ mL以上,与游动放线菌相比,提升约36%,且在阿卡波糖发酵生产中杂质组分A生成含量非常低,同时杂质组分C含量也明显降低,降低比率达到80%左右。
2.3 工艺优化
根据上述实验分析结果,以高产突变株(SIPI-AK)作为出发菌,按照10 L发酵罐发酵工艺进行试验分析,在以生长良好的斜面与种子培养基进行接种,并按照28 ℃温度条件下,以220 r/min速度进行振荡培养44~48 h后,提取种子液按照5%的接种量与装有发酵培养基的10 L发酵罐进行接种培养。其中,罐压设置在0.07~0.13 MPa范围内,搅拌速率设定为300~600 r/min,通气量为300~400 L/h进行发酵生产,并且在发酵培养48 h后隔24 h进行葡萄糖、麦芽糖以及氨基氮含量检测,并结合检测结果进行流加谷氨酸钠、葡萄糖、麦芽糖。
结果显示,在发酵周期为8 d情况下,在流加谷氨酸钠且氨基氮维持在质量浓度为0.14 mg/mL和0.18 mg/mL的发酵罐中,其阿卡波糖发酵单位无明显差异。而在流加谷氨酸钠且氨基氮维持在质量浓度为0.14 mg/mL的发酵罐中,其阿卡波糖发酵生产杂质组分C含量最低。
图1为阿卡波糖产生菌选育、发酵生产中,对补料添加不同氮源的影响分析结果。根据该结果可以看出,补料中添加谷氨酸钠效果最明显,因此,上述在对其工艺优化分析中采用流加谷氨酸钠。
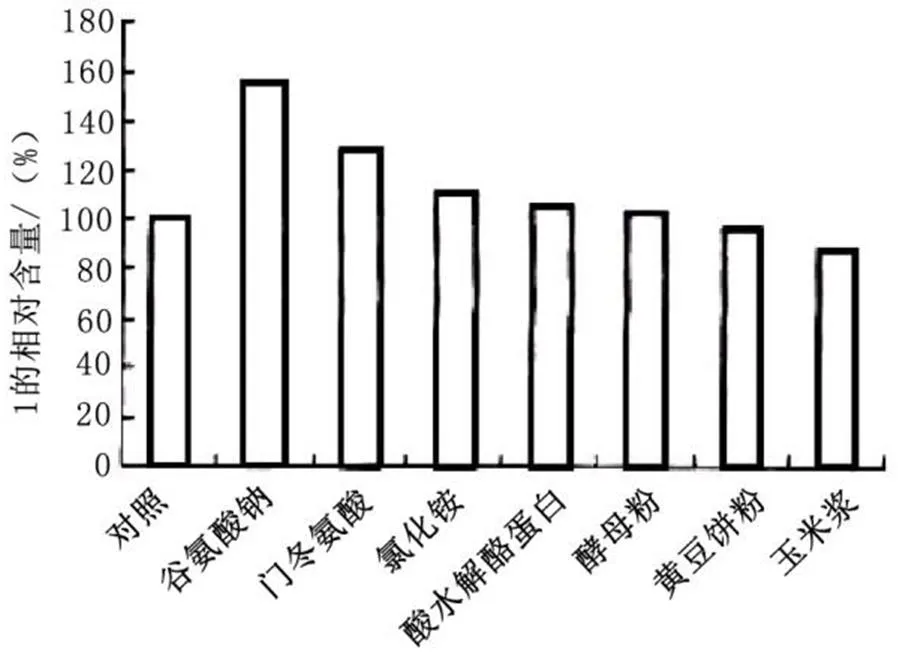
图1 阿卡波糖选育发酵中补料添加不同氮源的影响结果
3 结束语
综上所述,对阿卡波糖产生菌的选育和发酵工艺优化进行研究,有利于为阿卡波糖选育与发酵实践提供参考,促进其发酵生产质量和效果提升,具有较大的作用和意义。
[1]梅建凤,蔡少芬,李靓,等.高产舍雷肽酶的粘质沙雷氏菌诱变选育[J].食品与发酵工业2018(02):1-7.
[2]龙尾,汤卫华,吕春晖,等.L-丝氨酸产生菌的选育及发酵条件优化的研究[J].科技创新与应用,2017(10):77.
2095-6835(2018)18-0134-02
TQ463.2
A
10.15913/j.cnki.kjycx.2018.18.134
〔编辑:张思楠〕

