沙眼衣原体LpxA蛋白的表达、纯化及多克隆抗体的制备
李德坤,余锦强,邵 杰,汪 艳,刘珍凯,周贵春,穆迎涛
(湖北医药学院附属人民医院 眼科·十堰市人民医院 眼科中心,湖北 十堰442000)
沙眼感染性致盲的主要因素之一。随着卫生条件的改善,目前发达国家及地区沙眼的发病率已经非常低,但是在我国以及亚州、非州和拉丁美洲等一些落后地区沙眼患者的数量依旧仍旧居高不下[1,2]。沙眼的病原菌是沙眼衣原体(Chlamydia trachomatis,Ct),Ct是一种具有独特二相发育周期、细胞内寄生的革兰阴性细菌[3,4]。调查发现A、B和C等血清型Ct极其容易感染眼部,从而导致沙眼,D-K型容易感染泌尿生殖道,导致尿道炎、盆腔炎和阴道炎等疾病,开展Ct的致病机制研究具有重要的现实意义[5]。
已有研究证实Ct的质粒蛋白、热休克蛋白、主要外膜蛋白,和III型分泌蛋白等多种蛋白都可能参与了致病过程[6-8]。研究发现Ct与其他革兰阴性细菌一样,其外膜也含有大量的糖脂(Lipopolysaccharide,LPS)和脂蛋白。LPS一般是由脂质A、O-抗原和核心区所组成。LPS具有活化补体和刺激机体释放血管活性物质等作用,在细菌的粘附和侵袭过程中起重要功能[9,10]。细菌LPS的合成途径十分复杂,如大肠杆菌能利用LpxA(UDP-N-acetylglucosamine acyltransferase,LpxA)蛋白催化O-酰基加入到尿苷5′-二磷酸-N-乙酰氨基葡萄糖,这个催化反应是脂质A合成途径的第一步[11]。目前衣原体LPS的合成途径尚缺乏研究,我们在前期扩增得到Ct LpxA基因。本文拟通过基因工程的方法纯化得到His-LpxA蛋白,然后将其免疫新西兰兔,获得了抗His-LpxA蛋白的血清,为进一步研究Ct LPS的合成途径提供实验基础。
1 材料与方法
1.1菌种、载体和实验动物
大肠杆菌DH5α、BL21、含LpxA基因的重组质粒pMD18-LpxA,原核表达载体pET28a都由湖北医药学院保存,实验用动物新西兰兔购自广东省医学实验动物中心。
1.2主要试剂和仪器
胶回收试剂盒、质粒DNA提取试剂盒、ExTaq酶、限制性内切酶NdeⅠ、XhoⅠ和T4 DNA连接酶及均购自大连Takara公司,BCA蛋白定量试剂盒购自北京百泰克公司,辣根过氧化物酶标记的羊抗兔IgG抗体购自美国 Jackson ImmunoResearch Laboratories Inc公司,ECL发光剂购自英国Amersham,弗氏佐剂购自Sigma公司产品。Ni2+层析凝胶购自北京康为世纪生物科技有限公司;冷冻高速离心机(Microfuge 20R)购自美国贝克尔曼;超声波破碎仪(scientz-950E)购自宁波新芝、超低温冰箱和PCR仪购自赛默飞世尔公司;半干电转印仪购自美国Bio-Rad公司。
1.3引物设计及合成
根据LpxA基因序列,使用primer primer6软件设计引物,上游引物序列为:5′-CCCATATGACCAACATTCATCCTACA-3′(下划线为NdeⅠ酶切位点)和下游引物序列为:LpxA-R:5′-TTCTCGAGTTACTAAGACTCAACGAAAGCTCCT- 3′(下划线为XhoⅠ酶切位点)。
1.4LpxA基因的扩增及回收
以重组质粒pMD18-LpxA为PCR模板,扩增目的基因,PCR程序为:94 ℃,5 min;(94 ℃,30 s,58 ℃,30 s,72 ℃,1 min)* 35个循环;72 ℃,5 min,然后用琼脂糖凝胶电泳将PCR产物电泳,回收目的DNA片段。
1.5重组表达质粒的构建
将pET28a空质粒和LpxA基因进行双酶切,回收。然后使用T4 DNA连接酶将LpxA和pET28a在16 ℃下过夜连接。将连接产物转化大肠埃希菌DH5α,37 ℃倒置,培养16 h。挑取阳性单菌落到LB液体培养基中培养12 h,提取质粒使用PCR验证,将PCR呈阳性的细菌送上海生工公司进行测序验证。
1.6重组蛋白的诱导表达与纯化
将pET28a-LpxA转化大肠埃希菌BL21。第二天挑阳性菌接种到LB培养基培养过夜,然后将其按照1∶100扩接到新LB液体培养基;当细菌长到OD600约为0.6时,加入0.1 mmol/L IPTG到培养液,置于28 ℃培养,诱导细菌表达重组His-LpxA蛋白,培养4 h后收集细菌。利用pH值为7.4的PBS溶液洗涤,然后在冰上进行超声破碎。使用12 000 r/min离心20 min,取上清加入Ni2+层析凝胶,孵育1 h,然后使用40 mmol/L咪唑洗脱杂蛋白,最后用250 mmol/L咪唑洗脱目的蛋白并收集,使用SDS-PAGE检测纯化效果。
1.7兔抗His-LpxA蛋白多抗的制备
将纯化好的His-LpxA蛋白与完全弗氏佐剂乳化,背部皮下多点注射接种新西兰兔,每只兔接种200 μg,接种3只。三星期后,将His-LpxA蛋白与弗氏不完全佐剂乳化,然后每只兔背部皮下接种200 μg,进行第二次免疫。第三,四次免疫方法和步骤与第二次相同。同时设置注射生理盐水组为阴性对照。最后一次免疫2个星期后心脏处死采血,分离血清并将其保存在-20 ℃冰箱备用。
1.8抗血清的特异性和效价检测
取纯化好的His-LpxA进行 SDS-PAGE凝胶电泳,然后以100 V恒电压将蛋白转至PVDF膜上,5%脱脂牛奶封闭后,加入致备好的抗血清,4 ℃孵育过夜,洗涤干净。加入HRP标记的羊抗兔二抗,室温孵育1 h,洗涤干净后加入加底物进行显色,显影后观察结果。
将150 ng的His-LpxA蛋白包被到96孔板,4 ℃包被过夜。加入封闭液封闭2 h。将血清进行1∶40,1∶80,1∶160,1∶320……1∶40 960倍比稀释,然后每孔加入100 μl,以未免疫血清为阴性对照,同时设置PBS溶液为空白对照。室温孵育2 h,洗涤干净后加入1∶1000稀释的HRP标记羊抗兔IgG,室温孵育反应2 h。加入显色剂显色,10 min后加入终止液终止反应,并测定其OD450,计算血清效价。
2 结果
2.1表达载体的构建
以pMD18-LpxA为PCR为模板,PCR扩增得到的Ct LpxA基因大小为840 bp(图1A),与理论大小相符。将其连接到pET28a载体获得重组质粒pET28a-LpxA,使用PCR检测pET28a-LpxA,也得到与LpxA基因理论分子量大小相同的条带(图1B)。测序结果显示其序列与LpxA基因一致,表明成功构建重组质粒pET28a-LpxA。
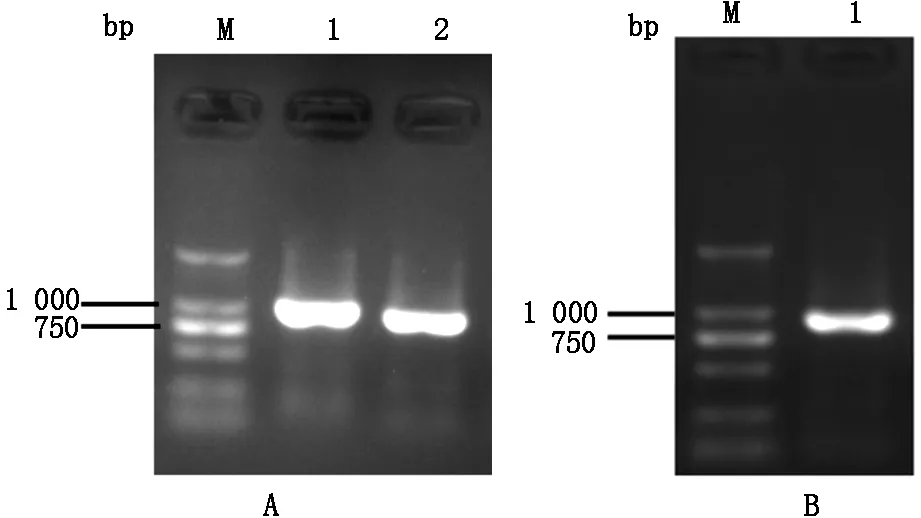
注:M:Marker; 1,2:LpxA基因扩增产物
2.2His-LpxA蛋白的表达及纯化
将重组质粒pET28a-LpxA转化到大肠杆菌表达菌BL21,培养后使用0.1 mmol/L IPTG诱导His-LpxA融合蛋白表达。电泳后发现与对照相比,重组菌在32.8kDa左右有蛋白表达,与His-LpxA蛋白的理论分子量一致(图2,泳道2)。经Ni2+层析柱纯化得到LpxA蛋白,其纯度约为95%(图2,泳道3)。
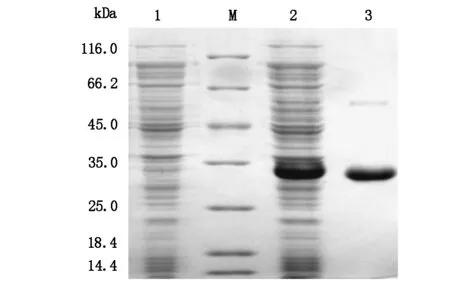
注:M:蛋白marker;1:转化pET28a的诱导产物;2:重组菌BL21/ pET28a-LpxA 的诱导产物:3:经Ni2+层析柱纯化后的His-LpxA蛋白
2.3制备的多克隆抗体可识别His-LpxA蛋白如图3所示,制备的多克隆抗体能够识别重组His-LpxA蛋白。
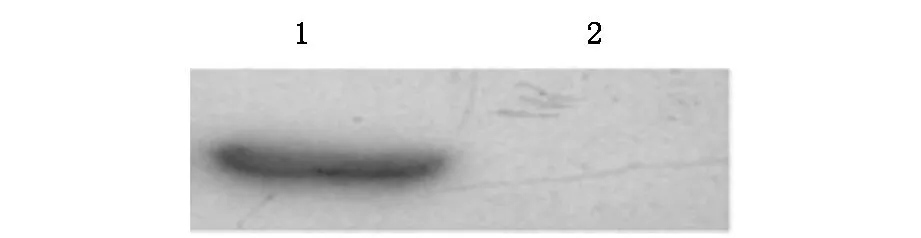
图3 制备的多克隆抗体能识别His-LpxA蛋白
2.4LpxA抗血清效价如图4所示,使用ELISA测定对照组和免疫组新西兰兔血清多克隆抗体的滴度,4次免疫后,将实验组血清血清稀释10 240倍后为阳性(图4),表明获得血清的滴度大于1∶10 240,成功制备抗血清。
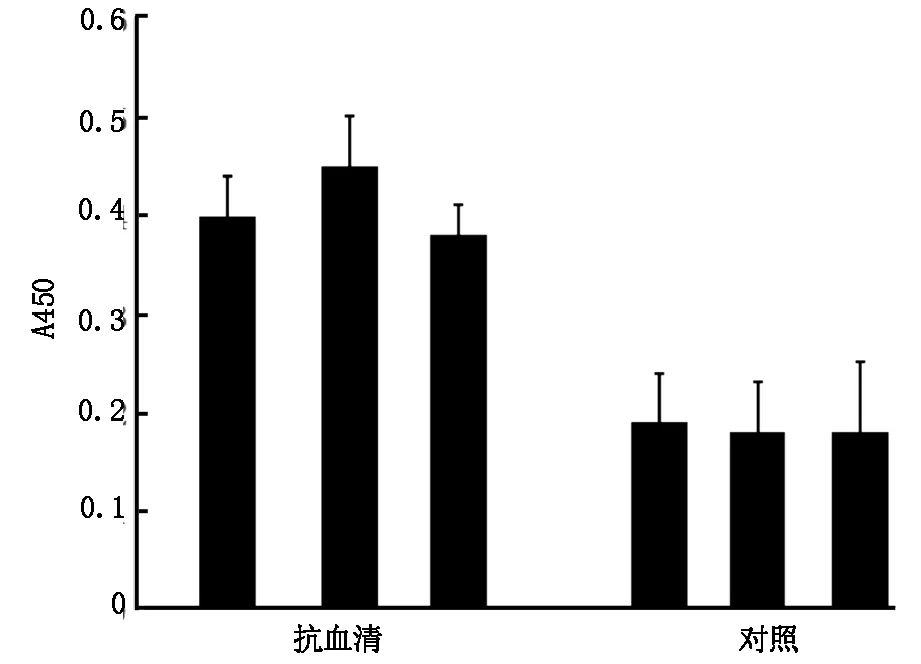
图4 ELISA检测LpxA蛋白免疫新西兰兔后血清
3 讨论
LPS是革兰阴性细菌的毒力因子之一,对大多数的革兰阴性细菌的活性极为重要,研究发现革兰阴性细菌中至少有6个基因参与了脂质A的合成,抑制其中任一基因的活性都会导致细菌的死亡[9]。Ct感染能够导致沙眼和生殖道等多种疾病 近年来研究证实LPS是Ct的EB发育过程中必不可少的成分,如果抑制Ct脂质A合成酶的活性,阻止Ct合成LPS,会导致具有感染活性的EB会失去感染能力[10,12]。LpxA基因是催化合成脂质A的第一个关键基因,它能够将O-酰基转移到尿苷5'-二磷酸-N-乙酰氨基葡萄糖。现在针对细菌的LpxA蛋白开发新型抗生素,LpxA蛋白有望成为控制Ct传染的靶点之一[11,13,14]。
获得高纯度的LpxA蛋白为研究Ct中脂质A合成途径提供实验基础。His标签具有分子量小,免疫原性低和与Ni2+亲和力高等特点,现在广泛用于纯化外源融合蛋白[15]。本研究将LpxA基因连接到pET28质粒,得到的重组质粒能够表达含His标签的融合蛋白。将重组质粒转化到表达菌大肠杆菌BL21,使用IPTG诱导大肠杆菌表达融合蛋白,然后我们再用Ni2+亲和法对纯化目的蛋白,得到较好纯度的融合蛋白。我们使用纯化得到的融合蛋白免疫新西兰兔,得到抗LpxA蛋白的血清,发现其效价高都于1∶10 240,说明纯化得到的融合蛋白能够诱导新西兰兔产生高效价的抗体,为进一步研究LpxA蛋白功能提供基础。
——一道江苏高考题的奥秘解读和拓展

