基于倾向性评分匹配法比较培美曲塞或多西他赛联合顺铂治疗Ⅳ期肺腺癌的临床疗效
刘凌枫 耿一超 欧阳伟炜 马筑 李青松 李梅 王羽 罗大先 杨文刚 苏胜发 何志旭 卢冰
作者单位:550004 贵阳 1贵州医科大学附属医院 贵州省肿瘤医院胸部肿瘤科,2贵州医科大学肿瘤学教研室,3贵州医科大学组织工程及干细胞研究中心
肺癌已成为我国发病率和死亡率最高的恶性肿瘤,其中非小细胞肺癌(non-small cell lung cancer,NSCLC)约占 85%[1-2],肺腺癌是 NSCLC 最常见的病理类型[3],初诊时约60%的NSCLC已发生远处转移[4]。约80%的晚期NSCLC患者表皮生长因子受体(epidermal growth factor receptor,EGFR)突变状态未知或阴性[5]。目前,化疗仍是NSCLC的首选治疗方案,吉西他滨或紫杉类联合铂类方案较常用[6]。Scagliotti等[7]研究显示,在晚期肺腺癌一线治疗中,培美曲塞+顺铂的疗效优于吉西他滨+顺铂,且毒副反应更轻。指南亦推荐培美曲塞+顺铂或多西他赛+顺铂用于晚期肺腺癌的一线治疗[8]。但目前比较培美曲塞+顺铂与多西他赛+顺铂疗效和安全性的研究较少。本研究回顾性分析培美曲塞或多西他赛联合顺铂治疗EGFR突变状态未知Ⅳ期肺腺癌患者的临床资料,利用倾向性评分匹配法(propensity score matching,PSM)比较两种化疗方案的疗效和安全性,以期为该病的临床诊治提供参考。
1 资料与方法
1.1 研究对象
选取2011年1月~2015年12月就诊于贵州医科大学附属医院和贵州省肿瘤医院经病理或细胞学检查确诊为肺腺癌的患者为研究对象。纳入标准:(1)TNM分期(UICC 2009分期)为Ⅳ期,EGFR突变状态未知或阴性;(2)初治患者;(3)年龄 18~75 岁;(4)KPS评分≥70分;(5)一线治疗采用培美曲塞+顺铂或多西他赛+顺铂方案,至少完成2个周期化疗,不超过6个周期;(6)未接受维持治疗;(7)截至末次随访时间未接受表皮生长因子酪氨酸激酶抑制剂或抗肿瘤血管生成治疗。排除标准:(1)妊娠或哺乳期妇女;(2)合并其他恶性肿瘤。本研究经贵州医科大学附属医院伦理委员会审批通过,患者均签署知情同意书。
1.2 治疗方法
培美曲塞+顺铂方案(PP组):培美曲塞500 mg/m2,静脉滴注,d1;顺铂 75 mg/m2,静脉滴注,d2,21~28 d为1个周期。多西他赛+顺铂方案(DP组):多西他赛60~70 mg/m2,静脉滴注,d1;顺铂 75 mg/m2,静脉滴注,d2,21~28 d为1个周期。两组中每位患者化疗总周期数不超过6个周期,化疗结束后不行维持治疗,按照培美曲塞和多西他赛的药物说明书进行预处理。
1.3 疗效及毒副反应评价
采用实体肿瘤疗效评价标准(RECIST1.1)进行疗效评价。完全缓解(CR):所有目标病灶消失,无新增病灶,至少维持4周;部分缓解(PR):靶病灶长径总和缩小≥30%,至少维持4周;疾病进展(PD):靶病灶长径总和增加≥20%或出现新病灶(若仅1个靶病灶的最长径增大≥20%,但记录的靶病灶长径总和未达20%,不评价为PD);疾病稳定(SD):靶病灶长径总和缩小但未达PR或增加但未达PD;客观缓解率(objective response rate,ORR)以 CR+PR 计算;疾病控制率(disease control rate,DCR)以 CR+PR+SD 计算。首要终点为总生存期(overall survival,OS),定义为从患者治疗开始直至死亡或末次随访的时间;次要终点为无疾病进展生存期(progression-free survival,PFS),定义为从患者治疗开始直至出现疾病进展或死亡的时间。安全性评价根据通用不良事件术语标准3.0版(CTCAE v3.0)进行评价。
1.4 统计学方法
采用 SPSS 21.0(SPSS Inc,Chicago,IL)软件进行数据分析。正态分布的计量数据采用均数±标准差(±s)表示,组间比较采用独立样本t检验;非正态分布的计量资料用M(QR)描述,组间比较采用Mann-Whitney U检验;计数资料组间比较采用χ2检验。采用Kaplan-Meier法计算生存率,组间比较使用Log-rank检验,将基线特征变量引入Cox回归模型行多因素预后分析。PSM过程利用SPSS的PSM扩展程序实现,采用1∶1最近邻居匹配法(PP组为基准组)进行匹配。以双侧P<0.05为差异有统计学意义。
2 结果
2.1 两组患者一般资料比较
共147例患者符合标准纳入研究,其中男性100例,女性47例;年龄30~75岁,中位年龄58岁。PSM分析显示,共匹配成功45对,匹配后两组患者一般资料的均衡性提高。见表1。

表1 两组患者倾向性评分匹配前后一般资料比较[n(%)]
2.2 两组患者近期疗效比较
倾向性评分匹配前,PP组的CR、PR、SD和 PD率分别为 2.2%、58.7%、26.1%和13.0%,DP组分别为1.1%、47.2%、24.7%和26.7%;PP组和 DP组的ORR分别为60.9%和 48.3%(χ2=1.917,P=0.166);DCR 分别为 87.0%和 73.0%(χ2=3.401,P=0.065)。倾向性评分匹配后,PP组的CR、PR、SD和PD率分别2.2%、57.8%、26.7%和13.3%,DP组分别为2.5%、57.5%、22.5%和17.5%;PP 组和 DP 组的 ORR 均为 60%(χ2<0.001,P>0.999);DCR 分别为 86.7%和 82.5%(χ2=0.284,P=0.594)。
2.3 不同化疗方案与总生存率和无进展生存率的关系
倾向性评分匹配前,DP组中位OS为9.0个月(95%CI:7.6~10.4),PP 组为 17.0 个月(95%CI:13.2~20.8),差异有统计学意义(χ2=6.433,P=0.011),见图1A;DP 组中位 PFS为 5.0个月(95%CI:4.2~5.8),PP组为 8.0 个月(95%CI:4.4~11.7),差异有统计学意义(χ2=7.333,P=0.007),见图1B。倾向性评分匹配后,DP组中位OS为9.0个月(95%CI:7.1~10.8),PP 组为 17.0个月(95%CI:13.2~20.7),差异有统计学意义 (χ2=4.411,P=0.036),见图 1C;DP 组中位 PFS 为 5.0个月(95%CI:4.1~5.9),PP 组为 8.0 个月(95%CI:3.8~12.2),差异亦有统计学意义(χ2=4.299,P=0.038),见图 1D。
2.4 不同化疗方案与预后因素的关系
以OS为终点作预后分析,倾向性评分匹配前Cox回归分析显示,PP组死亡风险较DP组降低42.1%(HR=0.579,95%CI:0.387~0.867,P=0.008);倾向性评分匹配后Cox回归分析显示,PP组死亡风险较 DP 组降低 52.4%(HR=0.476,95%CI:0.282~0.805,P=0.006)。见表 2。
2.5 两组患者毒副反应比较
倾向性评分匹配前后,PP组Ⅲ~Ⅳ级中性粒细胞减少发生率均低于DP组,差异有统计学意义(P<0.05),见表3。全组无Ⅴ级毒副反应发生。

图1 倾向性评分匹配前后不同化疗方案与总生存期和无疾病进展生存期的关系
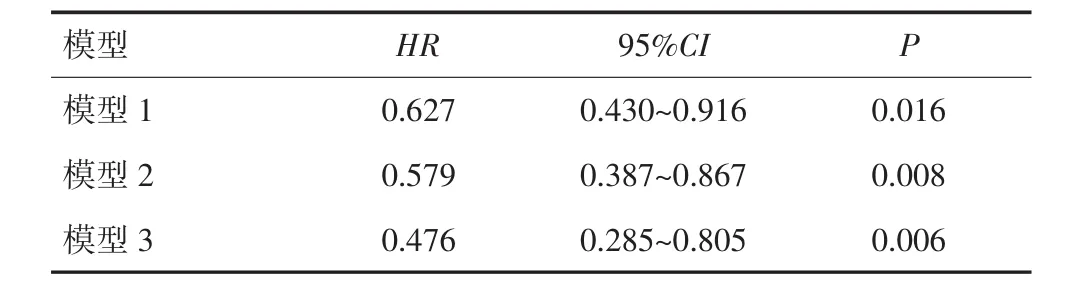
表2 不同化疗方案与患者OS的相关性分析*
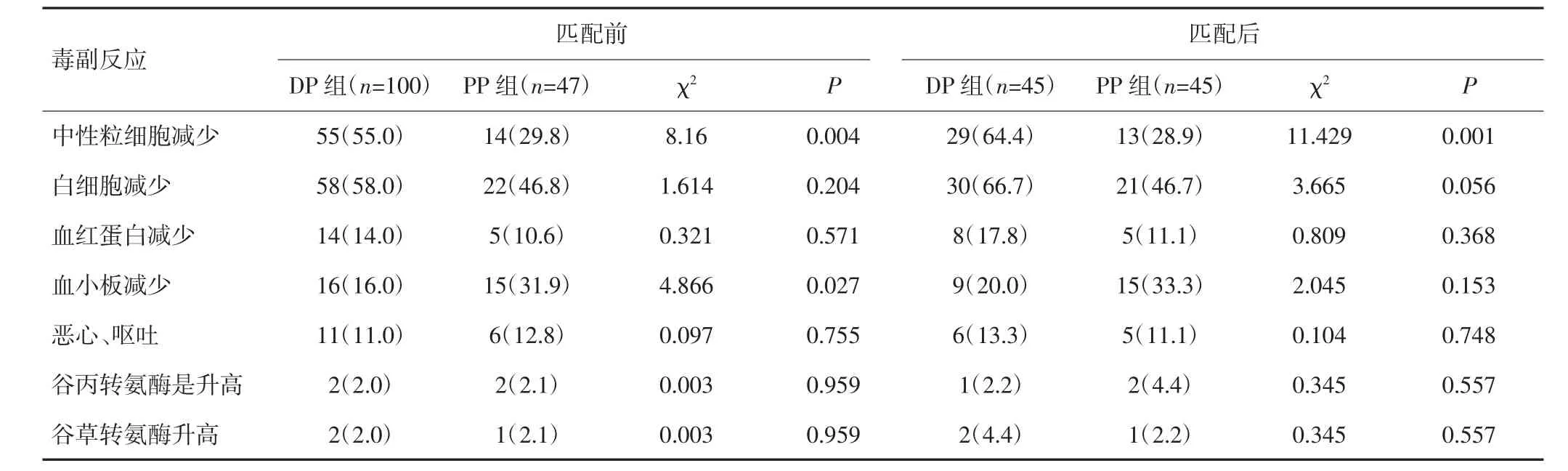
表3 两组患者倾向性评分匹配前后Ⅲ~Ⅳ级毒副反应比较[n(%)]
3 讨论
对于EGFR、ALK等驱动基因阴性或状态未知的晚期NSCLC患者,以铂类为基础的两药化疗方案仍是标准治疗方案[8]。在晚期NSCLC一线治疗中,吉西他滨、多西他赛联合铂类是最常用的含铂类两药联合化疗方案,其中培美曲塞是肺腺癌最常用的方案[9-10]。研究表明,晚期肺腺癌患者PP方案较吉西他滨+顺铂(GP)方案疗效更好,且毒副反应更低[7]。目前晚期肺腺癌中,比较培美曲塞或多西他赛联合顺铂的疗效和安全性的研究较少,尤其是前瞻性随机研究。采用PSM法校正选择偏倚及重要预后因素的观察性研究是随机研究的有益补充[11]。本研究通过PSM法探讨PP方案与DP方案在EGFR突变状态未知Ⅳ期肺腺癌中的疗效和安全性。首先采用PSM法对DP组和PP组患者资料进行匹配,结果共45对匹配成功。经倾向性匹配后,两组各协变量的均衡性提高,为更好地观察预后提供可靠依据。
在近期疗效观察中,发现两组患者ORR和DCR差异无统计学意义,说明两种方案疗效相当。进一步随访观察远期疗效,DP组和PP组中位OS分别为9.0 个月和 17.0 个月,中位 PFS 分别为 5.0 个月和 8.0个月,PP组的总生存期及无疾病进展生存期均较DP组延长,Cox回归模型分析亦发现PP组死亡风险显著下降。其中,DP组中位OS与ECOG1594研究中DP方案化疗的中位 OS(7.4个月)相当[6];而 PP 组的中位OS与Yang等[12]研究东亚人群应用培美曲塞+顺铂一线治疗的中位OS(17.1个月)相似。本研究均为EGFR突变未知患者,这些患者中EGFR敏感突变率约为50%,而培美曲塞对EGFR敏感突变的肺腺癌患者疗效更好[13],可能是PP组疗效更佳的原因。
化疗的毒副反应,尤其血液学毒性是评价化疗方案优劣的主要关注点,既往研究表明培美曲塞较其他化疗药物在毒副反应方面的优势亦主要体现在血液学毒性方面。本研究中,PP方案较DP方案具有减轻中性粒细胞毒性的优势,血红蛋白和血小板毒副反应发生率相当,与TRAIL研究结果相似[14]。说明PP方案具有较好安全性。
综上,在EGFR突变状态未知的Ⅳ期肺腺癌中,培美曲塞+顺铂化疗方案较多西他赛+顺铂化疗方案的临床疗效和预后更好。但本研究亦存在以下不足:(1)样本量较少;(2)本研究为回顾性研究,不可避免存在选择偏倚,PSM虽然均衡了两组对预后有重要影响的可观测因素,但不能均衡潜在的未知混杂因素;(3)未比较过敏反应、疼痛、脱发等毒副反应。因此有关结论尚需进一步研究。

