miR-182通过HES1调控宫颈癌耐放疗细胞株的上皮间质转化
李睿歆 谢庆生 王丽娟 李晶 饶群仙 林仲秋
作者单位:510120 广州 中山大学孙逸仙纪念医院妇科肿瘤专科
放疗适用于各期宫颈癌的治疗,但放疗耐受是导致复发和远处转移的重要因素,严重影响患者预后。在肿瘤发展过程中,上皮细胞表现出间质表型,发生上皮间质转化(epithelial-mesenchymal transition,EMT),使肿瘤细胞离开原发灶形成转移[1]。文献报道EMT在多种恶性肿瘤的放疗耐受中发挥作用[2-4]。miRNA是一类广泛参与肿瘤发生、发展各个环节的非编码RNA[5-6]。其中miR-182在肿瘤的EMT、转移及放疗耐受中均发挥作用[7-10]。其在宫颈癌原发灶中的表达与肿瘤分期呈正相关[11],发挥类似癌基因作用。发状分裂相关增强子1(hairy and enhancer of split 1,HES1)是Notch通路下游分子,受miRNA、泛素化等多种方式调控[12-14],同时参与EMT及放疗敏感性调控[15-17]。本课题组前期研究建立体外宫颈癌耐放疗模型[4],发现HES1可抑制宫颈癌HeLa和SiHa细胞迁移和侵袭,且可逆转EMT[18]。在甲状腺癌中,miR-182通过抑制HES1表达发挥促转移作用[19],但其在宫颈癌中是否存在类似机制尚不清楚。本研究探讨miR-182在宫颈癌耐放疗细胞株中的作用及其与HES1的调控关系,为宫颈癌耐放疗治疗提供新思路。
1 材料和方法
1.1 主要试剂和仪器
人宫颈癌细胞株HeLa、SiHa购自中科院上海细胞库,MEM培养基、胎牛血清购自以色列BI公司,opti-MEM购自美国Hyclone公司,LiPofectamine 2000试剂购自美国Invitrogen公司,Trizol逆转录试剂盒、SYBERⅡ、聚合酶链反应(PCR)引物购自日本TAKALA公司,HES1、miR-182小干扰RNA购自上海吉玛制药技术有限公司,HES1抗体购自英国Abcam公司,β-actin抗体、EMT抗体购自美国CST公司,Transwell小室(滤膜孔径8 μm)购自美国Corning公司,基质胶购自美国BD公司。SIMENS PRIMUS H型直线加速器购自德国SIMENS公司,BIO-RAD CFX96 Real-Time PCR仪器购自美国Biorad公司。
1.2 方法
1.2.1 宫颈癌耐放疗HeLa、SiHa细胞的构建 HeLa、SiHa细胞置于含10%胎牛血清的MEM培养基,37℃、5%CO2细胞培养箱内培养。按本课题组前期方法[6],通过分割剂量照射法诱导宫颈癌耐放疗HeLa、SiHa细胞,总照射剂量为24 Gy。其中HeLa、SiHa细胞分别每周4 Gy照射1次(HR4和SR4组),共照射6周;每周6 Gy照射1次(HR6和SR6组),共照射4周。各组细胞完成全部照射次数后继续传代培养。
1.2.2 细胞转染 经筛选选取耐放疗HR6细胞进行转染,HES1 siRNA、miR-182 siRNA由上海吉玛制药技术有限公司合成,按siRNA和Lipofectamine 2000说明书,将待转序列HES1 siRNA、miR-182 siRNA或阴性对照序列混合,室温反应5 min后加入6孔板中,48 h后收集细胞提取RNA,RT-qPCR检测miR-182和HES1的表达。以MEM培养基培养的HR6细胞为空白对照组。转染序列:miR-182 siRNA为5'-AGUGUGAGUUCUACCAUUGCCAAA-3',miR-182 siRNA阴性对照为 5'-CAGUACUUUUGUGUAGUACAA-3';HES1 siRNA为5'-CCAACUGCAUGACCCAGAUTT-3',HES1 siRNA阴性对照为5'-AUCUGGGUCAUGCAGUUGGTT-3'。

表1 RT-qPCR引物序列
1.2.3 RT-qPCR检测miR-182和HES1 mRNA的表达常规提取细胞RNA,参照Takara逆转录试剂盒说明书逆转录,反应条件:37℃ 15 min,85℃ 5 s。逆转录为cDNA后,通过Real-Time PCR仪器进行扩增。PCR反应条件:95℃变性5 s,60℃延伸30 s,循环40次。PCR引物序列见表1。U6为miRNA检测内参,GAPDH为mRNA检测内参。RT-qPCR结果分析采用2-ΔΔCt法进行相对定量分析。实验独立重复3次。
1.2.4 Western blot实验检测HeLa、SiHa细胞HES1蛋白的表达 常规提取细胞总蛋白并定量,10%SDS-聚乙酰凝胶电泳,电转至PVDF膜,5%脱脂牛奶封闭1.5 h,加一抗后4℃摇床孵育过夜,山羊抗兔、抗鼠二抗室温孵育2 h,ECL法显影,曝光。β-actin为内参。
1.2.5 Transwell小室法检测HR6细胞的迁移能力分别将HR6组、HR6 SI组(转入miR-182 siRNA)和HR6 NC组(转入siRNA 阴性对照)按8.5×104个/孔加入6孔板中。细胞瞬时转染16 h后,重悬转入24孔板中。200 μL细胞悬液加入上室,600 μL含10%胎牛血清的MEM培养基加入下室。置于培养箱中培养24 h,4%多聚甲醛固定15 min,结晶紫染色10 min,棉签擦去未穿过膜的细胞。显微镜下(×400)计数穿过膜的细胞数。每组实验设3个复孔。
1.2.6 Transwell小室法检测HR6细胞的侵袭能力常规制备上室基质胶后,每孔上室加入含8.5×104个HR6细胞的200μL细胞悬液,下室加入600 μL含20%胎牛血清的MEM培养基,细胞培养48 h后4%多聚甲醛固定15 min,结晶紫染色10 min。上室未穿膜细胞被擦除后计数。每组实验设3个复孔。
1.3 统计学方法
采用SPSS18.0软件进行数据分析。计量数据以均数±标准差(±s)表示。HES1、miR-182、E-cadherin 等表达数据组间比较采用Kruskal-Wallis检验,Slug数据组间比较采用单因素方差分析,若整体差异有统计学意义,进一步的多重比较采用Bonferroni检验;迁移、侵袭实验中的两组数据比较采用独立样本t检验。以双侧P<0.05为差异有统计学意义。
2 结果
2.1 放疗可抑制HES1表达,诱导miR-182表达升高
与未照射宫颈癌HeLa、SiHa细胞比较,耐放疗细胞 HR4、HR6、SR4、SR6中,HES1 mRNA 及蛋白表达均显著受抑制,且随单次放疗剂量增加,HES1受抑制程度逐渐加深(P<0.05),见图1A~D。与未照射宫颈癌SiHa细胞比较,耐放疗SR4细胞中miR-182 mRNA的表达出现明显折点,其表达水平显著高于SR6细胞(P<0.05)。耐放疗HR4细胞中miR-182 mRNA的表达水平与未照射宫颈癌HeLa细胞差异无统计学意义(P>0.05),但在 HR6细胞中表达明显升高(P<0.05),见图1E~F。故本研究选取HR6细胞进行后续实验。
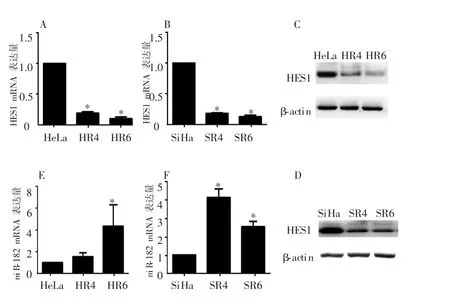
图1 分割放疗对不同宫颈癌HeLa、SiHa细胞HES1及miR-182表达的影响
2.2 下调miR-182表达可抑制细胞迁移、侵袭及EMT
迁移和侵袭实验显示,HR6 SI组的穿膜细胞数均明显少于HR6 NC组(P<0.05)。EMT相关因子检测结果显示,HR6 SI组E-cadherin的mRNA及蛋白表达显著增加,而SlugmRNA及蛋白表达则降低。其中HR6NC组E-cadherin和Slug mRNA及蛋白表达与HR6组比较,差异无统计学意义(P>0.05);而HR6 SI组分别与HR6 NC组和HR6组比较,差异均有统计学意义(P<0.05),见图2。
2.3 HR6细胞中miR-182与HES1相互表达的影响
RT-qPCR和Western blot实验结果显示,分别与HR6 NC组和HR6组比较,HR6 SI组细胞中HES1 mRNA及蛋白的表达均显著升高 (P<0.05),见图3A~B。RT-qPCR实验结果显示,HR6组、HR6 NC组和HR6 SI组细胞中miR-182 mRNA的表达无明显变化,见图3C。
3 讨论
放疗是宫颈癌重要的治疗手段之一,而放疗耐受是治疗失败的主要原因。有研究显示肺癌、结肠癌放疗后HES1表达受抑制[17-20]。在人胰腺癌细胞株(PANC-1、SW1990、MIA、PaCa-2)中,随放射剂量增加,HES1 表达水平亦逐渐降低[21]。本研究采用本课题组前期在体外构建宫颈癌耐放疗模型方法[4],通过单剂量分割放疗建立宫颈癌耐放疗细胞 HR4、HR6、SR4、SR6,结果发现,与未照射宫颈癌HeLa、SiHa细胞比较,4株耐放疗细胞中HES1的表达均降低,而miR-182表达均升高,推测miR-182和HES1可能参与宫颈癌的放疗耐受。
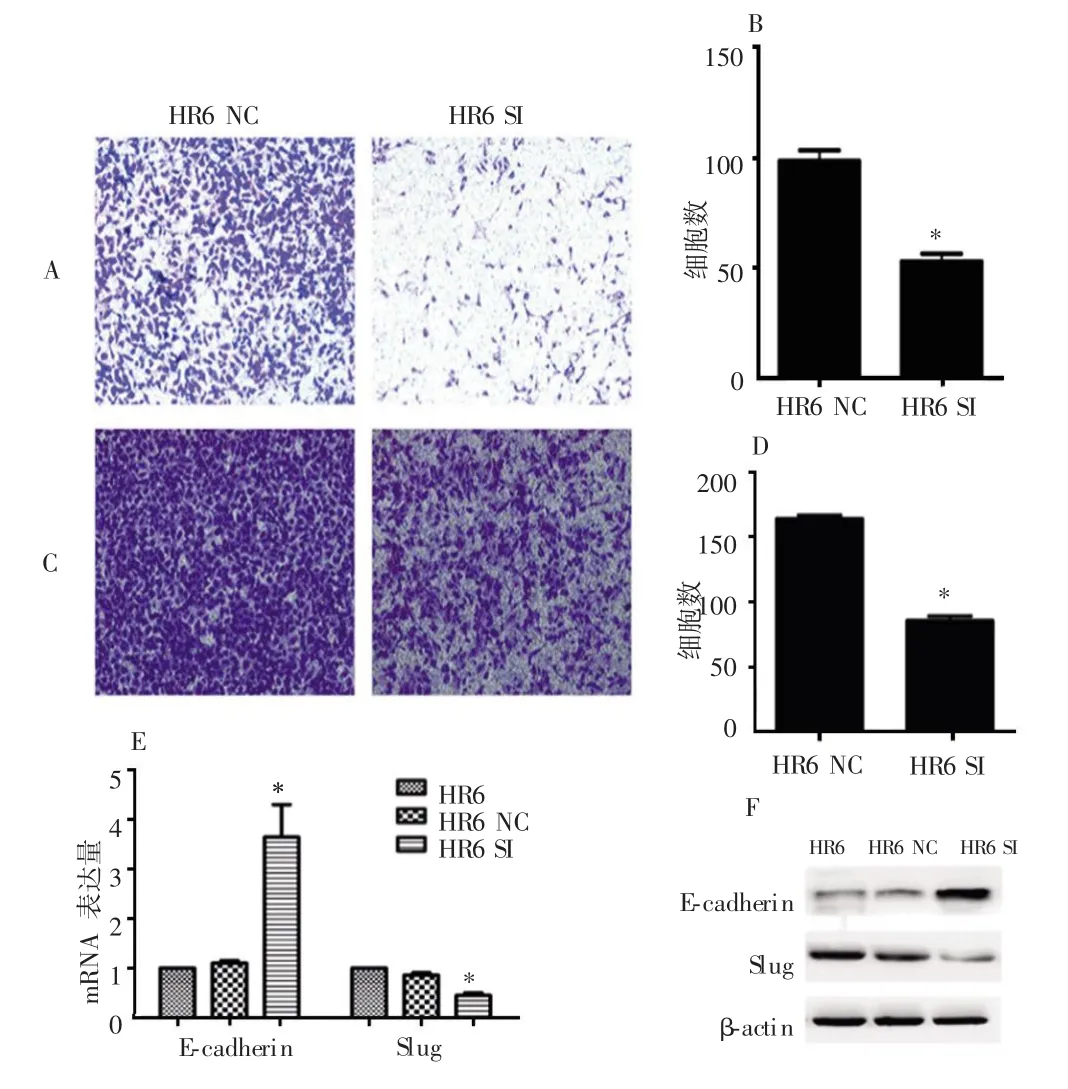
图2 下调miR-182对HR6细胞转移能力及EMT相关因子的影响
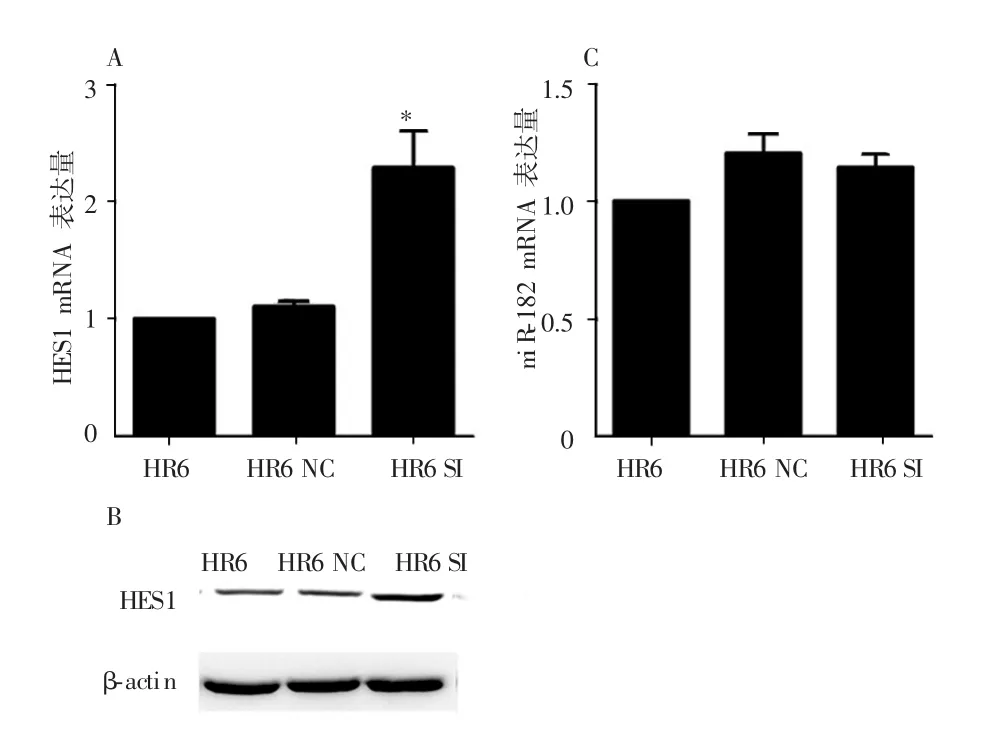
图3 HR6细胞中miR-182与HES1相互表达的影响
本研究还发现,与未照射的宫颈癌HeLa细胞比较,HR6细胞中miR-182表达显著升高,但在HR4细胞中其表达差异不大。而在SiHa细胞中,放疗亦诱导了miR-182表达,但其表达水平峰值出现在单次放疗剂量为4 Gy的细胞中,即SR4细胞,目前原因不明。有研究观察毛细血管共济失调患者和健康捐赠者T淋巴细胞中miR-182的表达,单剂量2 Gy照射后,miR-182表达峰值出现在24 h时,且2名健康捐赠者峰值有所不同[22]。综合本研究结果及文献,认为miR-182对放疗的反应可能不仅有剂量依赖性,亦可能存在时间依赖性和个体差异性,这亦可能是不同单次照射剂量及不同细胞株中miR-182表达存在差异的原因。综上,鉴于本课题组前期研究发现HR6的放疗耐受性最强,并结合本研究结果,故选择HR6进行后续实验。
目前研究认为EMT与多种恶性肿瘤放疗耐受相关。在胰腺癌耐放疗细胞株中,E-cadherin表达降低,Vimentin表达升高,且细胞形态发生改变[2]。食管癌中,放疗诱导的E-cadherin下调和N-cadherin上调被认为是导致耐放疗的原因[3]。研究发现沉默miR-182可诱导上皮标志物CDH1,抑制间质标志物CDH2,从而逆转TGF-β诱导的EMT和转移[7]。Zhang等[23]研究显示,miR-182可诱导Vimentin和FN1表达,抑制E-cadherin,从而促进乳腺癌MCF-7和T47D细胞的EMT和侵袭。但目前,在宫颈癌耐放疗细胞中下调miR-182是否亦发挥抑制EMT作用尚未知。本研究采用RNAi技术下调HR6细胞中miR-182的表达,结果发现,下调后上皮细胞标志物E-cadherin表达增强,而间质细胞标志物Slug表达减弱,提示在HR6细胞中下调miR-182可能抑制EMT。
有文献报道在甲状腺髓样癌中,miR-182可靶向HES1 3'-UTR,从而抑制HES1表达并促进肿瘤转移[19]。本课题组前期研究亦显示HES1在宫颈癌HeLa细胞中通过逆转EMT而发挥抑制迁移和侵袭的作用[18]。为观察耐放疗宫颈癌细胞中是否亦发挥上述作用,本研究下调miR-182后,采用Transwell小室法检测细胞迁移和侵袭能力,发现HR6穿膜细胞数均明显减少,与Yang等[24]在结肠癌中的研究结果一致。进一步在HR6细胞中下调miR-182,发现HES1表达明显升高,而下调HES1并不影响miR-182表达,提示在宫颈癌耐放疗细胞HR6中,抑制miR-182可上调HES1表达并逆转EMT,同时抑制细胞迁移和侵袭,而miR-182可能通过靶向HES1发挥作用,但miR-182靶点的具体连接部位及相关机制有待进一步研究。

