电解液中Mn2+的浓度对阳极氧化所得二氧化钛纳米管阵列光电响应的影响
司玉军*,李敏娇,熊中平,文鲜,徐葳
(四川理工学院化学与环境工程学院,绿色催化四川省高校重点实验室,四川 自贡 643000)
随着人口的增长以及工业化进程的推进,人类社会的能源消耗急剧增加,并向自然界排放大量有毒物质和工业废料,从而引发与环境污染相关的疾病蔓延、气候变暖、极端天气频发等一系列不利于可持续发展的全球性问题[1-2]。开发环境友好、安全以及可持续供应的能源和污染物处理技术是当前面临的迫切课题。
将太阳能转变为化学能或电能的光催化技术是解决上述问题的主要研究方向之一。光催化过程需要半导体催化剂的参与[3-5]。半导体催化剂的价带电子被一定能量的太阳光激发跃迁至导带而形成电子−空穴对。一方面,电子和空穴作为半导体载流子,其定向移动可以形成光电流;另一方面,光生电子具有强还原性,空穴具有强氧化性,它们可以引发一系列光催化化学反应,将光能转变为化学能。
二氧化钛(TiO2)具有化学稳定性好、无毒、催化反应性好等特点,是最有应用前景的光催化剂之一。但TiO2是宽能隙半导体,常用的锐钛矿型TiO2的能隙宽度为3.2 eV,需要能量较高的紫外光才能激发其价带电子,而紫外光仅占太阳辐射能的5%。另外,TiO2的光生电子−空穴对容易复合而失去活性,进一步降低了对光的有效利用率[6-7]。因此有必要对TiO2进行改性,以增强其对可见光的吸收,提高TiO2光生电荷的分离速率,使TiO2满足实际应用的要求。
近年来,通过阳极氧化法制备的具有一维纳米结构的TiO2纳米管阵列(TNA)引起了研究者的关注[8-10]。与粉末 TiO2相比,TNA管状结构独特,比表面积大,吸附性能强,而且具有单向电荷传输特性,在光电催化降解有机物、水解制氢等领域都获得了应用。将 TNA与其他半导体耦合来构筑异质结可以实现TiO2的改性,促进它对可见光的吸收,增强其光电响应活性[11]。在诸多半导体中,锰氧化物具有低成本、环境友好、电化学活性高等优点,在锌锰电池、锂离子电池等化学能源领域已经有广泛的应用[12-14],但有关锰氧化物对TiO2的掺杂改性鲜有报道[15-16]。
鉴于锰氧化物可以由阳极氧化电解而得[12],本文在含有Mn2+离子的电解液体系中,通过阳极氧化法制备TNA,同时将Mn2+离子氧化为锰氧化物,从而在TNA的制备过程中实现锰氧化物的同步掺杂。
1 实验
1.1 锰掺杂TiO2纳米管阵列的制备
基体为20 mm × 15 mm × 1 mm的纯钛片(纯度为99.99%),用砂纸逐级打磨至1200#,经去离子水和乙醇清洗后,采用0.02 mol/L的HF水溶液超声振荡30 s,然后在NH4F质量分数为0.5%和MnCl2浓度不同的丙三醇−水溶液体系(丙三醇与水的体积比为 1∶9)中进行阳极氧化。以钛片为阳极,不锈钢片为阴极,氧化电压20 V,氧化时间2 h,电解液温度25 °C。氧化后的钛片在马弗炉内500 °C煅烧2 h,即得锰掺杂的TiO2纳米管阵列,记为Mn-TNA。
1.2 纳米管阵列的结构表征和光电响应测试
采用TESCAN的VEGA 3型扫描电镜(SEM,钨灯丝)观察纳米管阵列的形貌。采用Bruker的XFlash®Detector 410-M型X射线能量散射仪(EDS)分析元素组成。采用丹东方圆的DX-2600型X射线衍射仪(XRD)分析纳米管阵列的相结构。采用HITACHI的UH4150型紫外−可见漫反射光谱仪表征纳米管阵列的光响应特性,以硫酸钡作为白色参比物。
纳米管阵列的光电响应活性用电化学计时电流法表征,测试在上海辰华的CHI760E电化学工作站上进行。采用铂片为辅助电极,饱和甘汞电极(SCE)为参比电极,Mn-TNA为研究电极(光照面工作面积为3.0 cm2)。电解液为0.1 mol/L Na2SO4溶液,容器为石英烧杯。测试过程中给工作电极施加0.5 V的偏压,用500 W氙灯模拟太阳光,光源距工作电极20 cm,每隔30 s遮挡一次光源,记录无光和光照条件下的电流密度,二者的差值越大,即光照下光电流密度跃升越大,表示Mn-TNA的光电响应活性越好。
2 结果与讨论
2.1 Mn-TNA的微观结构
由图1可知,在Mn-TNA的XRD谱图中,除了金属钛基底的衍射峰外,也有显著的锐钛矿型TiO2衍射峰,表明Mn-TNA中的TiO2主要以锐钛矿的形式存在。Mn-TNA的XRD谱图与TNA相似,没有观察到锰氧化物的特征峰,这可能是因为电解液中Mn2+离子的含量少,在电解过程中生成的锰氧化物较少,不能产生可以分辨的X射线衍射信号。但通过EDS可检测到其中含有Mn(见图2),表明在阳极氧化电解液中加入Mn2+离子可以实现锰对TNA的掺杂修饰。

图1 TNA和在含0.005 mol/L Mn2+的电解液中所得Mn-TNA的XRD谱图Figure 1 XRD patterns of TNA and Mn-TNA obtained from the electrolyte containing 0.005 mol/L Mn2+

图2 在含0.005 mol/L Mn2+的电解液中所得Mn-TNA的EDS谱图Figure 2 EDS spectrum of Mn-TNA obtained from the electrolyte containing 0.005 mol/L Mn2+
从图3可以看出,TNA和Mn-TNA的表面形貌相似,都具有整齐排列的开口阵列结构。

图3 TNA和在含0.005 mol/L Mn2+的电解液中所得Mn-TNA的SEM照片Figure 3 SEM images of TNA and Mn-TNA obtained from the electrolyte containing 0.005 mol/L Mn2+
2.2 Mn-NTA的光电响应活性
由图4可以看出,给TNA和Mn-TNA施加0.5 V的偏压后,在无光照条件下,纳米管阵列的光电流密度几乎为零。这是因为TiO2是n型半导体,位于其价带的电子没有足够的能量使其激发跃迁至导带,半导体中没有定向移动的载流子。光源照射到纳米管阵列瞬间,光电流密度急剧增大,表明TNA具有良好的光响应活性。同时也可以看出,阳极氧化电解液中Mn2+离子浓度较小(0.001 ~ 0.005 mol/L)时,随着其浓度的增大,Mn-TNA的光电响应增强,光电流密度增大;电解液中Mn2+离子浓度为0.005 mol/L时,光电流密度达到最大;其后随着电解液中Mn2+离子浓度的增大,Mn-TNA的光电响应活性逐渐降低,0.015 mol/L时所得Mn-TNA的光电流密度甚至低于TNA的光电流密度,说明锰对TNA的掺杂有一个合适的量值范围。
2.3 Mn-NTA的紫外−可见漫反射光谱分析
由图5可以看出,在TNA中掺入Mn后,所得Mn-TNA对紫外光的吸收减弱,对可见光的吸收增强。锰氧化物的能隙宽度小于二氧化钛的能隙宽度,能量较低的可见光足以将其价带电子激发而被吸收,从而增强Mn-TNA对可见光的吸收。但锰掺杂降低TNA对紫外光的吸收的原因尚不明确。结合图4所示氙灯模拟太阳光照射下的光电流响应测试结果可知,尽管在Mn2+离子浓度为0.015 mol/L的电解液中所得 Mn-TNA对可见光也有较好的吸收,但在模拟太阳光照射下的光电流密度却急剧下降,这表明在Mn2+离子浓度较小的电解液中所得 Mn-TNA的光电响应增强不仅仅是锰氧化物对可见光吸收增强的结果。用适量的锰对TNA进行掺杂可以促进TiO2光致电子−空穴对的有效分离,使得在外加偏压作用下,半导体中有更多的电子可以自由移动,得到更高的光电响应电流密度。

图4 TNA和从不同Mn2+浓度的电解液中所得Mn-TNA在无光和光照下的光电流密度−时间曲线(偏压0.5 V)Figure 4 Photocurrent density vs.time curves for TNA and Mn-TNA obtained from the electrolyte with different Mn2+concentrations in light on–off process at a bias voltage of 0.5 V
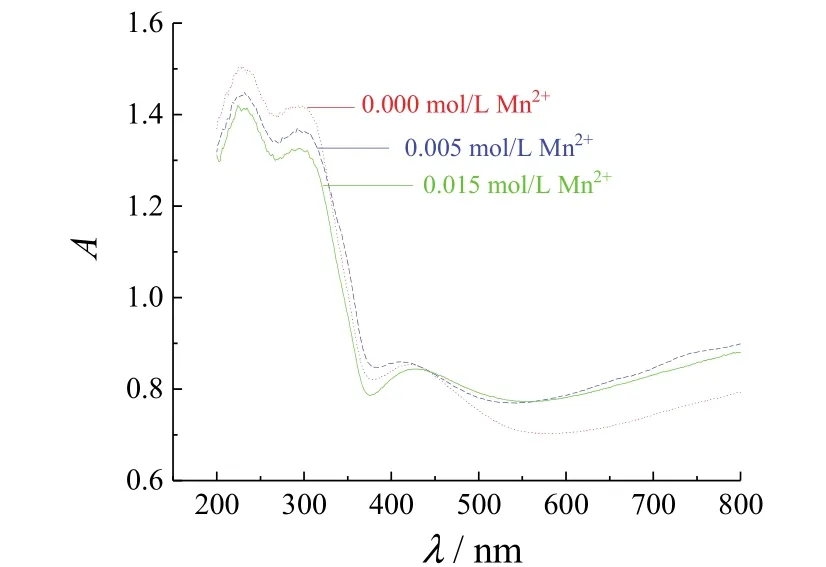
图5 TNA和从不同Mn2+浓度的电解液中所得Mn-TNA的紫外−可见漫反射谱图Figure 5 Diffuse reflectance ultraviolet-visible spectra of TNA and Mn-TNA obtained from the electrolyte with different Mn2+ concentrations
3 结论
在含有Mn2+离子的NH4F−丙三醇−水电解液体系中,用恒压阳极氧化法制备了锰掺杂的TiO2纳米管阵列Mn-TNA。锰对TNA的掺杂不会改变TNA的阵列管结构。锰掺杂对TNA光响应的影响在不同波长范围表现出不同的规律,TNA对紫外光的吸收受到抑制,对可见光的吸收则得到增强。电解液中 Mn2+浓度较小时,Mn-TNA的光电响应电流密度将随Mn2+浓度增大而增大,但Mn2+浓度过高会恶化Mn-TNA的光电响应。Mn2+浓度为0.005 mol/L时,所得Mn-TNA具有较好的光电响应,而Mn2+浓度达到0.015 mol/L时,Mn-TNA的光电响应比空白TNA还差。

