乳腺恶性肿瘤间质中α-SMA表达及与其临床病理特征的关系
王文然 郭 瑞 张 华
乳腺恶性肿瘤是临床较为常见的内分泌系统恶性肿瘤,流行病学研究显示乳腺恶性肿瘤的发病率可达735~988/100000万人左右[1]。近年来乳腺恶性肿瘤的发生呈现出了明显的年轻化的趋势,且其临床预后较差,远期病死率相对较高[2]。
在探讨乳腺恶性肿瘤发病机制的过程中发现,细胞生物学相关因子的改变,可以通过影响乳腺肿瘤上皮细胞的增殖、凋亡或者侵袭等能力的改变,进而促进患者病情的进展,加剧临床分期或者淋巴结转移等风险[3]。α-SMA能够在提高癌细胞的变形能力,增加其对于癌细胞DNA的结合等方面发挥作用,促进癌细胞的转移或者对于临近正常组织的浸润[4]。已有的研究探讨了α-SMA在乳腺癌患者中的异常蛋白表达,但缺乏对其与患者临床病理特征的关系研究。为了进一步揭示α-SMA的表达与乳腺恶性肿瘤患者临床病理特征的关系,本次研究选取(2015年1月至2016年12月)我院收集的乳腺肿瘤术后标本进行研究,旨在为乳腺肿瘤的发生和发展机制与影响因素的研究提供新参考。
1 材料与方法
1.1 一般资料
选取2015年1月至2016年12月我院收集的乳腺肿瘤术后标本进行研究,患者均为女性,按肿瘤良、恶性分组。其中乳腺恶性肿瘤组标本100例、良性肿瘤组标本60例。恶性肿瘤组,年龄33~65岁,平均(47.4±9.2)岁,其中TNM分期[5]:Ⅰ期29例、Ⅱ期30例、Ⅲ期41例,有淋巴结转移49例,组织学类型:乳腺导管原位癌34例、乳腺浸润性导管癌66例;组织学分级:Ⅰ级24例、Ⅱ级39例、Ⅲ级37例。良性肿瘤组,年龄27~65岁,平均(45.2±11.8)岁,其中乳腺纤维瘤21例、乳腺导管上皮普通型增生27例、乳腺导管上皮非典型增生12例。
1.2 纳入排除标准
纳入标准:①所有研究标本均来自于我院手术后切除的病变标本;②所有标本均经过病理学诊断证实;③恶性肿瘤标本手术前未采取放化疗、免疫治疗;④患者的各项临床资料完整。
排除标准:①伴有血液系统疾病、凝血功能障碍;②合并免疫疾病;③获取标本前患者接受过放化疗及免疫治疗;④合并其他类型恶性肿瘤。
1.3 免疫组化SP方法
采用石蜡切片脱蜡至水,采用离子水进行反复洗涤,加入牛奶液体封闭抗体,封闭时间为5 min,加入α-SMA抗体(鼠来源,ABCUM公司),37 ℃孵育2 h,采用磷酸盐缓冲液洗涤3次,滴加荧光染色标记的二抗抗体(购自abcum公司),37 ℃孵育30 min,加入磷酸盐缓冲液进行洗涤,采用南京凯基生物制剂公司生产的显色剂进行显色,封片,镜下观察。
1.4 冰冻切片免疫组化染色判断标准
免疫组化SP法结果判定α-SMA蛋白阳性的依据:①着色表达于细胞质,呈黄色、棕黄色和褐色;②根据阳性细胞比例:阳性细胞比例≤10%为“-”、11%~50%为“+”、51%~75%为“++”、>75%为“+++”,≤10%为阴性、>10%为阳性。
1.5 统计学方法
2 结果
2.1 两组肿瘤组织中α-SMA蛋白表达差异
经免疫组化染色后评分判断,乳腺恶性肿瘤组织中α-SMA蛋白阳性率为79.00%,显著高于乳腺良性肿瘤组织的25.00%,差异具有统计学意义(P<0.05)(表1)。

表1 两组α-SMA蛋白表达情况比较/例
2.2 α-SMA蛋白表达与乳腺恶性肿瘤患者临床病理特征的关系
乳腺恶性肿瘤组织中α-SMA蛋白阳性表达与患者年龄、病灶直径、ER表达、PR表达、原癌基因人类表皮生长因子受体2(human epidermalgrowth factor receptor-2,HER-2)表达无显著相关性(P>0.05),与肿瘤组织临床分期、组织学分级、淋巴结转移、组织学类型具有显著相关性(P<0.05)(表2)。
3 讨论
乳腺癌的病情进展,可以导致多器官的转移或者淋巴结转移的发生,患者生存预后较差。长期的临床随访研究发现,乳腺癌的致残率或者病死率近年来呈现出了明显的上升趋势[6],临床上乳腺癌患者的中位生存时间不足24个月,五年生存率不足35%[7-8]。而通过对乳腺癌发病过程中相关生物学机制的研究,一方面可以为揭示乳腺恶性肿瘤的病情进展提供理论基础,同时可以为临床上乳腺癌的综合性治疗措施如分子靶向治疗等提供新的作用靶点。α-SMA蛋白的四级空间结构上包含了多个可结合的糖蛋白配体,其可以通过影响癌细胞相关恶性肿瘤信号通路蛋白的转录或者激活等方面发挥作用,加剧癌细胞的生物学特性的改变,导致癌细胞的DNA扩增或者癌基因相关蛋白的磷酸化修饰的改变,促进患者癌细胞的侵袭或者转移的发生[9-10]。α-SMA蛋白的高表达,能够促进乳腺癌间质细胞成分中p53信号通路的激活、加剧P16等癌相关蛋白的翻译,影响到上皮病变细胞的极性、导致癌组织对于乳腺基底膜层的突破和浸润[11-12]。已经证实的是,α-SMA蛋白能够在促进甲状腺癌、卵巢癌或者肝癌等多种恶性肿瘤的临床分期的进展、癌组织的浸润或者组织学分型的恶化等方面发挥了一定的促进作用[13],但在乳腺癌患者中的研究不足。
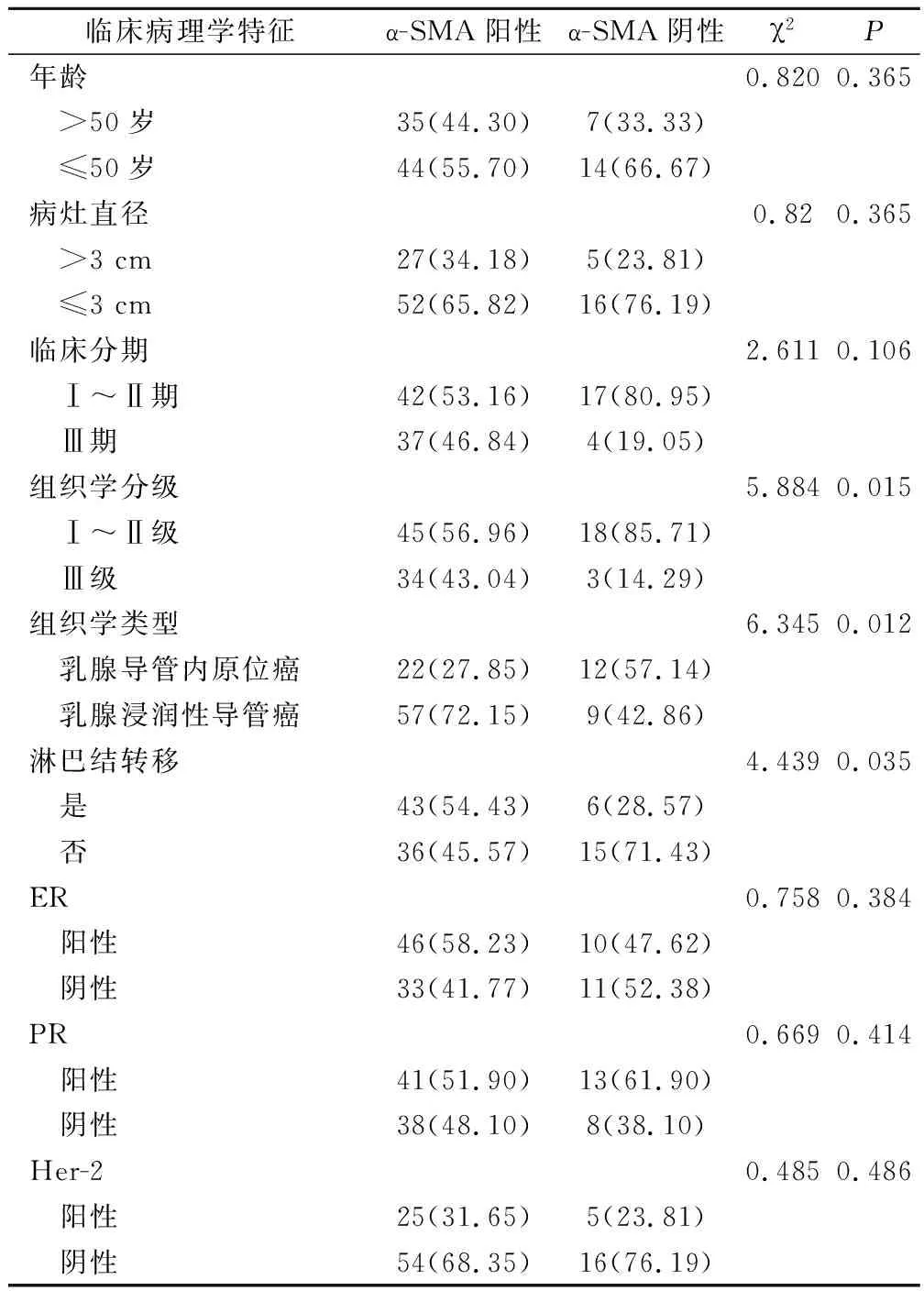
表2 α-SMA蛋白表达与乳腺恶性肿瘤临床病理特征的关系分析(例,%)
本次研究通过免疫组化分析研究发现,α-SMA蛋白的阳性表达率在乳腺恶性肿瘤病灶组织中较高,明显高于正常良性病变组织,差异具有明显的统计学意义,分析其原因可能为:肿瘤间质中肌纤维母细胞为主要的功能细胞,肌纤维母细胞通过不同的信号通路参与肿瘤细胞生物活性的调节,而α-SMA是肌纤维母细胞的细胞表型可靠的标志性蛋白,其可作为间质细胞表型的转化指标。当肌纤维母细胞中出现α-SMA蛋白高表达时,即会促进肿瘤增殖、浸润和转移。在乳腺肿瘤中,α-SMA蛋白的高表达能够在肿瘤相关蛋白信号通路的激活或者加剧癌细胞对于临床乳腺导管或者小叶的浸润方面发挥作用,促进乳腺癌细胞对于腋窝淋巴结或者锁骨下淋巴结的转移风险。李艳宏等[14]研究者在对400例乳腺疾病患者的病变组织进行检测的研究中发现,100例乳腺浸润性导管癌患者(D组)的肿瘤间质中α-SMA的阳性表达率显著另外3组(P<0.05),提示a-SMA阳性肌纤维母细胞增多与乳腺癌发生、发展关系密切。因此,本次研究所得结果并结合上述分析提示α-SMA蛋白可能参与到了乳腺恶性肿瘤的发生发展过程中。本研究在探讨α-SMA蛋白的表达与乳腺恶性肿瘤的临床病理特征的观察过程中发现α-SMA蛋白的表达与患者的淋巴结转移、组织学分型、组织学分级或者临床分期等具有密切的关系,相关临床病理过程的进展越为明显,α-SMA蛋白的表达浓度越高,趋势较为明显。赵晶洁等[15]学者在对100例相关乳腺癌组织中α-SMA蛋白的表达及其生物学行为的研究中也发现,在乳腺癌组织中α-SMA蛋白表达均高于良性乳腺组织,且与乳腺癌的临床分期、淋巴结转移有统计学意义。对本研究结果从机制上考虑,α-SMA蛋白的高表达与患者临床病理的关系可能主要与下列几个方面的因素有关:①α-SMA蛋白的高表达,促进乳腺癌患者局部肿瘤病灶组织中的肿瘤微环境的恶化,促进患者局部炎症损伤导致的持续性肿瘤细胞的增殖;②α-SMA蛋白的高表达,能够在促进乳腺癌患者的肿瘤干细胞因子CD44、CD133等的高表达的同时,促进癌病灶组织的癌细胞的迁移和细胞凋亡的抑制。③α-SMA蛋白的高表达,使乳腺上皮细胞可获得间质特性,失去典型的上皮细胞粘附性与极性,从而获得迁移能力,诱使肿瘤细胞离开原发部位,通过血管和淋巴管转移。
本次研究综合探讨了细胞间质成分相关生物学因子的异常表达与乳腺癌患者临床病理特征的关系,这有利于揭示乳腺癌的发生机制。综上所述,乳腺恶性肿瘤间质中α-SMA的表达显著的升高,并且与乳腺恶性肿瘤发生发展关系密切。后续临床研究应该在探讨α-SMA蛋白与乳腺癌患者临床预后的关系等方面做进一步的研究。

