谷氨酰胺强化肠内营养对晚期胃癌患者免疫功能及营养指标的影响
刘辉,陈信义,石玉春
1北京中医药大学附属护国寺中医医院肿瘤科,北京100035
2北京中医药大学附属东直门医院肿瘤科,北京1007000
胃癌是临床上发病率较高的消化系统恶性肿瘤,严重影响了患者的生活质量和身心健康,多数患者在确诊时已处于晚期,错失了手术的最佳时机,因此,需要通过放疗联合化疗等综合治疗方案对晚期胃癌患者进行治疗。晚期胃癌患者由于疾病对机体造成消耗,多数患者易出现营养不良和免疫功能下降的现象,因此,需要给予患者积极的营养支持[1]。目前,营养支持方式主要包括肠内营养支持和肠外营养支持,经口、肠道或者肠外途径为患者提供全面的营养素[2]。本研究回顾性分析了142例晚期胃癌患者的临床资料,观察并比较了不同营养支持方案对晚期胃癌患者免疫功能和营养指标的影响,旨在为晚期胃癌的治疗提供参考依据,现报道如下。
1 资料与方法
1.1 一般资料
回顾性分析2010年1月至2016年12月于北京中医药大学附属护国寺中医医院和北京中医药大学附属东直门医院接受治疗的142例晚期胃癌患者的临床资料。纳入标准:①年龄≥18岁;②均经影像学或手术探查确诊为晚期胃癌;③未合并其他系统的严重疾病。排除标准:①临床资料不全;②无法耐受营养支持治疗。根据营养支持方案的不同,将患者分为对照组和观察组,每组71例。对照组患者采用以能全力营养制剂为主的常规营养支持治疗方案,观察组患者采用以谷氨酰胺为主的强化营养支持治疗方案。对照组中,男42例,女29例;年龄50~69岁,平均(59.0±5.2)岁;平均体重指数(body mass index,BMI)为(22.4±2.1)kg/m2。观察组中,男40例,女31例;年龄51~70岁,平均(59.0±5.4)岁;平均BMI为(22.5±2.0)kg/m2。两组患者的性别、年龄比较,差异均无统计学意义(P﹥0.05),具有可比性。
1.2 治疗方法
对照组患者采用以肠内营养混悬液(TPF)为主的常规营养支持治疗方案,具体如下:第1~2天通过营养管输入5%葡萄糖溶液500 ml,若患者无特殊不适,开始对其给予肠内营养支持,肠内营养制剂为TPF,第2~3天输入肠内营养制剂500 ml,第4~9天输入肠内营养制剂1000 ml,不足部分由肠外营养补充。肠内营养支持治疗共持续进行7天。每天的热量为104.6 kJ/kg,每天的氮入量为0.16 g/kg。
观察组患者采用以谷氨酰胺为主的强化营养支持治疗方案,具体如下:第1~2天通过营养管输入5%葡萄糖溶液500 ml,若患者无特殊不适,开始对其给予肠内营养支持,肠内营养制剂为谷氨酰胺+TPF,第2~3天输入肠内营养制剂500 ml,第4~9天输入1000 ml,不足部分由肠外营养补充。肠内营养支持治疗共持续进行7天。每天的热量为104.6 kJ/kg,每天的氮入量为0.16 g/kg。
两组患者均使用复尔凯800型输注泵控制速度和剂量,肠内营养第1、2、3天的速度分别为25、50、100 ml/h。两组患者均在北京中医药大学附属护国寺中医医院和北京中医药大学附属东直门医院接受晚期胃癌常规化疗。
1.3 评价指标与检测方法
观察两组患者治疗前后的营养指标、胃肠激素水平、免疫功能和生活质量。采用SF-36生活质量评价量表评价患者的生活质量。此量表包括8个维度,分别是躯体功能、躯体角色、肢体疼痛、总体健康、活力、社会功能、情绪角色、精神健康。分值越高表明患者的生活质量越好。采用酶联免疫吸附试验检测患者血清中免疫因子的水平。抽取患者空腹静脉血5 ml,离心后分离血清待检,采用全自动生化分析仪测定患者红细胞(red blood cell,RBC)计数、血清白蛋白(albumin,ALB)和血清前白蛋白(prealbumin,PA)水平变化。采用放射免疫法测定患者的血清胃蛋白酶原Ⅰ(pesinogenⅠ,PGⅠ)、胃蛋白酶原Ⅱ(pesinogenⅡ,PGⅡ)和促胃液素(gastrin,GAS)水平变化。所有试剂盒均由北京东亚免疫技术研究所提供,严格按照试剂盒说明书进行操作。
1.4 统计学方法
采用SPSS 11.5软件对数据进行统计分析。计量资料以均数±标准差(±s)表示,组间比较采用t检验;计数资料以率(%)表示,组间比较采用χ2检验。以P﹤0.05为差异有统计学意义。
2 结果
2.1 治疗前后营养指标的比较
治疗前,两组患者的营养指标比较,差异均无统计学意义(P﹥0.05)。治疗后,观察组患者的RBC、ALB和PA水平均高于对照组患者,差异均有统计学意义(P﹤0.05)。(表1)
2.2 治疗前后胃肠激素水平的比较
治疗前,两组患者的胃肠激素水平比较,差异均无统计学意义(P﹥0.05)。治疗后,观察组患者的PGⅠ、PGⅡ和GAS水平均明显高于对照组患者,差异均有统计学意义(P﹤0.01)。(表2)
2.3 治疗前后免疫功能的比较
治疗前,两组患者的免疫指标比较,差异均无统计学意义(P﹥0.05)。治疗后,观察组患者的IgG、IgA和IgM水平均明显高于对照组患者,差异均有统计学意义(P﹤0.01)。(表3)
2.4 治疗前后生活质量评分的比较
治疗前,两组患者SF-36生活质量评价量表的各维度评分比较,差异均无统计学意义(P﹥0.05)。治疗后,两组患者的生活质量评分均较治疗前提高,观察组患者的生活质量评分均高于对照组患者,差异均有统计学意义(P﹤0.05)。(表4)
2.5 1年生存率的比较
观察组患者的1年生存率为84.5%(60/71),明显高于对照组患者的56.3%(40/71),差异有统计学意义(χ2=13.524,P﹤0.01)。
表1 治疗前后两组患者营养指标的比较(±s)

表1 治疗前后两组患者营养指标的比较(±s)
组别RBC(×1012/L)治疗前 治疗后ALB(g/L)治疗前 治疗后PA(mg/L)治疗前 治疗后对照组(n=71)观察组(n=71)t值P值3.35±1.02 3.38±1.05 0.173 0.432 4.02±0.99 4.32±1.01 1.787 0.038 25.35±2.14 25.37±2.08 0.056 0.478 28.52±3.02 33.44±3.11 9.563 0.000 156.87±13.06 156.89±12.92 0.009 0.496 172.26±15.03 195.13±14.12 9.345 0.000
表2 治疗前后两组患者胃肠激素水平的比较(±s)

表2 治疗前后两组患者胃肠激素水平的比较(±s)
组别PG (μg/L)治疗前Ⅰ治疗后PGⅡ(μg/L)治疗前 治疗后GAS(ng/L)治疗前 治疗后
表3 治疗前后两组患者免疫功能的比较(±s)
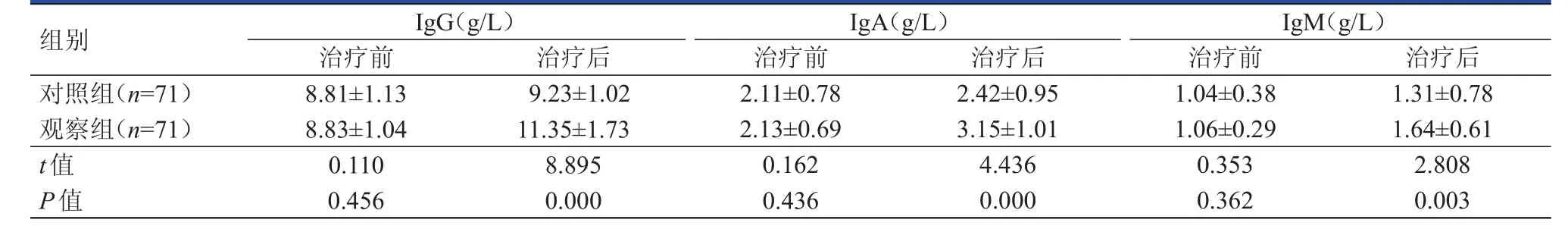
表3 治疗前后两组患者免疫功能的比较(±s)
组别IgG(g/L)治疗前 治疗后IgA(g/L)治疗前 治疗后IgM(g/L)治疗前 治疗后
表4 治疗前后两组患者生活质量评分的比较(±s)
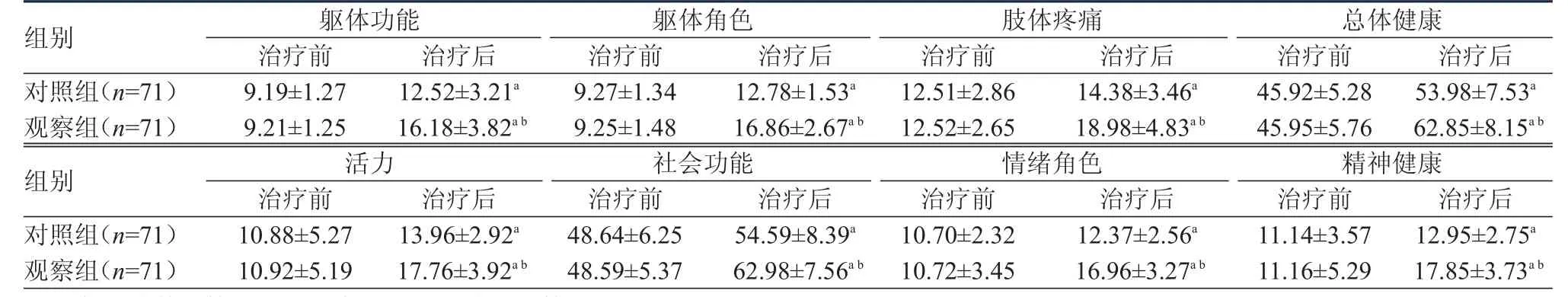
表4 治疗前后两组患者生活质量评分的比较(±s)
注:a与治疗前比较,P<0.05;b与对照组治疗后比较,P<0.05
组别对照组(n=71)观察组(n=71)组别对照组(n=71)观察组(n=71)躯体功能治疗前10.88±5.27 10.92±5.19治疗后13.96±2.92a 17.76±3.92a b躯体角色治疗前48.64±6.25 48.59±5.37治疗后54.59±8.39a 62.98±7.56a b肢体疼痛治疗前10.70±2.32 10.72±3.45治疗后12.37±2.56a 16.96±3.27a b总体健康治疗前11.14±3.57 11.16±5.29治疗后12.95±2.75a 17.85±3.73a b
3 讨论
胃癌属于临床常见的消化系统恶性肿瘤,多数胃癌患者因为伴有慢性出血和消化道梗阻而影响进食,因此,胃癌患者较其他恶性肿瘤患者更早且更容易发生营养不良,尤其是手术、放化疗等治疗方法会进一步导致患者的免疫功能下降[3]。有研究发现,恶性肿瘤患者营养不良的发生与肿瘤所造成宿主的物质代谢异常、营养物质摄入不足有关,肿瘤细胞的快速增殖、不断分裂会消耗机体大量的能量。约50%的肿瘤组织主要以无氧糖酵解的形式获取能量,消耗了人体大量的葡萄糖、脂肪和氨基酸,人体三羧酸循环与氨基酸异生作用增强,外周组织发生胰岛素耐受,因此,全身和肝脏蛋白的合成增加,肌肉蛋白合成降低,机体出现负氮平衡[4-6]。此外,人体对于肿瘤的应激性反应会导致人体产生一系列细胞因子从而引发糖、脂肪代谢紊乱,营养不良发生后,患者对于临床治疗方案的耐受能力降低,低蛋白血症会造成胶体渗透压降低和患者的血容量不足,而且患者的免疫应答能力会受到损伤,感染性并发症和器官功能不全的发生率升高,因此,营养支持治疗对于晚期胃癌患者的预后和耐受力改善至关重要[7-8]。目前临床上常采用的营养支持方案包括肠内营养支持和肠外营养支持。肠外营养支持治疗主要通过静脉滴注的方法为患者提供所必需的营养物质,包括热量、必需以及非必需氨基酸、脂溶性和水溶性维生素等多种微量元素,但是长期的肠外营养会导致导管并发症和感染并发症的发生,造成患者肠道的细菌发生移位[9]。肠内营养支持治疗是经胃肠道通过口服或管饲的方式为患者提供代谢所需要的营养物质及其他各种营养素的营养支持方式,但是部分学者认为常规的营养支持无法有效地改善创伤等应激后机体的分解代谢、炎性反应和免疫功能,因此,临床提出应用含有多种营养物质的免疫增强型肠内营养制剂,以改变患者的免疫功能,从而改善患者的预后[10]。化疗作为晚期胃癌重要的支持疗法,其会对患者产生一定的消耗,影响机体的营养状态,而且化疗在杀伤肿瘤细胞的同时会损伤人体的正常细胞,使机体的免疫力降低;另外,化疗药物的应用还会使患者食欲下降,导致患者的营养状况进一步恶化,形成恶性循环。
谷氨酰胺属于特殊营养物质,是人体内含量最为丰富的游离氨基酸,占全身游离氨基酸的50%以上,因此,谷氨酰胺是营养不良患者的条件必需氨基酸。谷氨酰胺代谢关键酶包括谷氨酰胺合成酶与谷氨酰胺酶,前者可以将谷氨酸与氨合成为谷氨酰胺,同时会消耗能量,后者则将谷氨酰胺分解为谷氨酸,因此,谷氨酰胺作为重要的营养物质,一方面可以通过氨基酸转移酶作用为蛋白质、嘌呤等生物分子提供氮源,同时,其也是肝糖原异生的重要底物,还是机体各器官之间转运氨基酸和氮的主要载体[11-12];另一方面谷氨酰胺是蛋白质代谢的重要调节因子,促进了机体组织蛋白质的合成,减少了骨骼肌蛋白质的分解过程,谷氨酰胺还参与还原剂谷胱甘肽的合成,在人体内具有对抗自由基的作用[13-14]。此外研究发现正常进食时,谷氨酰胺为肠道供能占总量70%以上,因此,小肠是谷氨酰胺重要的消耗器官,但是肠黏膜本身无法产生并储存谷氨酰胺,在严重的应激反应下,人体细胞对于谷氨酰胺的利用量增加,超过了生成量,需要外源性补充,通过强化摄入谷氨酰胺可以参与葡萄糖三羧酸循环氧化生成ATP,调节黏膜细胞核酸、蛋白质的合成代谢,促进肠黏膜细胞的更新和再生,保持其细微结构的完整,同时可以刺激机体产生高血糖素,增加肠黏膜中谷氨酰胺酶的活性,以促进其自身组织结构的恢复[15-16]。本研究显示,治疗后,观察组患者的RBC、ALB和PA水平均高于对照组患者(P﹤0.05),说明以谷氨酰胺为主的强化营养支持可以改善晚期胃癌患者机体的营养状态。治疗后,观察组患者的PGⅠ、PGⅡ和GAS水平均明显高于对照组患者(P﹤0.01),说明以谷氨酰胺为主的强化营养支持可以调节晚期胃癌患者体内的胃肠激素水平。治疗后,观察组患者的IgG、IgA和IgM水平均明显高于对照组患者(P﹤0.01),说明以谷氨酰胺为主的强化营养支持可以提高晚期胃癌患者机体的免疫功能。治疗后,观察组患者的生活质量高于对照组患者(P﹤0.05),说明以谷氨酰胺为主的强化营养支持可以提高晚期胃癌患者的生活质量。通过对患者的1年生存期进行分析发现,观察组患者的1年生存率为84.5%,明显高于对照组患者的56.3%,说明强化营养支持治疗对于生存率的提高具有一定的辅助效果。本研究的优势在于通过合理分析两种营养支持方案的特点,为晚期恶性肿瘤患者寻求了更为可靠、合理的营养支持方案,但是由于本研究属于回顾性分析,所纳入的患者数量有限,且未对患者进行远期随访观察,因此仍有待开展大样本、多中心、随机对照的研究以进一步深入分析。
综上所述,强化营养支持对晚期胃癌患者具有较好的治疗效果,可明显改善患者的免疫功能和营养状况,具有良好的临床应用价值。

