CIH对舌下神经核中H2S合成酶影响的初步研究*
李佳宸 史雅文 朱华,2 张希龙 殷敏 程雷
阻塞性睡眠呼吸暂停综合征(obstructive sleep apnea,OSA)是以夜间反复发生上呼吸道狭窄或坍塌为特征的一种睡眠相关疾病,它直接导致通气减少或呼吸暂停,血氧饱和度下降以及睡眠破碎[1],继而引发心脑血管等全身多系统的一系列疾病。觉醒状态下上气道的最小口径位于口咽部,而OSA患者的上呼吸道口咽部更狭小[2,3],而口咽部气道的开放依赖于上气道扩张肌的有效收缩。颏舌肌是其中最大也是最主要的扩张肌[4]。健康人群睡眠时颏舌肌活性具有下降趋势,这种趋势在OSA患者中更为明显[6],而在觉醒期OSA患者颏舌肌的活性较正常人显著地增加[5],这可能是对上气道狭窄的一种代偿机制。颏舌肌等上呼吸道肌群的活动受舌下运动神经元(HMNs)支配,后者在维持气道通畅性方面发挥关键作用。HMNs活性降低会导致咽肌张力减弱,气道阻力增加从而导致上呼吸道闭合。因此,HMNs对于保持上呼吸道开放至关重要。舌下运动神经元受一系列神经调节递质的调控,如组胺、去甲肾上腺素、5羟色胺等激动性神经调节递质,甘氨酸、γ氨基丁酸等抑制性神经调节递质[7]。我们的前期研究表明,5-HT在HMNs的调控中发挥重要作用,尤其在慢性间歇性缺氧(chronic intermittent hypoxia,CIH)环境下,5-HT受体在舌下神经核腹侧核团的表达增高,提示在OAS的发生发展中,可能发挥重要的代偿功能[8]。
另一方面,硫化氢(H2S)在中枢神经系统调控中的作用被逐渐关注。生理浓度的H2S具有多种生理学功能,它被认为是继CO、NO之后的另一种新型气体信号分子[9],在机体内多个系统中发挥着重要作用。哺乳动物体内的H2S主要是以L-半胱氨酸为基质,分别由胱硫醚-β-合酶(cystathionine-β-synthase,CBS)、胱硫醚-γ-裂解酶 (cystathionine-γlyase,CSE)、3-巯基丙酮酸硫转移酶 (3-mercaptopyruvate sulfurtransferase,3MST)催化合成H2S。CBS和3MST主要表达在中枢神经系统中[10,11],而CSE主要表达在血管壁组织及心肌组织中[12]。H2S在中枢神经系统中发挥抗氧化、抗炎、抗凋亡等作用[13],所以它被认为是中枢神经系统中的一种重要神经调节保护气体分子。
研究提示H2S参与延髓呼吸中枢的调控中可能发挥重要作用。Hu等[14]在向鼠脑延髓切片中灌注NaHS(外源性H2S供体)后发现舌下神经根分支电位明显提高,而在灌注CBS抑制剂后电位又下降,提示CBS-H2S参与大鼠中枢节律性呼吸的调节。同时,H2S还可能参与缺氧条件下对延髓呼吸中枢的保护过程,Pan等[15]将延髓切片置于5%氧浓度的环境中10min后,舌下神经根分支电位明显下降,而用NaHS灌注后其电位再次提高,硫化氢对呼吸活动产生兴奋作用,逆转由缺氧引起的呼吸电位抑制作用。Donatti等[16]通过向鼠脑延髓包钦格复合体内微注射CBS抑制剂和NaHS,发现CBS-H2S可以抑制急性缺氧诱导的肺过度换气。同样的,Li等[17]发现通过向大鼠脑室内注射NaHS或L-半胱氨酸(LCys,H2S底物)可以防止急性缺氧大鼠发生呼吸抑制作用。这些都提示H2S可能会保护髓质呼吸中枢免受急性缺氧引起的损伤。由于延髓包括较多核团,同时这些研究是针对急性缺氧而并非针对CIH。因此,CIH环境下,H2S对舌下神经核团究竟是否发挥保护性作用,H2S究竟是否参与缺氧时舌下神经核的调节,目前尚无研究讨论。因此,我们研究大鼠舌下神经核中H2S合成酶在CIH条件下的表达变化,从而探讨H2S参与OSA上呼吸道肌群调控的可能机制。
材料与方法
1 动物和造模
取12只8周龄的健康雄性Sprague Dawley(SD)大鼠,体质量180~200g,由江苏省动物实验中心提供。按照实验要求随机分为间歇性低氧组(CIH组)和常氧对照组(Control组)。8:30将CIH组大鼠放入低氧箱中,通过周期性通入氮气和空气使低氧箱中的氧浓度在5%~21%之间循环,每一循环2min,前60S通入氮气使低氧箱中氧浓度逐渐下降至5%,后60S通入空气使箱内氧浓度逐渐恢复至21%。16:30将箱内大鼠取出,放回常氧室内饲养。此循环每天持续8小时,连续35天。对照组置于常氧环境中饲养。两组大鼠自由摄食、进水,饲养于南京医科大学动物中心SPF环境中。
2 RT-PCR和Western blot的实验取材
将12只大鼠(每组各6只)以2%戊巴比妥钠(4mg/100g)麻醉后立即断头,快速将脑干分离,根据Yu[18]的方法将左右两侧舌下神经核组织分离出。根据Paxinos and Watson[19]图谱选取舌下神经核所在的横断面,用微穿刺针提取舌下神经核组织,立即置入液氮中,存放于-80度冰箱中。整个提取操作都在冰上完成。
3 反转录-聚合酶链反应及免疫印迹试验
3.1 RT-PCR
采用β-actin作为内参通过逆转录PCR(RTPCR)测定3MST,CBS and CSE mRNA的表达量。将从舌下神经核组织中提取的RNA样本通过紫外分光光度计测定浓度和纯度。检测结果提示OD260/OD280比值在1.8~2.0之间时,RNA的质量符合要求。将提取的RNA配置成20μl反转录体系,置于37℃水浴锅1h,再置于72℃水浴锅10min,冷却后用于在八排管中配制20μl的反应体系。3MST上游引物:5’-CGGCGCTTCCAGGTAGTG-3’,下游引物:5’-CTGGTCAGGAATTCAGTGAATGG-3’;CBS 上游引物:5’-CTCCGGGAGAAGGGTTTTGA-3’,下游引物 :5’-CATGTTCCCGAGAGTCACCAT-3’;CSE 上游引物:5’-GCTGAGAGCCTGGGAGGATA-3’,下游引 物 :5’-TCACTGATCCCGAGGGTAGCT-3’;β -actin 上游引物:5’-ACCCGCGAGTACAACCTTCTT-3’,下游引物:5’-TATCGTCATCCATGGCGAACT-3’。扩增反应采用35个循环,每个循环具体如下:95℃变性持续15秒,60℃退火持续30秒,72℃延伸持续30秒。PCR结束后行数据分析,循环阈值(Ct值)取平均值,利用待测样品的Ct差值,通过计算公式2-ΔΔCt法求得相对值即为该基因在该样本中的相对表达量。
3.2 Western blot
采用GAPDH作为内参通过蛋白质印迹法(Western-blot)测定3MST和CBS蛋白的表达量。以1:100的比例向预冷的RIPA裂解液中加入混合蛋白酶抑制剂cocktail,充分混匀后,冰上静置。每5mg组织中加入300ul蛋白裂解液,充分混匀,超声破碎后冰上静置10min。4℃12,000转离心15分钟,取上清即可得蛋白样品,采用CBA法测量蛋白样品的浓度。以1∶4的比例向蛋白样中加入蛋白上样缓冲液,混匀后100℃水浴锅中煮沸5分钟。使用12.5%SDS-PAGE凝胶,每样孔中加入20ug蛋白样,先在60V电压下上分离60分钟,再在120V下分离40~60分钟。将SDS-PAGE凝胶转移到PVDF膜上(Bio-Rad laboratories,Florida,USA) 在 300mA 下转膜80分钟。室温条件下5%脱脂牛奶震荡孵育2小时。将条带放入抗 MPST(1:100,ab85377);抗 CBS(1∶5000,ab140600)中,4℃摇床孵育过夜。取出条带,室温下TBST震荡洗涤三次,每次10分钟。室温条件下将条带放入二抗(山羊抗兔抗体,1∶5000,CST,USA)中,震荡孵育1.5小时。取出条带,室温下TBST震荡洗涤三次,每次10分钟。随后曝光。避光条件下配制ECL-plus显影液,混匀后,均匀滴在PVDF膜上,使用Bio-Rad ChemiDoc凝胶成像系统进行曝光,获得实验结果。
4 统计学处理
用ImageJ图像分析软件采集灰度值,用SPSS18.0统计软件进行统计分析,结果均以均数±标准差(±s)表示,两组间比较采用独立样本 t-test,P<0.05为差异有统计学意义。
结果
1 舌下神经核中H2S三种合成酶(3MST,CBS,CSE)的mRNA表达量
通过RT-PCR技术发现三种合成酶在舌下神经核均有表达。在CIH条件下,3MST和CBS合成酶mRNA的表达量明显低于对照组(P<0.05),而CSE mRNA的表达量与对照组没有统计学差异(P>0.05,图 1)。
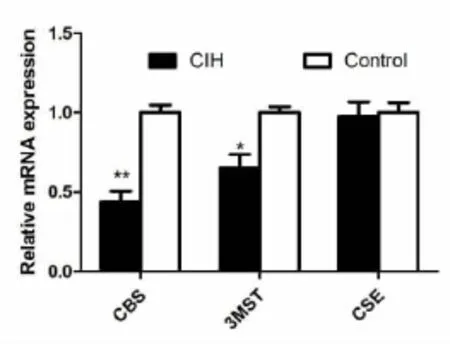
*:与 Control组相比 P<0.05;**:与 Control组相比 P<0.01
2 舌下神经核中3MST和CBS蛋白的表达量
利用Western-blot技术来检测舌下神经核中3MST和CBS蛋白的表达。在CIH组,舌下神经核中3MST和CBS蛋白的表达量均低于对照组(P<0.05,图 2)。
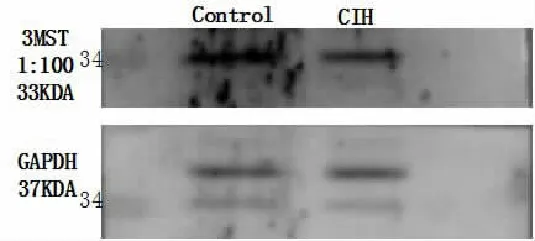
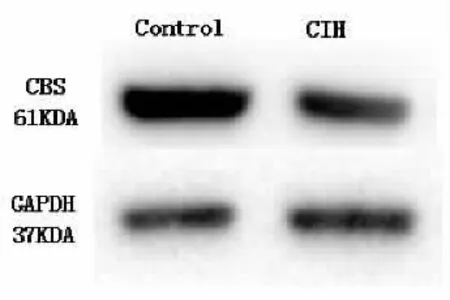
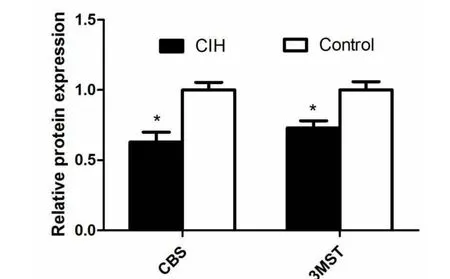
图2舌下神经核中3MST和CBS蛋白的表达量
讨论
初步研究结果显示,H2S的3种合成酶在舌下神经核中都有表达,但CIH组3MST和CBS在舌下神经核中的表达明显下调。
H2S作为一种新型的体内气体信号分子,近些年它在中枢神经系统中的重要作用已逐步受到关注,如管理脑中突触的活动[20],通过下丘脑-垂体-肾上腺轴来调节神经内分泌[21]。内源性H2S在脑中的浓度达到50~160um,远高于它在血清中的浓度(<46um)[22]。生理浓度的H2S参与呼吸活动的调节,H2S可以通过提高cAMP水平使延髓呼吸中枢兴奋[14]。在急性缺氧状态下,H2S可以通过激活KATP通道,抗氧化以及下调C-fos等途径保护呼吸中枢[15],内源性和外源性的H2S都能减少缺氧对延髓呼吸中枢造成的损伤[23]。TalaeiF等[24]也发现通过CBS/H2S途径可以减少缺血再灌注对组织造成的损伤。但这些研究主要是在鼠脑的延髓水平开展,而延髓中包含舌下神经核、疑核、面神经核、包钦格复合体等众多区域,H2S是否在缺氧时对其中具体每个核团都发挥保护作用,目前尚无明确定论。
既往文献提示,H2S对多种组织在急性缺氧时提供了保护性作用。而OSA的病理生理特征是慢性间歇性缺氧,而CIH对脑组织所造成的伤害是与持续性缺氧或者急性缺氧不同的[25]。因此,舌下神经核作为一个与OSA发病机制密切相关的核团,在处于CIH条件下时,H2S究竟对其发挥着什么样的作用,值得我们关注。
本研究中我们发现CIH条件下舌下神经核中3MST和CBS mRNA和蛋白的表达量均明显降低,推测H2S的合成减少,舌下神经运动元在缺氧时受到的保护作用因此减弱导致其受损加重。在相关研究中,Li等[26]通过测定大鼠延髓中H2S浓度、3MST mRNA及3MST蛋白发现CIH导致大鼠延髓各核团中3MST和H2S的表达均提高,这与我们的研究结果相反。我们推测这一结果可能与CIH程度和时间有关,在Li等[26]的研究中,每天6小时CIH环境并持续了14天,而我们的研究中每天8小时CIH持续了35天。相对而言,Li的研究中CIH造成损伤可能处于一个相对代偿的状态,所以H2S相关合成酶的表达是增加的。而我们的研究中CIH程度更重,可能使组织损伤到了失代偿状态,因此它的表达出现减少的趋势。对舌下神经核而言,何种程度CIH造成的损伤可被完全代偿,进而对整体而言,何种程度OSA引起的损伤是机体失代偿的开始,值得基础和临床研究的关注。由于目前相关文献较少,针对这一现象及推测,尚且需要进一步研究的证实。
以慢性间歇性缺氧为特征的OSA会使舌下神经核中H2S的调节逐渐失代偿,H2S的表达量下降,对舌下运动神经元的保护作用减弱,舌下运动神经元的兴奋性降低,对口咽部扩张肌的调控作用减弱进而引起上气道狭窄。这可能是加重OSA的发病机制之一。我们猜测H2S对舌下神经核的保护机制可能与其抗氧化、抗凋亡作用相关[17],这有待在今后的研究中进一步加以验证。
文献报道,H2S在OSA这种疾病中也并非完全发挥正向积极的作用。H2S可以刺激颈动脉体感觉神经,从而启动颈动脉体化学感受器,使其处于兴奋敏感状态。临床研究表明,颈动脉体化学反射的过度活动是OSA的一种重要驱动因素[27]。Peng等[28]发现在自发性高血压(SH)大鼠中,CSE-H2S驱使颈动脉体化学感受器兴奋从而会导致睡眠呼吸暂停,当对其使用CSE抑制剂后,大鼠呼吸情况变的平稳,OSA缓解。我们认为,这主要因为H2S通过CSE发挥了作用,而后者主要表达于心血管系统中[12]。尽管在中枢神经系统中CBS与3MST占主导地位[10,11],但外周H2S发射通路的存在,并且后者可能通过颈动脉体化学感受器发射来调控呼吸,这提示我们在将来的研究中,更要考虑到这外周与中枢H2S催化合成通路中可能存在的交互影响。
本研究发现硫化氢的3种合成酶均存在于成年大鼠的舌下神经核中,并且CIH明显抑制了3MST和CBS在其中的表达。这一结果提示,CBS与3MST-H2S通路可能参与调节舌下神经核相关的呼吸活动。但这一作用是否与CIH程度和作用时间存在潜在相关,同时是否与外周H2S合成通路有一定交互作用,尚且需要进一步研究来证实。

