中国前列腺癌患者BRCA1/2及ATM基因的胚系突变研究
韦 煜,吴俊龙,顾伟杰,秦晓健,林国文,戴 波,朱 耀,叶定伟
复旦大学附属肿瘤医院泌尿外科,复旦大学上海医学院肿瘤学系,上海 200032
在欧美国家,前列腺癌已经成为发病率最高的男性恶性肿瘤[1],虽然我国前列腺癌的发病率较低,但近年来发病率呈显著上升趋势[2]。据估计,2015 年我国前列腺癌新发患者有60 300例,死亡患者约26 600例[2]。
前列腺癌的高危因素之一是肿瘤家族史,这提示前列腺癌的发生与基因遗传背景密切相关。得益于高通量测序技术的迅速发展,全基因组关联研究(genome-wide association study,GWAS)已经确认了100多种导致前列腺癌风险增加的遗传突变,与33%的家族性前列腺癌有关[3-6];此外,其他与前列腺癌发病风险相关的基因也相继被发现。其中,大量研究发现BRCA2基因致病突变是前列腺癌的高风险因子[7-10],存在于1.2%~1.8%的前列腺癌患者[11-12]。尽管在局限性前列腺癌中DNA修复基因的胚系突变率很低,但最近的一篇文献报道显示,在转移性前列腺癌患者当中,11.8%的患者携带胚系DNA修复基因的突变,其中BRCA1/2、ATM基因的突变占到了7.55%[13]。已有研究表明,BRCA2基因的胚系突变与前列腺癌的早期发生、高危分级和治疗后复发有关[14]。
尽管在阐明前列腺癌易感性的分子机制上取得了丰硕进展,但基于中国人群的样本研究鲜有报道。同时,不同种族人群前列腺癌遗传易感性的差异使获中国患者的遗传突变谱变得更加迫切。既往研究显示,在转移性前列腺癌患者中,18.18%的中国患者携带有胚系BRCA2或ATM基因突变,分别占13.64%和4.55%;而在局限性前列腺癌中,携带这3种基因突变的人数为0[15]。然而,由于样本量有限,这一结论仍然需要得到进一步的验证。本课题组基于中国人群前列腺癌患者数据,分析报道了中国人群前列腺癌患者的遗传突变特征。
1 资料和方法
1.1 研究对象
本前瞻性研究纳入了2017年2月—2017年6月在复旦大学附属肿瘤医院遗传咨询门诊确诊为前列腺癌的53例患者,前列腺癌的诊断基于前列腺穿刺活检的病理结果。为保证样本数据有代表性,对有意愿进行基因检测的前列腺癌患者进行了连续入组。临床信息来自于患者诊疗记录以及随访调查。本研究已得到复旦大学附属肿瘤医院伦理道德委员会批准,且均获得入组患者的知情同意。
1.2 基因测序
在本研究中,我们采用目标区域捕获的方法对3个前列腺癌遗传易感基因(BRCA1、BRCA2和ATM)进行了二代测序。首先将从外周血淋巴细胞中提取的胚系基因组DNA进行纯化、取样后,对DNA片段进行纯化和扩增,然后采用设计好的Human SureSelect XT Custom Kit(700 Kb-34 Mb,AgilentTechnologies)进行目标区域捕获,使用Agilent 2100 Bioanalyzer分析捕获的文库,随后在HiSeq4000平台进行二代测序。目标基因的平均测序深度超过100×。
1.3 生物信息学分析
我们使用Illumina base-calling software 1.7处理原始测序数据,然后采用Burrows-Wheels Aliger将测序Reads与参考基因组序列比对,进行初步的质控。接着,我们用Picard来标记由聚合酶链反应(polymerase chain reaction,PCR)产生的重复读取的冗余信息。对重复数据进行过滤后,使用BWA软件将高质量的测序数据与UCSC人类参考基因组(GRCH37,UCSC hg19)进行比对。随后采用SAMtools来鉴定小插入或缺失突变,用SOAPsnp来鉴定中单核苷酸多态性。最后,采用ANNOVAR对In Dels和SNPs进行注释。
结合本研究,我们选取了BRCA1、BRCA2、ATM这3个DNA修复基因,依据1000 Genomes Project(www.1000genomes.org)和Exome Aggregation Consortium(http://exac.broadinstitute.org)筛选出人群中遗传突变频率<5%的突变,同时查阅了已发表文献和公共数据库ClinVar(https://www.ncbi.nlm.nih.gov/clinvar/)和LOVD(http://www.lovd.nl/3.0/home)。最终遗传突变的致病性根据美国医学遗传学与基因组学学会(American College of Medical Genetics and Genomics,ACMG)遗传分类标准来判断。致病性突变和可能致病性突变被定义为:① 所有的截断突变,同时人群数据库中该突变频率不超过5%,没有疾病数据库报道成良性或可能良性;② 人群数据库中突变频率不超过5%,同时已被疾病数据库报道成致病性或者可致病性的无意义突变;③ 影响到3个以上氨基酸的非移码突变。
1.4 统计学处理
采用SPSS 22.0进行统计学分析。以年龄为连续变量,以家族史、转移与否、Gleason评分、前列腺特异抗原(prostate-specific antigen,PSA)是否高危(PSA≥20 ng/mL)为分类变量,对连续变量采用Student’t检验,对分类变量采用χ2检验或Fisher确切检验法,均为双侧。P<0.05为差异有统计学意义。
2 结 果
本研究的患者年龄范围44~81岁,中位年龄65岁,<60岁患者15例,≥60岁患者38例;PSA<20 ng/mL有10例,≥20 ng/mL有39例(部分数据缺失);Gleason评分≤7分7例,>7分45例(部分数据缺失);其中16例患者一级亲属具有肿瘤病史,37例患者一级亲属无肿瘤病史(表1)。
在53例进行测序的患者中,有4例(7.55%)患者携带致病性遗传突变。4个致病性突变类型均为截断突变;其中,BRCA2基因突变有3例,ATM基因突变仅有1例,未发现BRCA1基因致病突变。同时,尚有4例临床意义不明突变存在,可能会造成对致病性突变的低估(表2)。无患者同时携带两种不同基因的致病性突变。53例患者致病性基因胚系突变位置见图1,BRCA1/2和ATM基因的胚系致病突变、临床意义不明突变分布见图2。
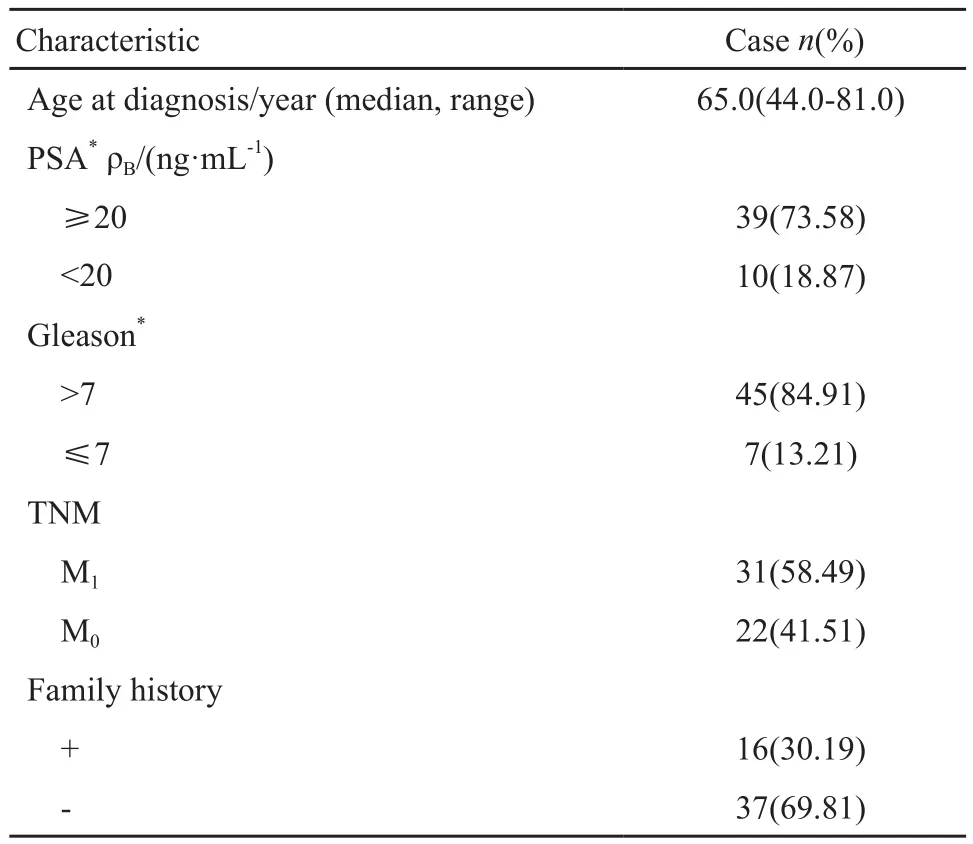
表 1 研究对象的临床病理信息Tab. 1 Characteristics of the patients

表 2 53例患者中的致病性突变和临床意义不明突变Tab. 2 Pathogenic mutations and uncertain signi fi cance identi fi ed in 53 patients

图 2 BRCA1/2和ATM基因的致病性突变、临床意义不明突变及其频率Fig. 2 Pathogenic and uncertain signi fi cance mutations and the frequencies in BRCA2 and ATM genes
我们发现,相比无致病性胚系突变的患者,携带胚系致病突变的患者往往确诊时年龄更低。突变患者确诊时的平均年龄为53.75岁,而未突变患者的平均年龄为65.25岁(P=0.011)。
一级亲属家族史阳性患者中,12.50%(2/16)的患者存在致病性突变,而一级亲属家族史阴性的患者中,5.41%(2/37)的患者存在致病性突变(P=0.575),没有证据显示出家族史与遗传突变之间的相关性。对于转移与非转移性前列腺癌患者,他们的遗传突变率分别为9.68%、4.55%(P=0.633),确诊时肿瘤已经发生转移的患者的遗传突变率与非转移患者之间差异无统计学意义。
同样,遗传突变与前列腺癌的危险分级之间似乎并不相关。53例患者中,1例患者因外院进行内分泌治疗无法对Gleason评分。所有遗传突变携带者的Gleason评分大于7分,而在未突变患者中Gleason评分大于7的占85.42%(P=1.0)。53例患者中,49例患者确诊时的PSA数据是有效数据,分析显示携带突变的患者中75%的PSA≥20 ng/mL,而80%的未突变患者PSA≥20 ng/mL(P=1.000)。
3 讨 论
在有关前列腺癌遗传突变的相关报道中,既往很少有研究将中国人群的数据纳入到统计之中。本研究中,我们对中国人群前列腺癌患者BRCA1/2、ATM基因的遗传突变率以及转移性前列腺癌患者中这3个基因的突变率进行了报道。一方面,我们的研究表明,中国人群中BRCA1/2、ATM基因的胚系突变率为7.55%,在转移性前列腺癌患者中为9.68%;另一方面,我们发现在中国人群中,BRCA1/2、ATM基因的突变与前列腺癌的早期发生有关,携带胚系致病突变的患者确诊时的平均年龄为53.75岁,显著低于无胚系致病突变的患者。这提示我们除了依据美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南,对转移性前列腺癌患者或家族中存在易感胚系基因突变患者的人群推荐进行基因检测之外[16],对于发病年龄偏早的患者推荐进行基因检测能够筛选出更多的突变携带者。
BRCA1/2、ATM基因的胚系突变不仅与前列腺癌的进展、预后相关,既往研究已表明对于携带胚系或体细胞BRCA1/2、ATM、PALB2和FANCA基因突变的转移性去势抵抗性前列腺癌(metastatic castration-resistant prostate cancer,mCRPC)患者,PARP抑制剂的响应率可达到88%[17],铂类治疗则可使PSA明显降低[18-19],治疗上的进展使得对获益人群进行有效筛选愈加重要。同时,PARP抑制剂和铂类在DNA修复基因胚系突变的mCRPC患者中显示出的不同效应是否与突变位点有关也值得进一步探讨。
Na等[15]的研究结果显示,中国人群BRCA2、BRCA1及ATM的遗传突变率为5.97%,其中转移性前列腺癌患者中突变携带者18.18%,局限性前列腺癌患者的突变携带者为0%,后者极低的突变率可能与入组的前列腺癌患者还必须符合Gleason评分≤6有关。同时,在致病性突变位点上,我们尚未发现与其中报道相同的位点,需要发现更多的致病性突变来进一步探究不同突变类型是否会对PARP抑制剂及铂类化疗的疗效造成影响。
本研究同样存在几点不足:首先,我们的样本量仍然有限,最终得到的致病性突变偏少,这在一定程度上影响了统计的准确性,需要依靠更多的样本获得更加准确的结果,以进一步指导中国人群前列腺癌的基因检测;另外,在样本的选取上,Gleason评分>7的患者占86.54%,PSA≥20 ng/mL的患者占79.59%,高危人群的大量分布导致无法对照得出BRCA1/2、ATM基因的胚系突变与前列腺癌高危之间的关系,需要设计更加合理的入组标准来排除人群导致的结果偏移。
总之,中国人群前列腺癌患者中BRCA1/2、ATM基因的突变携带者占5.97%~7.55%,在转移性前列腺癌患者中达9.68%~18.18%,仍然推荐进行基因检测。同时在中国患者中,前列腺癌的早发也提示了可能带有BRCA1/2、ATM基因的胚系突变。由于中国前列腺癌发病率在60岁以上人群中明显增加,可考虑对确诊年龄小于60岁患者进行基因检测。更大样本量的研究很有必要,可以获得更精确的突变率来指导临床治疗,同时可以阐明突变位点不同对患者使用PARP抑制剂和铂类化疗获得不同疗效造成的影响。

