GP、PF及TPF方案化疗联合调强适形放疗治疗鼻咽癌的临床疗效
杨佑琦,区晓敏,周 鑫,史 琪,邢 星,胡超苏
复旦大学附属肿瘤医院放疗科,复旦大学上海医学院肿瘤学系,上海 200032
鼻咽癌是一类预后较好且以放化疗为主要治疗手段的恶性肿瘤。在二维放疗时代,INT0099这项Ⅲ期随机临床试验证实鼻咽癌的同期顺铂联合放疗在无进展生存期(progress-free survival,PFS)和总生存期(overall survival,OS)上优于单纯放疗[1]。随后几项研究也证明同期放化疗可改善鼻咽癌预后[2-4],但同时也带来放化疗相关的毒性反应。调强适形放疗(intensitymodulated radiotherapy,IMRT)技术的应用提高了鼻咽癌的局部区域控制率,对正常组织实现了更好的保护[5-6],但也削弱了同期放化疗在局部区域控制率上的获益。目前尚无Ⅲ期随机临床试验证实同期放化疗在IMRT时代的价值。本中心一项Ⅲ期随机研究报道,诱导化疗联合同期放化疗对比诱导化疗联合放疗及辅助化疗,结果表明两组生存情况差异无统计学意义,但诱导化疗联合同期放化疗组伴随有更高比例的放射性黏膜炎(52.4% vs 35.9%,P=0.02)、呕吐(13.7%vs 4.7%,P=0.00)等不良反应[7]。一项Ⅲ期多中心随机临床试验提示在同期放化疗的基础上增加诱导化疗可提高无失败生存率,提示诱导化疗在改善局部晚期鼻咽癌患者预后方面可能存在价值[8]。一项Ⅱ期的TPF(多西他赛+顺铂+氟尿嘧啶)诱导化疗联合同期放化疗的试验报道97%的患者三程诱导化疗后获得部分缓解或完全缓解,提示TPF方案可作为诱导化疗的选择之一[9]。此外,有研究表明尽管存在更高比例的Ⅲ/Ⅳ级不良反应,TPF方案作为诱导化疗可能优于PF(顺铂+氟尿嘧啶)方案[10-11]。吉西他滨是一种胞嘧啶核苷衍生物,可抑制DNA合成。GP(吉西他滨+顺铂)方案的疗效和安全性已在很多复发/转移鼻咽癌的临床应用中获得证实[12-14]。GP方案作为诱导化疗治疗鼻咽癌也有相关的报道[15-17],提示该方案具有良好的耐受性和疗效,但目前暂无Ⅲ期随机临床试验证实。所以我们的研究旨在回顾性分析在诱导化疗联合IMRT及辅助化疗这一模式下不同化疗方案对鼻咽癌患者疗效的影响。
1 资料和方法
1.1 临床资料
本研究纳入2009年1月—2010年12月在复旦大学附属肿瘤医院放射治疗中心收治的134例行诱导化疗联合IMRT及辅助化疗的鼻咽癌患者。诱导化疗方案与辅助化疗方案相同。其中,GP方案组为55例,PF方案组为20例,TPF方案组为59例。纳入标准:① 所有患者均行鼻咽部活检病理明确为非角化性未分化型癌;② 年龄18~70岁;③ 美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分小于等于1;④ 白细胞计数大于等于4×109个/ L,血红蛋白大于等于90 g/L,血小板大于等于100×109个/L;⑤ 谷丙转氨酶、谷草转氨酶小于1.5倍的正常值上限,肌酐清除率大于等于60 mL/min。排除标准:①存在临床或影像学证据证实的远处转移;② 既往有恶性肿瘤病史,或本次诊断为双原发肿瘤;③ 之前接受过放疗、化疗或手术等其他抗肿瘤治疗;④ 孕妇或哺乳期妇女;⑤ 原发灶或淋巴结行手术治疗(活检除外)。所有纳入研究的鼻咽癌患者分期均依据第7版国际抗癌联盟(Union for International Cancer Control,UICC)/美国癌症联合会(American Joint Committee on Cancer,AJCC)分期系统进行TNM分期。3组的基线特征见表1。
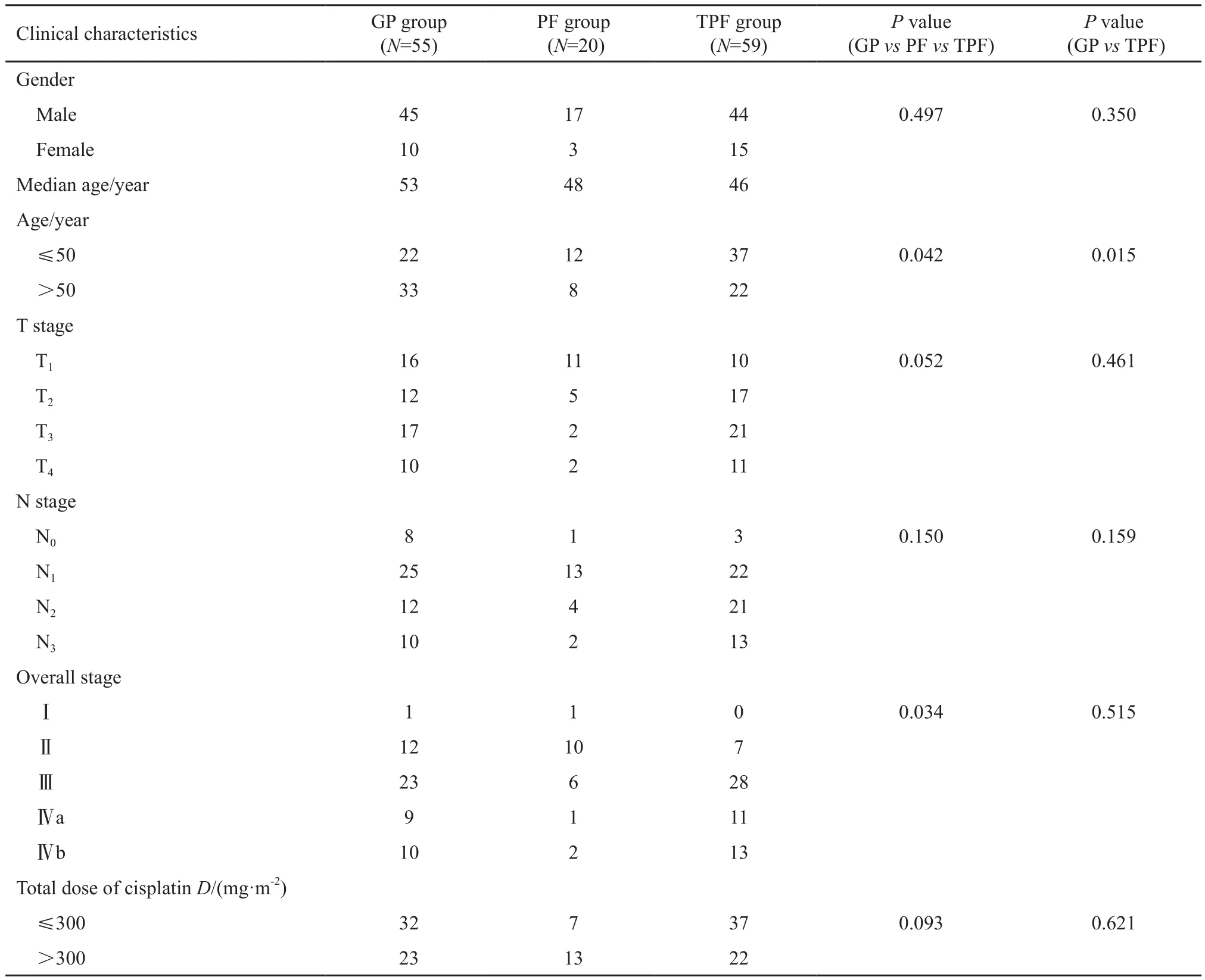
表 1 GP/PF/TPF 3组化疗方案的鼻咽癌患者基本临床特征Tab. 1 Comparison of clinical characteristics among three groups(n)
1.2 治疗方法
1.2.1 诱导化疗及辅助化疗
GP方案组采用GP方案化疗(吉西他滨1 000 mg/m2,第1、8天+顺铂25 mg/m2,第1~3天),PF方案组采用PF方案(顺铂25 mg/m2,第1~3天+氟尿嘧啶500 mg/m2,第1~5天,持续静脉滴注),TPF方案组采用TPF方案(多西他赛75 mg/m2,第1天+顺铂25 mg/m2,第1~3天+氟尿嘧啶500 mg/m2,第1~5天,持续静脉滴注)。化疗每3周重复,诱导化疗和辅助化疗各行2~3个疗程。化疗期间或结束后定期监测血常规、肝肾功能及电解质,必要时及时予以升白细胞、升血小板及抗感染等对症治疗。化疗相关不良反应评定采用常见不良事件评价标准(the Common Terminology Criteria for Adverse Events V4.0,CTCAE V4.0),3组化疗方案不良反应见表2。
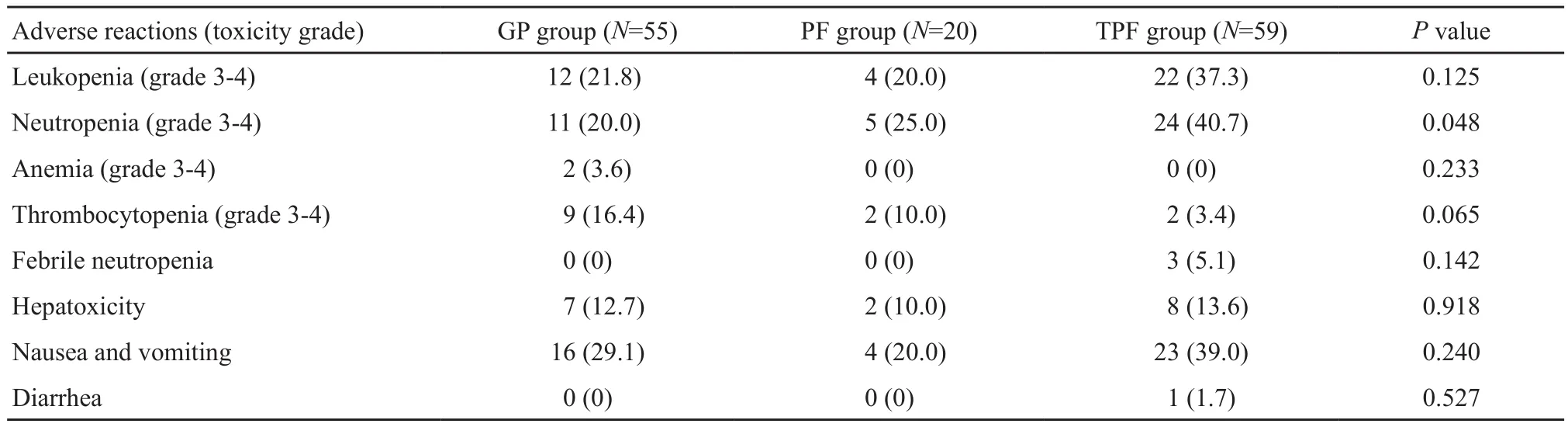
表 2 GP、PF及TPF 3组化疗方案不良反应比较Tab. 2 Comparison of adverse reactions among the three groups[n(%)]
1.2.2 放疗
诱导化疗结束后行IMRT。患者采用仰卧位,头颈肩面罩固定,定位CT扫描范围从头顶扫至锁骨头下2 cm,层厚5 mm。原发灶的大体肿瘤靶区(gross tumor volume,GTV)剂量为(66.0~70.4)Gy/(30~32)次,颈部转移淋巴结GTV剂量采用66.0 Gy/(30~32)次。高危、低危临床靶区剂量分别为60.0 Gy/(30~32)次和54.0 Gy/(30~32)次。正常组织剂量限制及处方剂量要求参见QUANTEC相关剂量限制标准。
1.3 随访
辅助化疗结束后在我院门诊定期随访,中位随访时间为62.72个月。治疗结束后2年内每3个月门诊随访1次,随后的3年里每6个月复查1次,5年以后每年复查1次。复查需采集病史并行体格检查,复查还需采用鼻咽镜及鼻咽MRI、腹部B超、胸片或胸部CT和骨扫描。
1.4 统计学处理
3组患者临床资料及不良反应的比较均采用χ2检验。OS、无病生存期(disease-free survival,DFS)和局部无复发生存期(local recurrence-free survival,LRFS)情况的组间比较采用Kaplan-Meier法。所有统计分析采用SPSS 17.0统计软件完成,P<0.05为差异有统计学意义。
2 结 果
2.1 3组化疗方案疗效比较
本研究纳入的134例患者中位年龄为50岁,大于50岁的患者在GP方案组、PF方案组和TPF方案组中的比例分别为60.0%、40.0%和37.3%。3组T3/T4期患者所占比例分别为49.1%、20.0%和54.2%。N2/N3期患者所占比例分别为40.0%、30.0%和57.6%。3组Ⅲ/Ⅳ期患者所占比例分别为76.4%、45.0%和88.1%。此外,3组因均采用联合顺铂方案,本研究对顺铂累积剂量进行探讨,3组顺铂累积剂量大于300 mg/m2的患者比例分别为41.8%、65.0%和37.3%。
GP方案组、PF方案组及TPF方案组的5年OS率分别为91.9%、75.1%和90.8%。5年DFS率分别为80.8%、71.5%和74.2%。5年LRFS率分别为95.8%、82.3%和96.0%。GP方案组的OS率高于PF方案组且差异有统计学意义(91.9% vs 75.1%,P=0.041,图1),LRFS率(95.8% vs 82.3%,P=0.058)、DFS率(80.8% vs 71.5%,P=0.332)虽高于PF方案组但差异无统计学意义(图2,图3)。TPF方案组的LRFS率也高于PF方案组且差异有统计学意义(96.0% vs 82.3%,P=0.043),但两组间的OS差异无统计学意义。
2.2 GP方案组与TPF方案组疗效比较
GP方案组与TPF方案组在性别、T分期、N分期、总分期及接受顺铂总剂量上的分布均衡(表1)。GP方案在5年OS率(91.9% vs 90.8%,P=0.721)和DFS率(80.8% vs 74.2%,P=0.309)上呈现略优于TPF方案的趋势,但差异无统计学意义。两组间的5年LRFS率相似(95.8% vs 96.0%,P=0.710)。
2.3 化疗期间3组不良反应情况
3组患者均未观察到Ⅲ、Ⅳ度非血液学毒性,如肝毒性、恶心呕吐及腹泻。TPF方案组Ⅲ、Ⅳ度中性粒细胞下降的发生率高于GP方案组及PF方案组(P=0.048),差异有统计学意义。TPF方案组Ⅲ、Ⅳ度白细胞下降及Ⅰ、Ⅱ度恶心呕吐均高于其他两组,但差异无统计学意义。此外TPF方案组有3例患者出现粒细胞减少伴发热,1例患者出现Ⅱ度腹泻。GP方案组Ⅲ、Ⅳ度血小板下降的发生率则高于PF、TPF方案组,差异无统计学意义。

图 1 GP方案组、PF方案组和TPF方案组的5年OS曲线Fig. 1 OS of groups GP, PF and TPF for 5 years
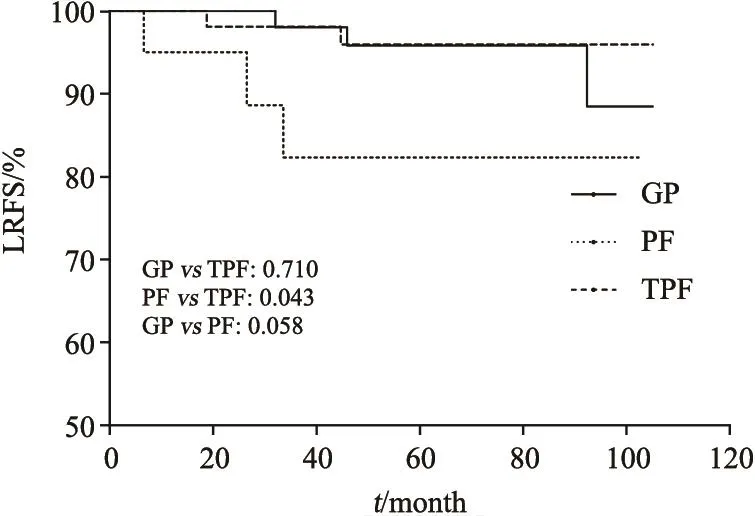
图 2 GP方案组、PF方案组和TPF方案组的5年LRFS曲线Fig. 2 LRFS of groups GP, PF and TPF for 5 years
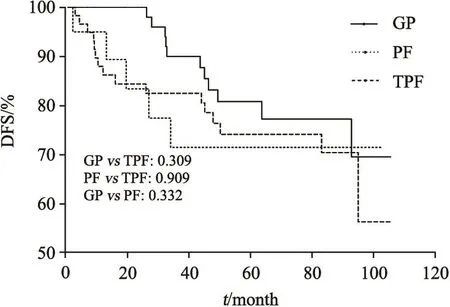
图 3 GP方案组、PF方案组和TPF方案组的5年DFS曲线Fig. 3 DFS of groups GP, PF and TPF for 5 years
3 讨 论
尽管多项研究已证明了在二维放疗时代同期放化疗在鼻咽癌治疗中的作用[1-4],但IMRT时代同期化疗的生存获益亟待证实。一项更新的Meta分析结果显示在同期放化疗联合辅助化疗组有生存获益,但其中大部分纳入的研究采用的是二维放疗[18]。有研究比较同期放化疗与IMRT同步补量(simultaneous integrated boost,SIB)的单纯放疗,两组患者的局控率(80.6% vs 90.8%,P=0.100)、OS率(71.7% vs 83.2%,P=0.201)、DFS率(63.9% vs 74.6%,P=0.070)和无远处转移生存率(79.6% vs 86.0%,P=0.270)相似。一项本中心的回顾性分析结果发现同期放化疗并非影响生存的独立预后因素[19]。基于对同期放化疗耐受性的考虑,诱导化疗联合IMRT及辅助化疗也是一种值得探索的治疗策略。该研究同时发现顺铂累积剂量超过300 mg/m2是影响DMFS、DFS和OS的独立预后因素[19]。所以本研究将顺铂累积剂量纳入临床特征分析。尽管3组患者在年龄、T分期和总分期中的分布方面差异有统计学意义,将GP方案组与TPF方案组进行比较,提示两组在性别、T分期、N分期、总分期及顺铂累积剂量的分布基本均衡。PF方案组局部晚期鼻咽癌患者比例较另外两组偏低,仅占45%,而顺铂累积剂量大于300 mg/m2的患者比例明显高于另外两组,这提示即使PF方案组的患者分期相对较早,顺铂累积剂量较高,也并未改善PF方案组患者的预后。
诱导化疗在临床广泛应用的优势主要在于:① 能快速减轻肿瘤负荷,减轻临床症状,同时肿瘤退缩后有利于放疗计划的设计以保护正常组织;② 放疗前肿瘤血供佳,肿瘤部位能达到有效的化疗药物浓度;③ 可杀灭微小转移灶;④ 患者对诱导化疗的耐受性较同期化疗及辅助化疗更好。Hui等[20]开展的一项Ⅱ期临床试验提示诱导化疗提高了3年的OS率(94.1%vs 67.7%,P=0.012)。一项Ⅲ期多中心随机临床试验报道在同期放化疗的基础上增加TPF方案诱导化疗能提高3年无失败生存率(80% vs 72%,P=0.034),提示TPF方案诱导化疗的增加可改善无失败生存 情况[8]。Peng等[10]对3 738例分别接受TPF方案、PF方案及TP方案(多西他赛联合顺铂)诱导化疗的局部晚期鼻咽癌患者进行比较,发现TPF方案在3年DFS率(84.7% vs 79.3%,P=0.004)、OS率(93.6% vs 90.8%,P=0.047)及LRFS率(94.1% vs 90.4%,P=0.002)优于PF方案,这一结论与本研究的结果相似。但是TPF方案的应用存在一定限制,氟尿嘧啶需要持续静脉滴注,而多西他赛需要地塞米松预处理,可能增加糖尿病、胃溃疡的发生风险。GP方案在复发、转移鼻咽癌中一线化疗的地位已在一项Ⅲ期随机临床试验中证实,GP方案与PF方案组的PFS差异有统计学意义(7.0个月 vs 5.6个月,P<0.000 1)[21]。Yau等[22]报道GP方案与PF方案诱导化疗两组生存情况相似,GP方案组鼻咽病灶的客观缓解率高于PF方案组(91.2% vs 75.0%,P=0.083)。但该研究纳入ⅣA/ⅣB期患者,局部区域病灶分期晚,可能难以观察到明显的局部区域控制率获益。Zheng等[23]分析604例经二维放疗或IMRT的局部晚期鼻咽癌患者,发现尽管诱导化疗的增加并未带来生存获益,但GP方案诱导化疗是OS的独立预后因素(P=0.038),并在无远处转移生存方面有改善生存的趋势(P=0.109),提示GP方案作为诱导化疗在治疗局部晚期鼻咽癌患者中可能优于TP方案或PF方案。相似的结果在Zhao等[24]的研究中也有报道,提示在非流行区鼻咽癌患者的亚组分析中,男性患者或双颈淋巴结转移患者经GP方案诱导化疗后较TP方案或PF方案在OS上差异有统计学意义。Wu等[16]发表的一项GP方案联合IMRT治疗局部晚期鼻咽癌的Ⅱ期临床试验结果报道了5年局部控制率、区域控制率、无远处转移生存率和OS率分别为93.2%、92.3%、89.0%和82.1%,提示GP方案联合IMRT是一种安全有效的治疗策略。
辅助化疗的地位目前仍存在争议。一项Meta分析结果提示同期放化疗联合辅助化疗较同期放化疗有生存获益[25]。另一项Meta分析结果则显示辅助化疗未能改善生存[26]。Chen等[27]发起的一项Ⅲ期多中心随机临床试验结果证明,同期放化疗联合PF方案辅助化疗与同期放化疗相比,2年无失败生存率差异无统计学意义(86% vs 84%,P=0.130)[27]。
在本研究诱导化疗联合放疗和辅助化疗这一治疗模式中,观察到GP方案在OS方面略优于PF方案,TPF方案在局部控制率上略优于PF方案,TPF方案在临床疗效方面并未优于GP方案,而中性粒细胞减少发生率显著高于其他两组。结合上述研究结果,这提示GP方案在临床疗效和不良反应方面可能优于PF方案及TPF方案。但因PF方案组病例数较少,且回顾性分析入组可能存在偏倚,这一结论尚需大样本的前瞻性临床试验来证实。GP方案在无远处转移鼻咽癌患者中的疗效值得进一步探索和验证。

