GRM4正向别构调节剂抑制乳腺癌细胞的增殖并促进细胞凋亡
李林海,肖 斌,郭梓璇,赖斯华,古丽米热•安外尔,符玉文,陈建芸,孙朝晖
1.中国人民解放军广州总医院检验科,广东 广州 510000;
2.嘉应学院检验系,广东 梅州 514000;
3.广州医科大学检验系,广东 广州 510000
谷氨酸受体是介导谷氨酸生物学作用的重要门控开关,是多种中枢神经系统疾病的治疗靶点。谷氨酸受体分为离子型谷氨酸受体和代谢型谷氨酸受体,其中代谢型谷氨酸受体4(glutamate metabotropic receptor4,GRM4)属于G蛋白偶联受体家族,可通过G蛋白介导直接与离子通道偶联,抑制K+和Ca2+通道开放,K+电导降低,引起缓慢的去极化,增加细胞的兴奋性[1],激活第二信使及下游信号转导系统。GRM4基因已被定位在EJM1区域内,并代表高级候选基因[2],是GRM的一员,在离子通道调节、神经元兴奋与神经递质释放等方面发挥重要作用。近年来,GRM4在肿瘤生物学中的机制研究逐渐被人们关注。研究表明GRM4在结肠癌[3]、前列腺癌[4]及骨肉瘤[5]等多种肿瘤中高表达并与肿瘤患者的预后相关,并且激活GRM4能够抑制成神经管细胞瘤的增殖能力[6]。但GRM4在乳腺癌中的生物学作用尚不清楚。
正向别构调节剂(positive allosteric modulators,PAM)是结合在别构酶的调节部位并激活该酶催化活性的生物分子,也是研究候选靶蛋白生物学功能的重要工具。近期,Selleck公司推出了两款GRM4的正向别构调节剂:VU0364439(分子式:C18H13C12N3O3S,相对分子质量:422.29)和VU0364770(C12H9CIN2O,相对分子质量:232.67),作为治疗帕金森病、焦虑和疼痛的候选药物。VU0364439的半最大有效浓度(concentration for 50% of maximal effect,EC50)为19.8 nmol/L,是目前为止最强的GRM4正性变构调节剂[7]。VU0364770是一种新研发的特异性的GRM4正向别构调节剂(EC50=1.1 μmol/L);经测试VU0364770对68种细胞膜受体,包括其他代谢性谷氨酸受体亚型均没有作用活性[8]。两种正向别构调节剂均对GRM4有较强的别构激活作用,且具有较好的特异性。
本研究拟分析VU0364439和VU0364770对多种乳腺癌细胞系增殖及凋亡的影响,为探索以GRM4为靶点的新的乳腺癌治疗方案提供思路。
1 材料和方法
1.1 细胞培养与实验试剂
人乳腺癌细胞系MCF-7、MDA-MB-231、SK-BR-3、BT474、HCC1937、MDA-MB-453和人正常乳腺癌上皮细胞MCF-10A均购自中国科学院上海生命科学研究院细胞库;细胞用DMEM培养基培养,在37 ℃、CO2体积分数为5%的培养温箱中生长。VU0364439(Cat:S8035,CAS:1246086-78-1,10 mmol/L溶于1 mL DMSO)和VU0364770(Cat:S2862,CAS:61350-00-3,10 mmol/L溶于1 mL DMSO)购自美国Selleck公司(图1);CellTiter-Glo®细胞活性检测试剂购自美国Promega公司(Cat:G7570);总RNA提取试剂盒(Cat:ER101-01)、逆转录试剂盒(AH341-01)、实时荧光定量聚合酶链反应(real-time fluorescent quantitative polymerase chain reaction,RTFQ-PCR)试剂盒(Cat:AQ131-01)和细胞凋亡试剂盒(Cat:FA101-01)购自北京全式金生物技术有限公司。
图 1 VU0364439和VU0364770的分子结构Fig. 1 The molecular structures of VU0364439 and VU0364770
1.2 化学发光法测定细胞增殖活性
将乳腺癌细胞系MDA-MB-231、MCF-7和SK-BR-3铺于96孔板中,每孔约1万个细胞,在各孔中分别单独加入不同浓度的VU0364439和VU0364770(4、20和100 μmol/L)及联合加入VU0364439和VU0364770(4、20和100 μmol/ L),以相应浓度的DMSO溶液作为阴性对照组并准备无细胞培养基的对照孔,以获得背景发光值。48 h后,每孔加入100 μL CellTiter-Glo®试剂,震荡混匀2 min使得细胞裂解,室温温育10 min后,用分光光度计记录荧光信号。
1.3 流式细胞术测定细胞凋亡
将乳腺癌细胞系MDA-MB-231、MCF-7和SK-BR-3铺于6孔板中,每孔约40万个细胞,在各孔中分别单独加入不同浓度的VU0364439和VU0364770(4、20和100 μmol/L)及联合加入VU0364439和VU0364770(4、20和100 μmol/ L),以相应浓度的DMSO溶液作为阴性对照组,48 h后,使用不含EDTA的胰酶消化收集细胞;用预冷的PBS洗涤细胞2次,500×g,4 ℃离心5 min,收集细胞;加入100 μL预冷的1×AnnexinⅤ结合缓冲液,重悬细胞;加入5 μL AnnexinⅤ-FITC和5 μL PI,轻轻混匀;室温避光反应15 min;加入400 μL预冷的1×AnnexinⅤ 结合缓冲液,轻轻混匀,将样品于冰上避光放置,1 h内用流式细胞仪检测。
1.4 RTFQ-PCR检测
1.4.1 RNA的提取
1.4.1.1 样品处理
使用胰蛋白酶处理6孔板中培养的乳腺癌细胞(约4×105个),4 ℃ 12 000×g离心5 min;轻弹离心管底部,使细胞沉淀松散,加入相应体积的裂解液BB4(每1 mL BB4,加10 μL β-巯基乙醇,现用现配)。剧烈旋涡震荡,直至细胞沉淀分散均匀;用RNase-Free的针管反复吹吸5~10次,使溶液均质化;室温下12 000×g离心5 min,吸上清液于RNase-Free的离心管中。
1.4.1.2 RNA提取
向上清液中加入1倍体积70%乙醇,漩涡振荡,分散沉淀;将得到的溶液和沉淀一起加入离心柱中,12 000×g离心30 s,弃掉流出液;向离心柱中加入500 μL CB4,室温12 000×g离心30 s,弃掉流出液;加入500 μL WB4,室温12 000×g离心30 s,弃掉流出液;室温12 000×g离心2 min,彻底去除残留的乙醇;将离心柱转入一个新1.5 mL RNase-Free的离心管中,并向离心柱中央加50 μL RNase-Free Water,室温静置1 min;室温12 000×g离心2 min,洗脱RNA;将RNA置于-80 ℃保存。
1.4.2 逆转录与RTFQ-PCR反应
逆转录反应体系:总RNA50 ng,5×SuperMix 4 μL,gDNA去除剂1 μL,加RNase-Free Water至20 μL。轻轻混匀体系,50 ℃温育15 min,85 ℃加热5 s失活逆转录酶及gDNA 去除剂。
RTFQ-PCR反应体系:cDNA模板 2 μL,正向引物0.2 μmol/L,反向引物0.2 μmol/L,2×RTFQ-PCR SuperMix 10 μL,加ddH2O至20 μL反应体系。
RTFQ-PCR反应条件:94 ℃ 30 s;94 ℃ 5 s,60 ℃ 30 s,40~45个循环,熔解曲线。GRM4上游引物为5’-TGAGGGTGCTGTCACGATCC-3’,GRM4下游引物为5’-ACGTGGCTGCCCTTCTTGAG-3’;β-actin上游引物为5’-ACAGAGCCTCGCC TTTGCCGAT-3’,β-actin下游引物为5’-CTTG CACATGCCGGAGCCGTT-3’。
2 结 果
2.1 GRM4正向别构调节剂抑制乳腺癌细胞增殖
在3种乳腺癌细胞系MDA-MB-231、MCF-7、SK-BR-3中,VU0364439和VU0364770在浓度为100 μmol/L时,对3种乳腺癌细胞的增殖均有显著的抑制作用,而浓度为4和20 μmol/L时抑制作用不明显。VU0364439和VU0364770联合使用时,也能够抑制3种乳腺癌细胞的增殖,但抑制效果与单独使用VU0364439和VU0364770基本一致(图2)。
2.2 GRM4正向别构调节剂促进乳腺癌细胞凋亡
在MCF-7细胞中,DMSO处理组的平均细胞凋亡百分比(Q2+Q3)为16.36%,而加入VU0364439和VU0364770后,细胞凋亡百分比分别达到了32.47%和42.71%;与对照组相比,联合使用VU0364439和VU0364770也显著促进MCF-7细胞凋亡,但联合使用与单独使用相比差异无统计学意义(图3)。
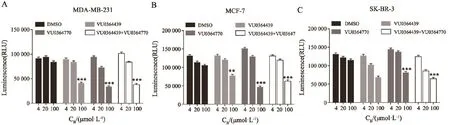
图 2 化学发光法测定VU0364439和VU0364770的单独使用和联合使用对3种乳腺癌细胞增殖能力的影响Fig. 2 Chemiluminescence assay showed the eあect of VU0364439 and VU0364770, which were used alone or in combination on the proliferation of three breast cancer cells lines
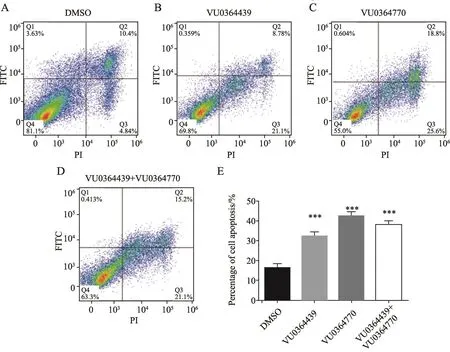
图 3 流式细胞术检测单独使用或联合使用VU0364439和VU0364770对乳腺癌细胞系MCF-7凋亡的影响Fig. 3 Flow cytometry assay showed the eあect of VU0364439 and VU0364770, which were used alone or in combination on the apoptosis of breast cancer cell line MCF-7
2.3 GRM4正向别构调节剂促进GRM4基因的表达
RTFQ-PCR检测GRM4在6种不同的乳腺癌细胞系及正常乳腺上皮细胞MCF-10A中的表达,如图4A所示,GRM4在多数乳腺癌细胞及对照细胞中表达较低,而在MCF-7中表达水平最高。在MCF-7细胞中,单独或联合使用VU0364439和VU0364770均能促进GRM4的表达,而联合使用VU0364439和VU0364770与单独使用对GRM4基因表达的促进作用差异无统计学意义(图4B)。
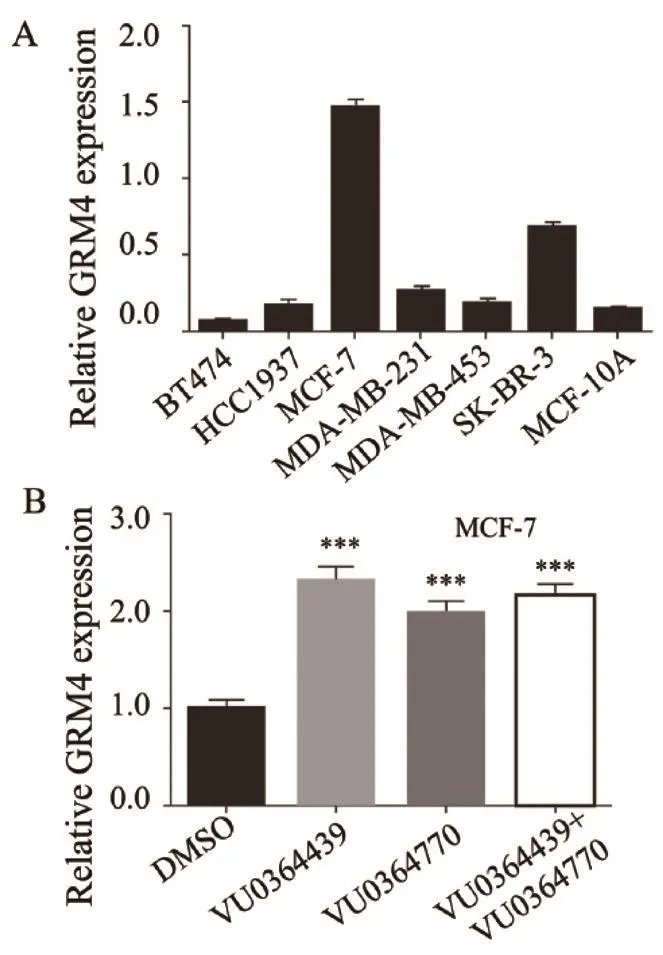
图 4 VU0364439和VU0364770促进GRM4的表达Fig. 4 VU0364439 and VU0364770 promoted the expression of GRM4
3 讨 论
GRM4是代谢型谷氨酸受体的一种亚型,是G蛋白偶联受体(G protein-coupled receptor,GPCR)家族C组的成员。GRM4在肿瘤生物学中的研究报道较少,原因之一就是缺乏选择性配体,特别是通过正位作用位点以外的区域起作用的别构调节剂[9]。本研究以体外培养的乳腺癌细胞系为研究对象,初步探讨了VU0364439和VU0364770对乳腺癌细胞系增殖和凋亡的影响。研究发现,当两种别构调节剂达到一定使用浓度时,均能够抑制多种乳腺癌细胞的增殖,并且促进乳腺癌细胞凋亡;两种别构调节剂联合使用时,并没有起到叠加效应。两种别构调节剂均能够促进GRM4基因的表达,但联合使用与单独使用相比差异无统计学意义。以上结果表明,GRM4可能是乳腺癌的抑癌基因。
别构调节剂是结合在别构酶的调节部位调节该酶催化活性的生物分子。别构调节剂可以是激活剂(正向),也可以是抑制剂(反向)。正向别构调节剂与GRM4的结合与调控作用机制极为复杂,可能涉及到蛋白构象的重组或相互作用蛋白及下游信号通路的改变,还可能通过正反馈通路促进GRM4基因的表达。事实上,一些正向别构调节剂已在肿瘤的治疗中体现出了其潜在的临床应用价值,如A型氨基丁酸受体GABAAR的正向别构调节剂3α-diol可以影响前列腺癌细胞的增殖[10];MRS1477是TRPV1通道的正向别构调节剂,其与辣椒素的联合使用能够协同发挥抑制乳腺癌增殖的作用[11]。
GRM4作为抑癌基因的作用仅在神经管细胞瘤中有报道,而研究表明GRM家族的其他成员在多种肿瘤中发挥重要作用。GRM3主要表达于小鼠骨髓瘤细胞系SP2/0的细胞凋亡中期,敲低GRM3能显著抑制细胞凋亡[12];GRM5与肝癌细胞的发生、发展关系密切,其抑制剂MPEP能够促进肝癌细胞凋亡,抑制肝癌细胞迁移[13]。GRM1是报道最多的GRM家族成员,其可作为乳腺癌抗血管生成治疗方案的药物作用靶点[14],也是软骨黏液样纤维瘤中重要的致癌驱动基因[15]。由此可见,GRM家族的不同成员在各种恶性肿瘤中发挥不同作用。
综上所述,本研究初步对GRM4的两种正向别构调节剂对乳腺癌细胞增殖和凋亡的作用进行了探讨,进一步配合一些常规化疗药物进行辅助治疗验证是我们下一步的研究目标,本研究为探索以GRM4为靶点的乳腺癌治疗方案奠定了基础。

