江西和广东烟草青枯菌对噬菌体的敏感性及聚类分析
余成鹏,胡蓉花,陈小强,苏 颖,林培炯,刘琼光*
(1.华南农业大学 农学院,广东 广州 510642;2.江西省吉安市烟草公司,江西 吉安 343000)
茄科劳尔氏菌(Ralstoniasolanacearum,俗称青枯菌)是世界性重要植物病原细菌,广泛分布于热带、亚热带以及部分温带地区,能侵染 54 个科450 余种植物[1-2]。青枯菌是一个多变的复合种(species complex),其寄主范围、地理分布、致病性以及生理特性具有多样性和复杂性[1,3],因此,对其种下分类研究较多,包括传统的生理小种(race)和生化变种等(biovar)[4-5]。Fegan[6]和Prior[7]提出以演化型分类框架来描述青枯菌种以下的差异。
中国青枯菌具有丰富的遗传多样性,存在着演化型I型中的10个序列变种,以及演化型II型中的1个序列变种、其中演化型I型菌种为中国的优势菌系。迄今为止,在中国尚未发现演化型III型和演化型IV菌株[8]。
由青枯菌引起的烟草青枯病是我国烟草种植区严重的病害之一,目前尚未有理想的化学防治药剂。噬菌体(bacteriophage,phage),是一种感染细菌的病毒,广泛存在于自然界,数目庞大[9],且具有专化性和特异性等特点,探讨利用噬菌体来防治植物病害引起了研究者的广泛兴趣[10]。利用噬菌体对烟草青枯病进行防治,发现能有效降低烟草青枯病的发病率[11],显示噬菌体防治作物青枯病的良好前景。然而,实际应用中,还受到噬菌体寄主范围的限制。
尽管我国各地烟草青枯菌主要属于1号小种,生化变种III(生化型III)[12-19],然而,对这些菌株的进一步聚类分析较少,而且,目前尚未有利用噬菌体对青枯菌进行遗传分类。本论文目的是测定6个不同噬菌体对来自广东和江西的烟草青枯菌的侵染,并基于青枯菌对噬菌体的敏感性试验,进一步对烟草青枯菌进行聚类分析,明确6个噬菌体的寄主范围,及烟草青枯菌的聚类分组,其结果将有助于揭示噬菌体与青枯菌之间的关系,为生产上烟草青枯菌的流行监测,青枯病的防治等提供重要的信息和科学依据。
1 材料与方法
1.1 供试培养基
1.1.1 普通细菌培养基 牛肉膏3 g,酵母菌3 g,蛋白胨3 g,硫酸镁0.25 g,硫酸氢二钾2 g,硫酸二氢钾0.5 g,蔗糖15 g,琼脂20 g,蒸馏水1 000 mL。
1.1.2 半固体培养基 牛肉膏3 g,酵母菌3 g,蛋白胨3 g,硫酸镁0.25 g,硫酸氢二钾2 g,硫酸二氢钾0.5 g,蔗糖15 g,琼脂8 g,蒸馏水1 000 mL。
1.1.3 LB液体培养基 胰蛋白胨(tryptone)10 g,酵母提取物(yeast extract)5 g,NaCl 10 g,琼脂粉15 g,蒸馏水1 000 mL,pH=7.4。
1.1.4 TTC培养基 水解干酪素1 g,蛋白胨10 g,甘油5 mL,琼脂32 g,1%三苯基四氮唑(TTC)10 mL,蒸馏水1 000 mL。
1.2 供试菌株及其来源
供试的75个烟草青枯菌菌株分别来自江西省吉安、赣州和抚州,广东省梅州和韶关等,由华南农业大学细菌实验室保存和提供(表1)。
1.3 供试噬菌体
供试6个烟草青枯菌噬菌体分离自江西省和广东省烟田土壤,分别为P1521、P1553、P1556-1、P1556-2、P574-2和P7-1,由华南农业大学细菌研究室保存和提供。
1.4 烟草青枯菌培养
供试烟草青枯菌以及供试噬菌体的宿主烟草青枯菌先用固体培养基平板活化,取单菌落接种于10 mL的LB液体培养基中,于30 ℃,180 r/min的恒温振荡培养24 h。
1.5 噬菌体增殖培养
取1 mL供试噬菌体和1 mL其宿主菌于10 mL的LB液体培养菌中,于30 ℃ 180 r/min的恒温震荡培养24 h。
1.6 噬菌体侵染试验
采用双层平板检测法,具体步骤为:取1 mL供试烟草青枯菌菌液加入150 mL冷却至45 ℃的半固体培养基中,混匀后快速倒入含有普通细菌培养基的平板上,每个平板约12 mL,制成双层平板,待平板冷却凝固后,取3 μL供试噬菌体液点接在上述平板表面,30 ℃培养2 d,观察并记录平板上产生噬菌斑情况。
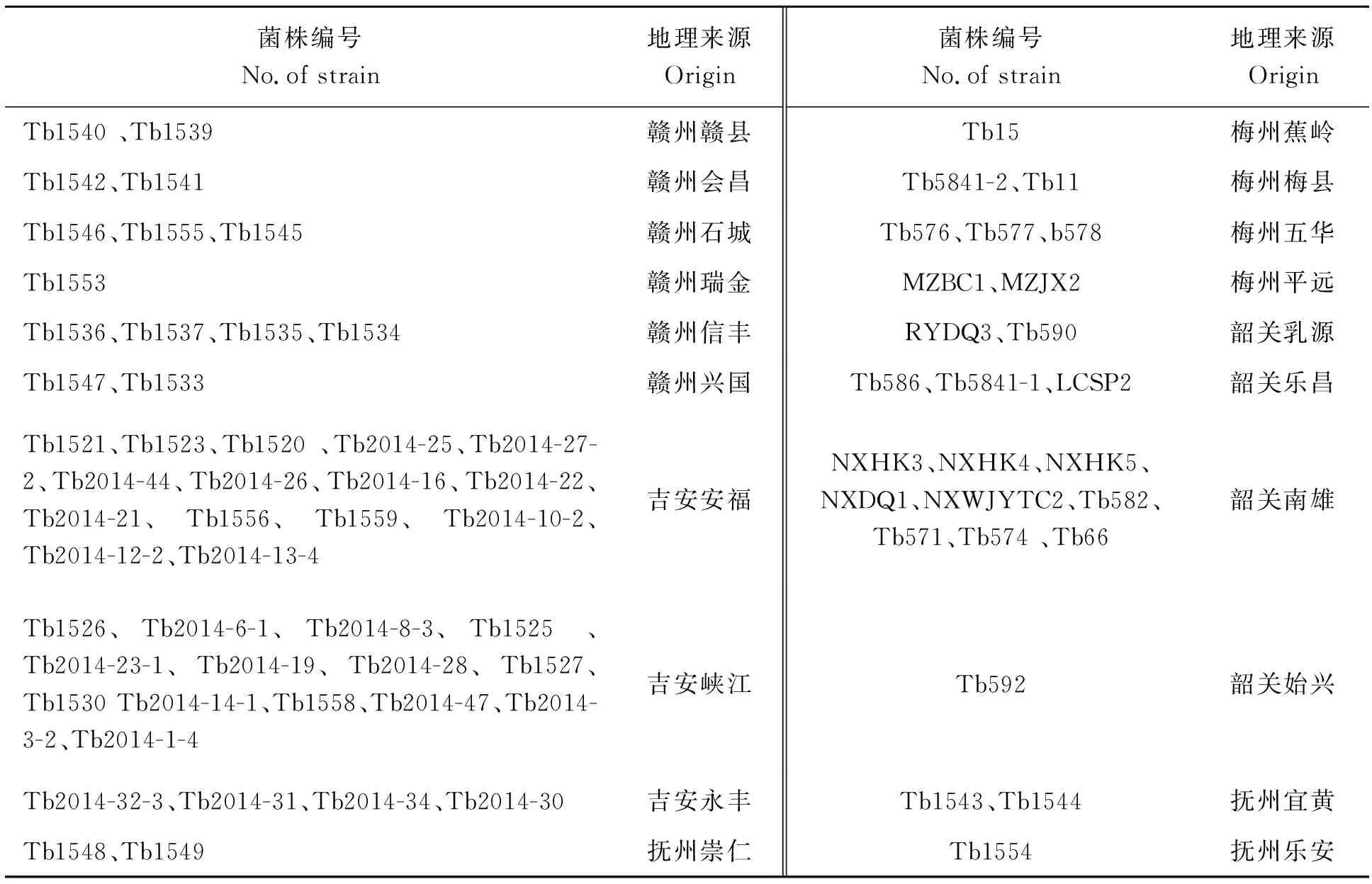
表1 75个烟草青枯菌菌株编号和地理来源
1.7 数据处理
根据双层平板上噬菌斑的有无,记录每个供试青枯菌对6个噬菌体的敏感情况,有噬菌斑记为“1”,无噬菌斑记为“0”,制成Excel表格用于聚类分析。
采用PASW Statistics 18 软件,对结果组间连接方法进行系统聚类,绘制出聚类树状图,进行利用噬菌体分析烟草青枯菌的遗传多样性。
2 结果与分析
2.1 噬菌体侵染青枯菌平板检测

指示菌为青枯菌NXWJYTC2菌株Indicative strain was NXWJYTC2图1 双层平板培养检测噬菌斑Fig.1 The detection of phage by double plate plaque assay
通过双层平板检测法,测定了6个噬菌体P1521、P1553、P1556-1、P1556-2、P574-2和P7-1对75个烟草青枯菌的侵染和裂解作用,如果某个青枯菌指示菌株的平板上产生噬菌斑,说明该噬菌体侵染并裂解该青枯菌(图1),反之,如无噬菌斑出现,说明噬菌体不侵染该青枯菌。
2.2 6个噬菌体的寄主范围及噬菌体分组
6个噬菌体对75个青枯菌的裂解情况见表2。从表2中看出,有17个青枯菌菌株都能被6个噬菌体裂解,而6个噬菌体都不能裂解青枯菌Tb15菌株。不同噬菌体裂解75个青枯菌存在差异。噬菌体P1556-1能侵染65个青枯菌菌株,其中包括了78.26%的广东菌株和90.38%的江西菌株,占供试青枯菌的86.7%,噬菌体P1521,能侵染63个青枯菌菌株,噬菌体P1553侵染的青枯菌最少,只能侵染其中的24个菌株,其中广东菌株占52.17%,江西菌株占23.08%。不同噬菌体侵染的青枯菌数量存在差异(表3),进一步分析发现,如果以侵染90%以上的菌株为衡量标准,那么在江西赣州烟区可使用P1556-1和P1521噬菌体,江西吉安烟区可使用P1556-1和P7-1噬菌体,抚州烟区可用P1521和P574-2,广东韶关烟区适宜使用P574-2噬菌体,而噬菌体P1553寄主范围较窄,不适宜在广东和江西两省烟区使用。

表2 6个噬菌体对75个青枯菌的裂解情况
“+”:有噬菌斑;“-”:无噬菌斑
“+”,with plaque,“-”:no plaque
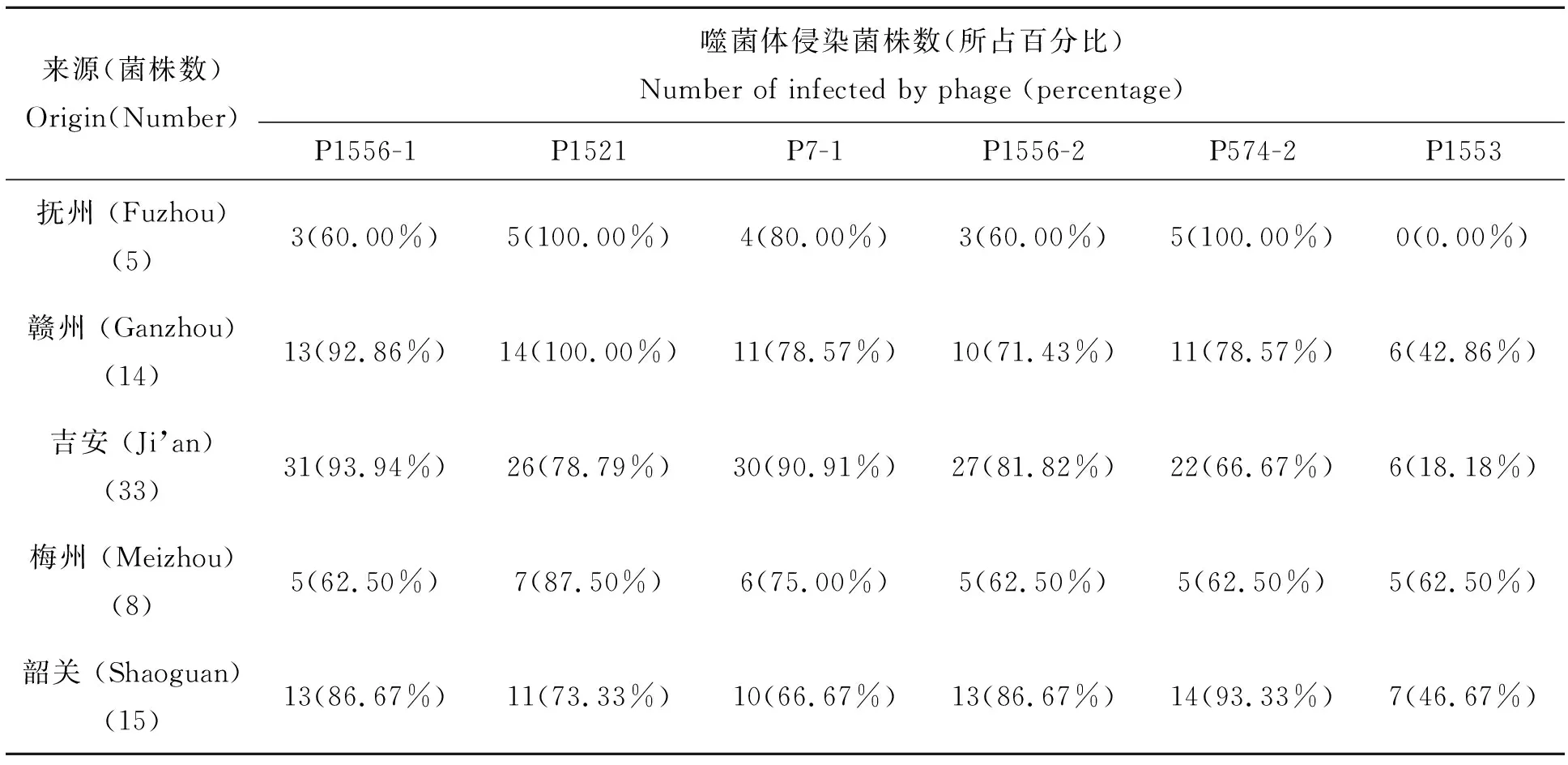
表3 6个噬菌体可侵染的烟草青枯菌数量及其所占比例
根据6个噬菌体对75个青枯菌的侵染情况,可将6个噬菌体分为3组,其中P1556-1,P1556-2和P7-1为P-I组,P-II组包括P1521和P574-2,P1553为P-III组(图2)。
2.3 基于噬菌体对75个烟草青枯菌的聚类分析

图2 基于对75个青枯菌侵染而进行的噬菌体分组Fig.2 Phage types based on the infection to 75 strains of Ralstonia solanacearum
从上述寄主范围较广、寄主范围中等和寄主范围较窄的3组噬菌体中,各选择1个噬菌体,如P1556-1、P574-2 和P1553,对75个青枯菌进行聚类分析,结果表明,75个青枯菌可分为7个遗传组(Rs-I~Rs-VII)(表2、表4和图3),其中Rs-IV菌株数量较多,包括31个青枯菌,占供试菌株的41.33%,这些菌株对P1553噬菌体均不敏感,而对P1556-1和P574-2 2个噬菌体敏感,其次为Rs-VII遗传组,共有18个菌株,它们均对3个噬菌体敏感,Rs-I 只有2个菌株,各来自江西峡江和广东蕉岭,它们对这3个噬菌体均不敏感,Rs-II 共有13个菌株,它们表现为对噬菌体P1556-1敏感,而对P574-2 和P15533不敏感。Rs-III有5个菌株,表现为对噬菌体P574-2敏感,对P1556-1和P15533不敏感。Rs-V共有3个菌株,它们对P1556-1不敏感,而对噬菌体P574-2 和P15533敏感。而在Rs-VI中的3个青枯菌中,均表现为对P1556-1和P15533敏感,对噬菌体P574-2不敏感。说明,75个烟草青枯菌之间存在较多的异质性和遗传差异。
进一步分析结果发现,来自江西和广东两省烟区的青枯菌存在差异(表5),其中Rs-IV遗传组在各烟区所占比例均较大,分别来自广东省4个县和江西省9个县的烟区,其中,在江西省吉安和赣州烟区所占比例最大,抚州市(乐安、宜黄和崇仁)烟区5个菌株只分布在Rs-IV和Rs-III遗传组。在广东省二大烟区中,其青枯菌除了在Rs-VI中没有分布之外,其它遗传组中青枯菌也是零星分布,韶关烟区不含有Rs-I遗传组,梅州烟区不含有Rs-III遗传组。Rs-V遗传组全部来自广东省烟区,没有江西烟区菌株,而Rs-VI遗传组则不含有广东烟区菌株,说明,江西和广东两省烟草青枯菌存在差异(表5)。

表4 基于噬菌体P1556-1、P574-2和P1553对75个青枯菌的分型结果

图3 基于噬菌体P1556-1,P574-2和P1553对75个青枯菌聚类Fig.3 The clustering analys of 75 Ralstonia solanacearum strains based on phage P1556-1,P574-2 and P1553
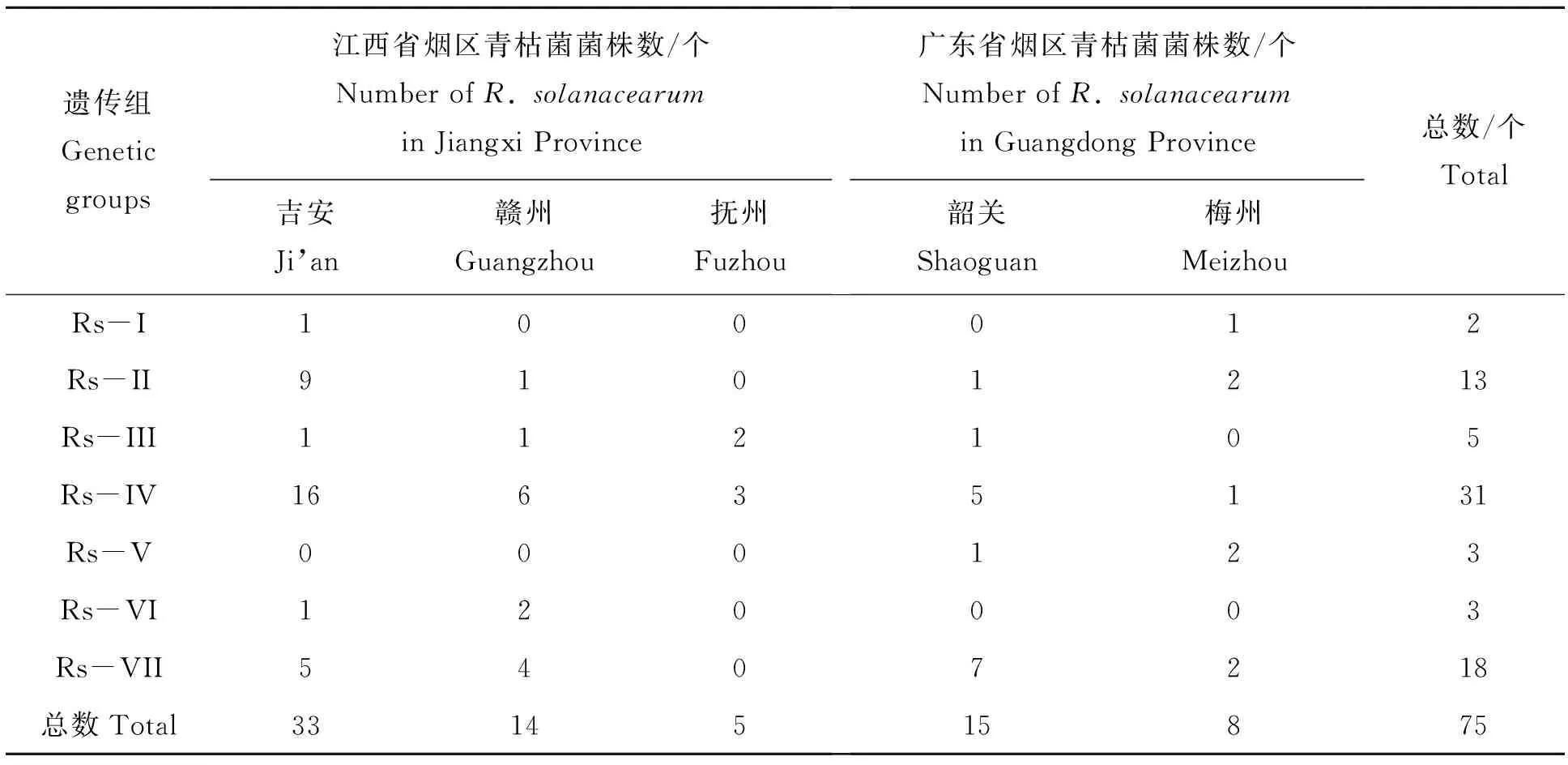
遗传组Genetic groups江西省烟区青枯菌菌株数/个Number of R. solanacearumin Jiangxi Province吉安Ji’an赣州Guangzhou抚州Fuzhou广东省烟区青枯菌菌株数/个Number of R. solanacearum in Guangdong Province韶关Shaoguan梅州Meizhou总数/个TotalRs-I100012Rs-II9101213Rs-III112105Rs-IV16635131Rs-V000123Rs-VI120003Rs-VII5407218总数Total3314515875
3 讨论与结论
随着噬菌体分离技术的提高以及噬菌体治疗技术在人类疾病上的成功应用,近年来,作物上利用噬菌体进行细菌性病害防治也有了跨越式的发展[20],如利用噬菌体防治辣椒和番茄叶斑病(Xanthomonascampestrispv.vesicatoria.)[21]和梨火疫病(Erwiniaamylovora)等[22]。在青枯病菌噬菌体研究方面,从青枯菌筛选到的2个噬菌体菌株,能降低烟草青枯病的发病率[11]。裂解谱较广的噬菌体M-DS1可以用来检测土壤青枯菌的存在,其检测灵敏度达102cfu/g[23]。国外有研究报道利用噬菌体防治作物青枯病,并完成了有关噬菌体的基因组序列分析[24-26],这为噬菌体基因库增添了新的资料,尽管如此,但至今噬菌体制剂产品的应用仍然极少。尽管利用噬菌体防治作物青枯病显示了良好的应用前景,但是,依靠噬菌体进行青枯病防治依然存在一些问题,如噬菌体侵染的寄主范围有限,青枯菌的遗传多样性丰富。
本研究测定了6个青枯菌噬菌体对75个烟草青枯菌侵染试验,结果表明,噬菌体P1556-1、P1521和 P7-1寄主范围较广,能侵染其中80%以上的青枯菌,噬菌体P1553寄主范围较窄,为此,在利用噬菌体防治青枯病的实际应用中,要考虑噬菌体的寄主范围。据此,笔者认为,在江西赣州烟区适宜使用P1556-1和P1521噬菌体,江西吉安烟区可使用P1556-1和P7-1噬菌体,抚州烟区可用P1521和P574-2,而广东韶关烟区适宜使用P574-2噬菌体,噬菌体P1553寄主范围较窄,不适宜在广东和江西两省烟区使用。然而,6个噬菌体的田间应用及防治效果,还需要进一步的田间防治试验。
青枯菌具有高度的变异性和适应性,不同地域之间以及不同寄主的菌株间有明显的变异以及分化现象[7],所以目前针对青枯菌的遗传多样性的研究有很多文献报道。然而,基于噬菌体对青枯菌的聚类分析鲜见报道。本论文选取了广东和江西省20个县市的75个烟草青枯菌菌株,测定了它们对3个代表性的青枯菌噬菌体的敏感性,结果表明,75个青枯菌可分为7个遗传组(Rs-I~Rs-VII)。聚类结果表明,Rs-IV遗传组菌株数量较多,包括31个青枯菌,占供试菌株的41.33%,是江西和广东省烟区的优势菌株,这些菌株对P1553噬菌体均不敏感,但却能被噬菌体P1556-1和P574-2裂解。其次为Rs-VII遗传组,共有18个菌株,它们均能被P1556-1、P574-2和 P1553等噬菌体裂解,而来自江西峡江的Tb2014-3-2和广东蕉岭的Tb15菌株对P1556-1、P574-2和 P1553 3个噬菌体均不敏感。进一步分析结果发现,来自江西和广东两省五大烟区的青枯菌也存在差异,Rs-IV遗传组在江西省吉安和赣州烟区所占比例最大,抚州烟区5个菌株只分布在Rs-IV和Rs-III遗传组。在广东省二大烟区中,其青枯菌除了在Rs-VI中没有分布之外,其它遗传组中青枯菌也是零星分布,韶关烟区不含有Rs-I遗传组,梅州烟区不含有Rs-III遗传组。Rs-V遗传组只含有广东省烟区菌株,而Rs-VI遗传组则不含有广东烟区菌株,基于噬菌体对青枯菌聚类分析的结果,表明,部分遗传组与青枯菌的地理来源存在一定的相关性。我国广东[16],福建[13],贵州[15],江西[18],湖北[14],河南[19]等烟区,先后进行了烟草青枯菌菌系分化研究,主要属于1号小种,生化变种III,但还不能从根本上反映广东和江西两省烟草青枯菌菌株之间的差异,因为它们都属于1号小种和生化型III,本研究基于噬菌体方面反映了江西和广东两省烟草青枯菌的菌系的差异,进一步丰富了前人的研究结果。

