江西赣州桃果炭疽病菌的形态及分子鉴定
叶梦斐,周 烨,刘佳文,崔汝强,石绪根
(江西农业大学 农学院,江西 南昌 330045)
桃(AmygdaluspersicaL.),蔷薇科、桃属植物,是一种果实作为水果的落叶小乔木,花可以观赏,果实多汁,可以生食或制桃脯、罐头等,核仁也可以食用。果肉有白色和黄色的,桃有多种品种,一般果皮有毛,“油桃”的果皮光滑;“蟠桃”果实是扁盘状;“碧桃”是观赏花用桃树,有多种形式的花瓣。桃原产中国,栽培历史悠久,各省区广泛栽培[1]。江西省是我国南方桃的重要产区之一,产业基础较好,在落叶果树中,桃是仅次于梨的经济栽培树种。据统计,2015年江西桃栽培面积10 716 hm2,产量63 705 t[2],南昌市、景德镇市、九江市、赣州市、上饶市为主产地区。桃炭疽病广泛分布于各大产区,为桃的重要病害之一,对产量影响极大。炭疽病主要危害果实,幼果感病时果面呈暗褐色,发育缓慢甚至停滞,直至萎缩硬化。稍大的果实在发病初期,会产生淡褐色的水渍状斑点,并且逐渐扩大,形成红褐色的圆形或椭圆形凹陷病斑,在潮湿环境中也会有橘红色的小粒点长出。在江西省内的主产区中,赣州市龙南县武当镇桃产量受炭疽病影响较为严重。但尚不清楚龙南县武当镇桃炭疽病由何种炭疽菌引起,无法实施有效的防治措施。为此,笔者将形态学和分子生物学结合,对其病原进行了鉴定。
1 材料与方法
1.1 病果采集
2017年7月于江西省赣州市龙南县武当镇桃园采集呈典型症状的桃果实炭疽病病果样品(图1),样品采回后立即进行病菌分离。
1.2 病原分离与纯化

图1 桃果实炭疽病发病样品Fig.1 The sample of diseased peach fruit of Colleto trichum
1.2.1 分离 按常规组织分离法分离病菌,分离培养基为PDA。用接种针轻轻刮取病果发病组织表面的孢子,并在1 mL无菌水中震荡3~5 s制成孢子悬浮液,吸取100 μL孢子悬浮液于PDA平板培养基上,涂布均匀,倒置放入人工气候箱中,26 ℃,培养5~6 d后观察待分离菌的生长情况。
1.2.2 纯化 挑取菌落边缘菌丝于PDA平板培养基中,倒置放入人工气候箱中培养,逐日观察菌落形态特征,待分生孢子团形成后,镜检分生孢子形态,并随机选取50个分生孢子测量其大小。
1.3 病菌致病性测定
按照柯赫氏法则要求,对分离的病菌进行致病性测定。致病性测定方法如下:取已灭菌的培养皿,倒入PDA制成空白培养基备用;用无菌打孔器分别在分离株(大概10个)和空白培养基(大概10个)中打菌饼;取健康桃子,先用无菌水冲洗,棉球擦干,再用体积分数为75%酒精擦洗,棉球擦干;用同一打孔器在桃子两处打孔,用镊子小心撕去果实表皮,分别将分离株与空白培养基接种到果实伤口处,3个重复;接种后,用无菌水保湿;将接种后的果实放入无菌托盘中,保鲜膜覆盖后,置于恒温培养箱中(28 ℃,60%湿度,光照∶黑暗= 16∶8)培养。待病斑出现后,进行病菌再分离,观察孢子形态与原分离株是否一致。
1.4 分子鉴定
1.4.1 rDNA-ITS序列扩增 用无菌吸水纸吸干菌丝水分,用液氮碾磨后,转移至1.5 mL离心管中,按照基因组DNA提取试剂盒(博彩生物公司)操作说明提取DNA,经10 g/L琼脂糖凝胶电泳检测DNA样品质量。用通用引物ITS1:5′-TCCGTAGGTGAACCTGCGG-3′,ITS4:5′-TCCTCCGCTTATTGATATGC-3′[3]扩增rDNA-ITS序列,PCR反应在25 μL体系中进行,体系如下:10×PCR Buffer 2 μL,dNTP Mix 2 μL,DNA模板1 μL,引物ITS 10.5 μL,引物ITS4 0.5 μL,rTaq酶0.2 μL,ddH2O18.8 μL;PCR扩增程序如下:94 ℃预变性4 min,94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸1 min,35个循环后,72 ℃ 10 min,4 ℃保存运行。PCR产物经10 g/L琼脂糖凝胶电泳检测。
1.4.2 TA克隆 参照割胶回收试剂盒(AXYGEN公司)操作说明回收PCR产物,进行TA克隆[4],实验方法如下:取4 μL割胶回收的产物、1 μL PMD-T-18和5 μL Solition Ⅰ于PCR管中混匀,16 ℃反应30 min,利用冻融法将连接产物转化进入感受态大肠杆菌DH5α中,均匀涂布于含50 mg/L Amp的LB平板上,37 ℃培养12~16 h后,用通用引物M13F:5′-GTAAAACGACGGCCAGT-3′,M13R:5′-CAGGAAACAGCTATGAC-3′进行菌落PCR鉴定阳性重组子,PCR反应体系如下:10× PCR Buffer 2 μL,dNTP Mix 2 μL,单菌落模板0 μL;引物各0.4 μL,rTaq酶0.2 μL,ddH2O 15 μL,PCR扩增程序如上述。扩增产物经10 g/L琼脂糖凝胶电泳检测,测序并-80 ℃冰箱中保存菌种。
1.4.3 构建系统进化树 采用MEGA7.0软件[5],构建分离株与其他12种炭疽病病原菌之间的系统进化树,构建方法是邻接法(neighbor-joining,NJ),自引导值(Bootstrap Replication)设为1 000,其他依照默认设置。
2 结果与讨论
2.1 病菌形态及大小观测
本实验通过组织分离法从病果中分离获得4个形态几乎一致的真菌,在PDA平板上菌落初为白色,后由中部向边缘逐步变为灰绿色,背面为黄绿色,近圆形,上有黑色小点,菌落蓬松,边缘整齐、光滑,菌落生长速率12.4 mm/d。显微镜下观察,其分生孢子呈圆柱形,单孢,两端钝圆,孢子大小为(19.19~26.08) μm×(5.91~9.35) μm。根据分离株的形态特征,查阅相关文献[6-7],推测赣州市桃果炭疽病菌属于胶孢炭疽菌(Colletotrichumgloeosporioides),其在菌落形态及孢子形态如图2所示。

A:菌落正面形态特征;B:菌落背面形态特征;C:分生孢子形态A:The obverse side morphological characteristics of the colony,B:The reverse side morphological characteristics of the colony,C:The morphology of conidium图2 赣州桃果炭疽病菌菌落及分生孢子形态特征 Fig.2 The morphological characteristics of bacterial colony and conidia of Colletotrichum gloeosporioides in Ganzhou
2.2 病菌致病性测定结果
将分离株进回接至健康果实中,恒温培养7 d,发现分离株回接产生的病斑与原始症状相似,且从回接病斑中分离到与原始分离株形态及孢子大小一致的病原菌。致病性测定结果见图3。
2.3 rDNA-ITS 序列测定及同源性分析
2.3.1 DNA电泳结果 采用博彩生物基因组DNA提取试剂盒方法提取分离株基因组的DNA,结果见图4。
2.3.2 rDNA-ITS序列扩增 以分离株基因组DNA为模板,用真菌鉴定通用引物ITS1和ITS4进行PCR扩增,扩增产物经10 g/L琼脂糖凝胶电泳检测,可知扩增序列大小约为550 bp,符合预期大小,结果见图5。
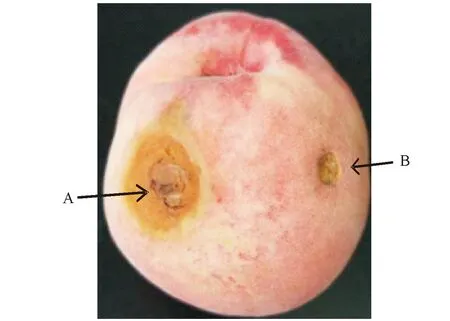
A:分离菌回接;B:空白对照A:The inoculation isolated fungi;B:Blank control图3 回接桃果病斑Fig.3 The disease spots of the inoculated peach fruit
M:DL 2 000 Maker;1~2:分离菌基因组DNAM:DL 2 000 Maker;1-2:The DNA genome of isolated fungi图4 分离菌DNA电泳结果Fig.4 The DNA electrophoresis of isolated fungi
2.3.3 TA克隆 将回收纯化的扩增产物连接克隆至载体PMD-T-18上,利用菌落PCR法,阳性克隆鉴定,扩增后得到片段约700 bp,符合预期大小,确定为阳性克隆,保存阳性克隆送苏州泓迅生物科技有限司测序,电泳结果见图6。
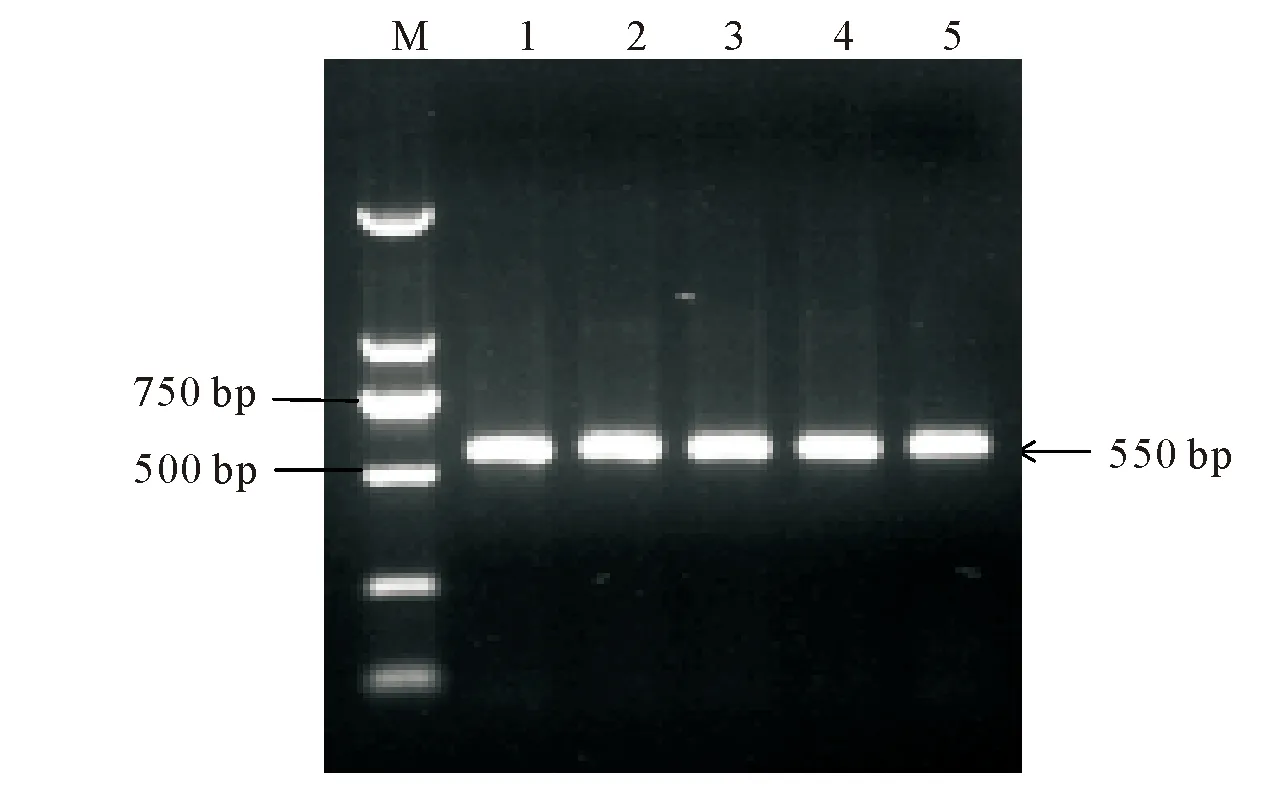
M:DL 2 000 Maker;1~5:rDNA-ITS序列M:DL 2 000 Maker;1-5:rDNA-ITS sequence图5 分离菌rDNA-ITS扩增电泳Fig.5 The rDNA-ITS sequence of isolated fungi
M:DL 2 000 Maker;1~5:TA克隆序列M:DL 2 000 Maker;1-5:The sequence of TA clone图6 分离菌rDNA-ITS序列克隆电泳Fig.6 The rDNA-ITS cloning sequence of isolated fungi

图7 赣州桃胶孢炭疽rDNA-ITS序列Fig.7 The rDNA-ITS sequence of Colletotrichum gloeosporioides in Ganzhou
2.3.4 测序结果 测序结果表明该DNA片段长度为536 bp(不包括引物片段长度),将此序列放在NCBI上进行同源性比对,结果表明该序列与胶孢炭疽菌(Colletotrichumgloeosporioides)的同源性达100%,故该桃果实的致病菌为胶孢炭疽菌。该DNA片段的序列如图7所示。
2.3.5 系统进化关系分析 利用MEGA7.0软件,构建了分离株与其他12个炭疽病病原菌的rDNA-ITS序列的系统进化树。从进化树可以看出,分离株与C.gloeosporioides、C.siamense和G.cingulata的进化关系最近,形成一个小分支,而与其他病原菌的进化关系较远,结果如图8所示。
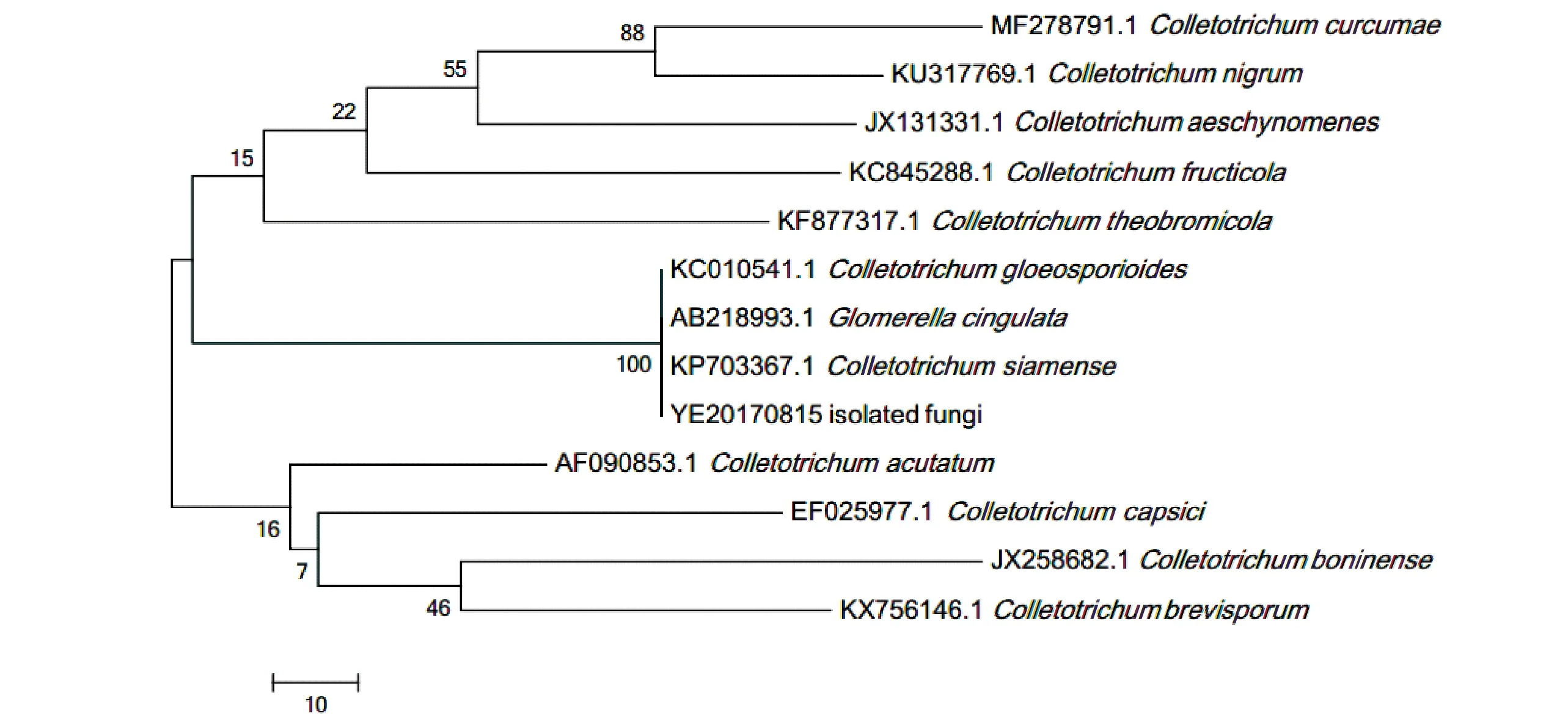
图8 赣州桃果实炭疽病分离株与12种炭疽病菌的系统进化树Fig.8 Neighbor-joining tree based on the rDNA-ITS sequences of isolated fungi and twelve other anthracnose pathogen in the database
3 结论与讨论
本文通过病菌分离纯化和rDNA-ITS序列测定对江西省赣州市桃果实炭疽病病菌进行了鉴定,所获得的分离株具有一致的菌落特征和分生孢子形态大小,与文献记载的胶孢炭疽菌(Colletotrichumgloeosporioides)形态特征相符,选取分离株进行rDNA-ITS序列测定和同源性分析,结果与胶孢炭疽菌具有100%的核苷酸序列同源性,据此,笔者认为赣州桃果实炭疽病病菌应属于胶孢炭疽菌(C.gloeosporioides)。
桃炭疽病是广泛分布于国内各桃产区的重要病害,已有研究表明我国福建古田县、清流县,陕西西安市,广西桂林市灵川县,湖北省,辽宁省,浙江省桐庐县,上海市浦东新区,贵州省贵阳市均有发现炭疽病,且危害较为严重[8-17],其中福建古田县和贵州省贵阳市的桃炭疽病菌为盘长孢刺盘孢菌(ColletotrichumgloeosporioidesPenz)[8,17],湖北省的桃炭疽病菌为尖孢炭疽病菌(Colletotrichumacutatum)[13]。可以看出,江西赣州桃炭疽病菌与国内多数桃产区的炭疽病菌同属不同种,具有一定的研究价值。
rDNA-ITS 序列测定是目前国内外使用较广的植物病原分子鉴定方法[18-21]。本研究所测得的赣州桃炭疽病菌的rDNA-ITS序列既与胶孢炭疽菌的对应序列具有100%的同源性,也与油茶炭疽病菌和暹罗刺盘孢的对应序列具有100%的同源性。结果表明rDNA-ITS序列在炭疽病菌的鉴定中存在一定的局限性,需要与传统的形态学鉴定方法相结合进行,可以提高结果的可信度。

