Cd2+对紫球藻生长及光化学活性的影响
张仁璇 姜 思 佟少明
(辽宁师范大学生命科学学院, 辽宁省植物生物工程重点实验室, 大连 116081)
Cd2+是具有潜在危害及造成水体污染的非必需重金属元素之一, 在水环境中非常稳定, 据统计人类活动和自然界排放到水体中的Cd2+的比例为7∶1, 其在水体中的存在直接影响藻类及其他水生生物, 对整个水生食物链网也具有潜在的威胁[1]。Cd2+对藻细胞的影响主要表现为使细胞结构发生明显变化, 叶绿体类囊体的表面体积减小, 并引起多磷酸体、脂内含物、藻蓝素颗粒等的数目与相对体积以及细胞壁层的体积发生改变, 线粒体内出现大量的密集颗粒等, 进而造成藻细胞一系列生理生化指标的改变, 如生物量的减少、色素及蛋白质含量下降、酶的活性发生改变等[2]。
在重金属的毒理学研究中, 基于细胞的生物监测手段越来越受到重视[3]。单细胞微藻由于具有种类多、繁殖快、易培养及敏感性高等特点, 经常被选择作为指示生物来监测水体质量[4], 其中细胞密度及叶绿素含量等指标来反映重金属对微藻生长的影响, 但这些指标的测定存在着测量时间较长、测量结果不准确(微藻的活细胞和死细胞较难区分)等缺陷[5]。近些年发展起来的通过监测微藻光化学参数的变化来评价水体污染程度是解决上述问题的方法之一, 并且此测定方法灵敏度高、可靠性强、省时省力[6,7]。
紫球藻(Porphyridium purpureum)是一种极具研究价值的真核单细胞红藻, 细胞形态呈圆形或卵形, 培养时受到温度、光照强度、光暗周期以及酸碱度的影响。紫球藻含有丰富的藻红蛋白可与藻蓝蛋白、别藻蓝蛋白和叶绿素a在叶绿体类囊体薄膜上按一定次序排布形成藻胆体, 用于光合作用中光能的吸收、传递和转化[8]。本研究以紫球藻作为研究材料, 探究了不同浓度梯度的Cd2+在不同处理时间内对紫球藻的生长、叶绿素a、藻红蛋白和ATP含量的影响, 以及通过光合参数Fv/Fm、YII、ETR及NPQ的规律变化明确了Cd2+对紫球藻光化学活性的影响, 对于利用紫球藻分析Cd2+及其他重金属污染的特性具有一定的参考价值。
1 材料与方法
1.1 材料培养
紫球藻的液体藻种为辽宁师范大学植物生物工程重点实验室的弱光低温保存种, 扩大培养采用f/2液体培养基, 在光照强度为35 μmol photons/(m2·s),温度25℃, 光周期为16h∶8h(L∶D)的光照培养箱中进行。
1.2 Cd2+胁迫对紫球藻生长的影响
配制Cd2+终浓度分别为0、50、100、200、500、1000 μmol/L的f/2液体培养基, 将预培养至指数生长期的紫球藻, 以接种量(5×104个/mL)分别接入含上述Cd2+浓度的50 mL f/2培养基中, 放置光照培养箱中静置培养, 每天间断摇动3—4次。在培养的6d内每天取藻液2 mL, 稀释后, 采用血球计数板来测定藻细胞密度。
1.3 Cd2+胁迫对紫球藻叶绿素荧光特性的影响
Cd2+处理紫球藻及接种如上所述, 接种后的6d内, 每天采用Multi-color-PAM(WalZ, Gemany)各种处理的紫球藻的叶绿素荧光参数, 包括Fv/Fm、YII、ETR和NPQ, 测定方法完全按照仪器提供的操作规程进行。
1.4 Cd2+胁迫对紫球藻藻红蛋白含量的影响
紫球藻藻红蛋白的含量测定参考Kursar等的方法[9], 具体操作为:取不同浓度Cd2+处理6d后的紫球藻50 mL, 25℃, 5000 r/min离心10min, 弃上清, 得到藻体后加入10 mL ddH2O, 洗涤藻体, 25℃, 5000 r/min离心10min, 弃上清; 加入10 mL磷酸缓冲液(10 mmol/L、pH 7.0)洗涤藻体, 上述条件离心, 弃上清; 将藻体重悬于10 mL磷酸缓冲液中; –80℃冷冻1h, 40℃解冻, 反复冻融3次, 对藻体重悬液进行超声破碎,超声5s, 停止5s, 持续5min; 镜检藻体, 超过90%藻体破碎后, 4℃, 5000 r/min离心10min, 收集上清液于新管中。以磷酸缓冲液作为空白对照, 用紫外分光光度计测定OD545值。藻红蛋白含量采用藻红蛋白(mg/mL)=A545×154公式计算。
1.5 Cd2+胁迫对紫球藻ATP含量的影响
ATP含量测定参照碧云天ATP检测试剂盒提供的方法略加改动, 具体操作为先取2 mL圆底离心管, 标记并称重。每管中加入不同浓度Cd2+处理5d后的紫球藻1.5 mL, 25℃, 5000 r/min离心10min,弃上清, 再次称重。每管中加入100 μL裂解液, 破碎匀浆后, 4℃, 12000 r/min离心10min, 取上清用于后续实验。
ATP浓度测定:向检测孔内加入100 μLATP检测工作液(碧云天, 江苏), 室温孵育3—5min。向检测孔内加入10 μL样品或者ATP标准品, 迅速混匀,间隔2s后, 用Mikrowin 2000测定荧光值。通过ATP标准品建立ATP浓度(μmol/L)和荧光值之间的标准曲线, 进而计算出待测样品中ATP的实际浓度。
2 结果
2.1 Cd2+胁迫对紫球藻的生长的影响
在不同浓度的镉离子处理6d内, 每天监测紫球藻生物量(图1), 紫球藻的细胞密度随Cd2+浓度增加而降低, 浓度越高, 生长越缓慢; 到第6天时, 各处理浓度的生长量分别为同期未处理组的94.2%(P>0.05,50 μmol/L)、90%(P<0.05, 100 μmol/L)、68%(P<0.01, 200 μmol/L)、17.9%(P<0.01, 500 μmol/L)及14.9%(P<0.01, 1000 μmol/L)。
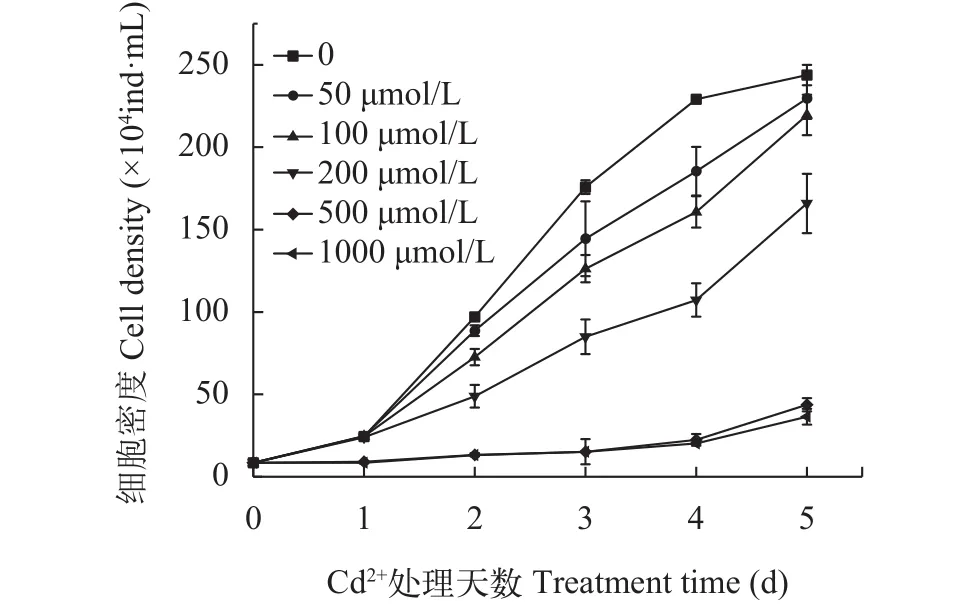
图1 Cd2+对紫球藻生长的影响Fig. 1 The effect of Cd2+ on the growth of P. purpureum
2.2 Cd2+胁迫对紫球藻光化学活性的影响
采用用Multi-color-PAM监测了Cd2+处理后紫球藻的PSII的最大光量子产额(Fv/Fm)、实际光化学效率(YII)、相对电子传递效率(ETR)和非光化学淬灭光化学活性(NPQ)在6d内的动态变化情况。
如图2A所示,Fv/Fm在低于200 μmol/L的Cd2+处理后, 呈现先下降后上升的趋势, 处理后的第6天, 50 μmol/L Cd2+处理的Fv/Fm值仍然高于未处理组, 而100 μmol/L及200 μmol/L的Cd2+处理的Fv/Fm值急剧下降, 表明Cd2+浓度为100 μmol/L时就可以对PSII系统造成伤害; 500及1000 μmol/L浓度的Cd2+处理,Fv/Fm值一直呈现下降的趋势, 到第6天时, 分别为0.0375和0.038, 与未处理组的0.3435相比, 下降了近89%, 表明藻细胞的PSII反应中心已经完全遭到了破坏, 失去原有功能, 藻细胞无法进行光合作用, 大部分细胞已经死亡。
如图2B所示,YII的值在低于200 μmol/L的Cd2+处理后, 呈现先下降后上升的趋势, 到第6天时,50和100 μmol/L Cd2+处理的YII值与未处理组相比,没有显著差异; 500和1000 μmol/L浓度的Cd2+处理使YII值一直处于持续下降中, 处理后的第6天的YII值分别为0.052和0.021, 与未处理组0.2295相比,分别下降了77%及91%, 表明在此时的Cd2+浓度已经使紫球藻的光合效率已经降到最低, 无法通过光合作用提供藻细胞生长所需的能量。
如图2C所示, ETR值在低于200 μmol/L的Cd2+处理后, 先下降后逐渐上升, 至第6天时, 50、100及200 μmol/L Cd2+处理与未处理组无显著差异;500和1000 μmol/L的Cd2+处理至第6天的ETR值分别为0.4和0.3, 与未处理组3.5相比, 分别下降了89%和91%, 表明光合电子传递几乎接近于停止。
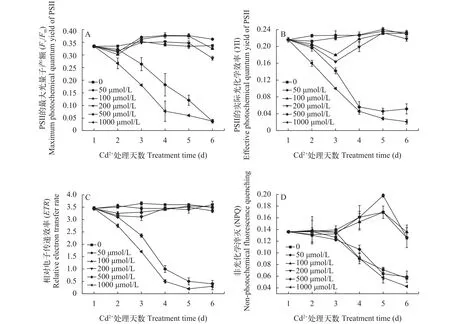
图2 Cd2+胁迫处理对紫球藻光活学活性的影响Fig. 2 The effect of Cd2+ stress on the photochmecial activity of P. Purpureum
如图2D所示, NPQ的值在低于200 μmol/L的Cd2+处理后的第3天起, 就显著高于未处理组, 到第6天3种浓度的处理分别比未处理组高2.23倍、2.39倍及2.22倍, 表明此时细胞在受到Cd2+胁迫后,能够通过NPQ方式耗散所吸收的过剩光能; 500和1000 μmol/L的处理的NPQ值一直处于下降之中, 表明此时细胞由于PSII的失活造成紫球藻的正常生理功能被严重破坏, 已经无法通过NPQ的方式来耗散所吸收的光能。
2.3 Cd2+胁迫对紫球藻叶绿素a及藻红蛋白含量的影响
在不同浓度的Cd2+处理6d后, 随着处理浓度的增加, 紫球藻的叶绿素a及藻红蛋白的含量显著下降(图3), 且浓度越高, 下降的辐度越大。在各浓度Cd2+处理6d后, 叶绿素含量分别是未处理组的68%(P<0.01, 50 μmol/L)、59.7% (P<0.01, 100 μmol/L)、43.1% (P<0.01, 200 μmol/L)、8.9% (P<0.01, 500 μmol/L)及7.3% (P<0.01, 1000 μmol/L); 藻红蛋白的含量分别是未处理组的83.6% (P<0.05, 50 μmol/L)、76.4%(P<0.01, 100 μmol/L)、62.8% (P<0.01, 200 μmol/L)、6.1% (P<0.01, 500 μmol/L)及5.8% (P<0.01, 1000 μmol/L), 相比之下, 叶绿素a下降的速度要比藻红蛋白快速。以上结果也可以看出, 在超过500 μmol/L的Cd2+作用下, 绝大部分叶绿素a和藻红蛋白已经降解, 也是光化学活性下降的主要原因之一。
2.4 Cd2+胁迫对紫球藻ATP含量的影响
在不同浓度的Cd2+处理6d后, 随着处理浓度的增加, ATP的含量显著下降(图4), 且浓度越高, 下降的辐度越大, ATP含量分别是未处理组的67.1%(P<0.01, 50 μmol/L)、61.9% (P<0.01, 100 μmol/L)、44.5% (P<0.01, 200 μmol/L)、30.3% (P<0.01, 500 μmol/L)及19.8% (P<0.01, 1000 μmol/L)。
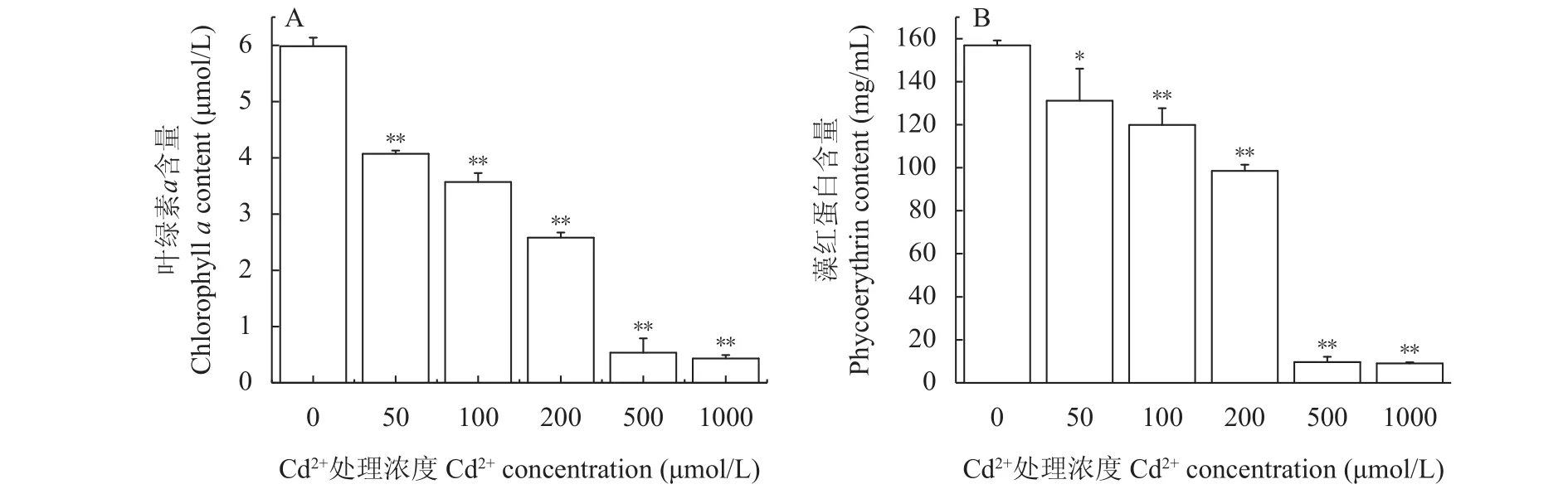
图3 Cd2+胁迫处理对紫球藻叶绿素a及藻红蛋白含量的影响Fig. 3 The effect of Cd2+ on the content of chlorophyll a and phycoerythrin of P. purpureum
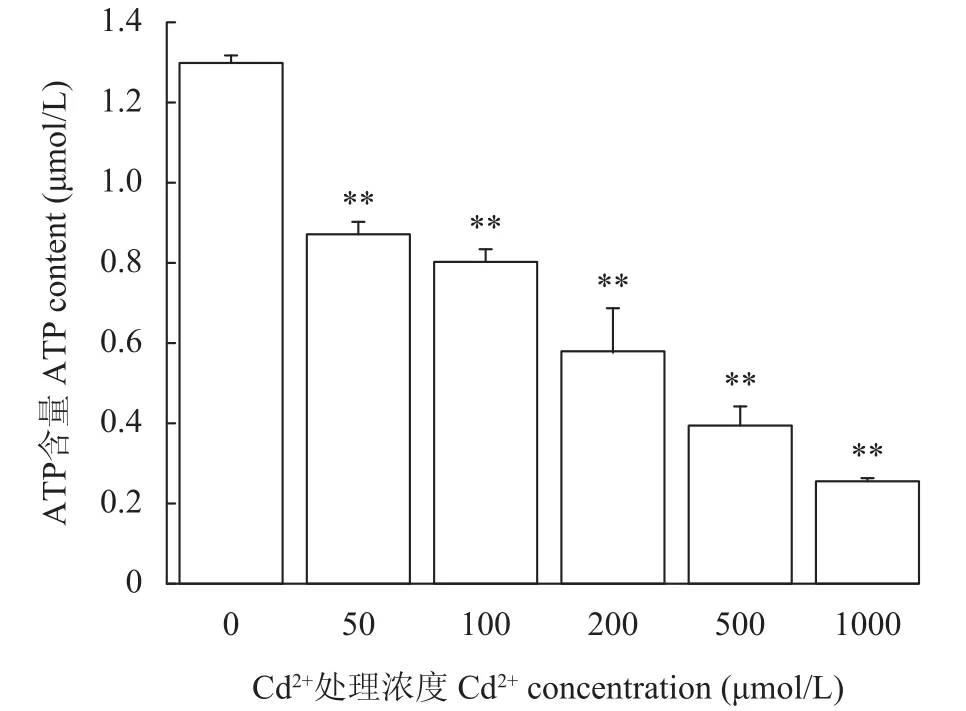
图4 Cd2+胁迫处理对紫球藻ATP含量的影响Fig. 4 The effect of Cd2+ stress on the content of ATP of P.purpureum
3 讨论
水生生态系统的平衡是生态学研究的一个重要领域, 水体中的重金属污染是主要的环境问题之一, 微藻作为水生生态系统的主要初级生产力, 重金属的污染对其生长及发育会产生极大的影响。重金属对藻类的毒性强弱与重金属的种类、浓度、环境因素等有关, 同时也因藻类的不同而各异[8]。叶绿素含量是常用来评价藻类受到伤害时的生理指标之一, 重金属胁迫对叶绿素含量的影响会因重金属的种类及藻类不同而异, 一般而言, 低浓度的必需重金属的胁迫会促进叶绿素的积累, 而高浓度必需重金属或非必需重金属胁迫会降低叶绿素的含量。如Ni2+和As3+胁迫会显著降低铜绿微囊藻中叶绿素a含量[10]; 轮藻在不同重金属离子作用下叶绿素含量明显降低, 其影响的强弱顺序依次为Cr6+、Cd2+、Hg2+和Pb2+[11]; 对于必需重金属Zn2+而言, 低浓度(<3 mg/L)会促进鞘藻叶绿素的合成, 高浓度(>20 mg/L)会降低鞘藻叶绿素的含量[12], 而低于1 mg/L的Zn2+浓度, 会提高栅藻叶绿素a含量, 而Zn2+浓度高于5 mg/L时, 栅藻叶绿素a含量会降低[13]。在本研究中, 紫球藻的叶绿素a的含量在高于50 μmol/L的Cd2+胁迫处理时, 叶绿素a的含量就显著下降, 且随着处理浓度的提高, 下降的幅度增大。
藻胆蛋白作为光合作用的捕光色素复合体, 主要存在于红藻、蓝藻、隐藻和少数甲藻中, 用于光能的吸收和传递[14]。紫球藻作为真核单细胞红藻,其光合色素主要有叶绿素a和藻红蛋白。在本研究中, 紫球藻在受Cd2+胁迫后, 培养液颜色随Cd2+浓度升高而逐渐红色变浅, 直至变白, 结合藻红蛋白含量测定结果表明, Cd2+通过破坏藻红蛋白结构, 从而降低原初反应中光能的吸收和传递, 抑制紫球藻的光合作用, 因此藻红蛋白是紫球藻受到Cd2+胁迫的一个重要作用位点。
ATP是生物体内最重要的高能化合物之一, 为生命活动的提供直接能源, 因此生物细胞体内的ATP含量水平反映了细胞的活性。对于真核藻类而言, ATP能量供应主要来源于呼吸作用的氧化磷酸化和光合作用的光合磷酸化过程。重金属Cd2+、Hg2+及Co的胁迫会损伤细胞的超微结构, 致使细胞核变形, 线粒体膨大和解体及叶绿体类囊体片层结构破坏[15,16]。在本研究中, 紫球藻细胞内的ATP含量随Cd2+浓度增加而显著下降, 这可能也是由于Cd2+作用于线粒体及叶绿体的类囊体片层等结构,使其功能受损或结构被严重破坏, 使得ATP合成受阻, ATP含量下降, 从而影响藻细胞的活性。
叶绿素荧光技术已广泛应用于环境监测中, 通过测定能进行光合作用藻类的Fv/Fm、YII、rETR、International Journal ofNPQ等光合参数变化, 来反映外界环境因子的变化。如在Cu2+、Zn2+、Cd2+胁迫下纤细角毛藻、三角褐指藻及杜氏盐藻的Fv/Fm、YII、rETR和qP等参数值的变化与重金属离子浓度和胁迫时间呈显著负相关[5]。Fv/Fm为PSII的最大光量子产额, 反映了PSII反应中心完全开放时所能吸收的最大量子产额,Fv/Fm值的大小随着生存的外界环境的变化而变化, 但当藻类受到胁迫后, 该值一般会随着胁迫程度的增加而下降, 在某种程度上Fv/Fm值的大小能够反映紫球藻PSII的功能是否受损。紫球藻在受到Cd2+胁迫时, 高于500 μmol/L的Cd2+胁迫时会使Fv/Fm值急剧下降, PSII反应中心受损、原初反应受抑制, 因此紫球藻是无法在高于500 μmol/L镉离子的环境中生存;ETR为PSII相对电子传递效率,与放氧光合速率和CO2的固定速率具有良好的线性关系, 高于500 μmol/L的Cd2+的胁迫会严重抑制电子传递链的电子传递, 从而影响紫球藻的光合效率;NPQ为非光化学淬灭, 表示PSII捕光色素捕获的光能以热能形式耗散的份额的大小, 可保护光合结构不受强光所破坏, 是植物体的进行自我保护的一种机制, 当紫球藻受到低于200 μmol/L的Cd2+胁迫时,细胞还可以通过NPQ方式来耗散部分能量, 避免光合结构受到损伤坏, 而在高于500 μmol/L的Cd2+胁迫下, NPQ值持续下降到最低点, 已经不能通过NPQ方式来耗散吸收的光能, 完全丧失了自我保护的机制。因此, 重金属Cd2+对紫球藻光化学活性的影响主要表现在PSII反应中心受损, 电子传递过程受阻, 光合效率降低, 在低浓度的Cd2+胁迫下, 细胞可以通过NPQ途径来调节细胞所吸收的过剩光能,但在高浓度的Cd2+胁迫下, 随着PSII光系统等各种膜结构的解体及细胞复合物的降解, 相应的保护机制也会失去。
综合本研究结果, 各浓度梯度的Cd2+胁迫, 会使紫球藻的生长速度显著下降, 叶绿素显著减少, ATP含量显著减少, 且浓度越高减少的幅度越大; 紫球藻的光化学参数Fv/Fm、YII、ETR对金属Cd2+胁迫反应与重金属的浓度呈显著的负相关, 可以利用这些光化学参数的变化来反映紫球藻受重金属的胁迫的程度, 并可作为筛选抗重金属的微藻品种的参考指标。

