洱海微囊藻水华的水生态风险评估研究
刘 毅 杨 劭 刘晓峰
(华中师范大学生命科学学院, 武汉 430079)
浮游植物是生物圈的重要初级生产者, 也是水生态系统的基础组成部分, 在地球的碳、氧、氮、磷等生源要素循环中扮演重要功能。浮游植物在特定的条件下可形成水华或赤潮现象。水华通常被认为是浮游植物生长繁殖过快而产生的现象。水华暴发时, 大量藻类在水体上层聚集形成肉眼可见漂浮层或藻细胞团。形成淡水水华的物种多属蓝藻、绿藻,硅藻、甲藻、隐藻等水华也常有报道[1,2]。水华的形成是一种自然现象, 淡水水华多发生在富营养化程度较高的湖泊中, 但在水质良好的水体中也偶有小规模水华发生, 如意大利Tovel湖[3]。严重的水华现象可导致水体缺氧、透明度降低, 有的水华藻类可产生异味物质和毒素, 并对水生态系统以及人畜饮水安全产生危害。
近几十年来我国水华发生的范围和程度呈现增长的趋势, 特别是2007年太湖蓝藻水华导致的停水事件。该事件不仅引起公众广泛的关注, 使得政府部门对水华的治理日益重视, 另一方面也让社会公众和水环境管理者产生“恐藻”心理, 甚至于谈“藻”色变。所以, 在水环境管理过程中, 必须准确了解不同类型、不同程度的水华所产生的危害程度, 才能采取适当的对策, 从而避免公众的漠视或恐慌。因此, 水华的生态风险和人类健康风险评估研究, 在水环境管理中具有十分重要的意义。
虽然形成水华的藻类种类很多, 但蓝藻水华,尤其是微囊藻属水华, 是比较常见的一类, 而且部分微囊藻种/株能产生微囊藻毒素, 严重威胁人类饮用水安全和水生态健康, 因而最受关注和重视[4]。微囊藻水华对人类健康的风险已有大量研究, 在此基础上各国政府已制定相关标准。如世界卫生组织在娱乐水质准则里规定微囊藻毒素10 μg/L以下为低风险[5]; 加拿大卫生组织在娱乐水质准则里规定微囊藻毒素限值为20 μg/L[6]; 我国生活饮用水卫生标准《GB5749-2006》规定微囊藻毒素含量不能超过1 μg/L。不仅如此, 部分国家还制定了娱乐用水、灌溉水、牲畜饮用水等地表水的蓝藻水华藻密度标准: WHO规定娱乐用水蓝藻密度<2×107cells/L为低风险、(2—10)×107cells/L为中等风险、(10—100)×107cells/L为高风险水平[5]; 加拿大政府对娱乐用水限值为蓝藻密度不大于1×108cells/L[6]。然而在水华的水生态风险评估方面, 相关研究报道很少, 也没有任何国内外机构制定水华的水生态风险评价标准, 因此对各种水华的生态危害程度难以准确判断, 从而无法对相关水体进行科学管理。
洱海是云贵高原第二大淡水湖泊, 是大理人民主要的生活、生产水源地, 被大理白族人民视为母亲湖。洱海从1996年开始, 1998、2003和2013等年度多次发生大规模蓝藻水华, 小规模蓝藻水华则更为常见[7]。目前洱海水生态系统被认为是处于草型清水稳态和藻型浊水稳态之间的过渡态, 系统仍有可能转化为藻型浊水稳态, 其水生态系统修复成为当务之急的治理任务[8]。据报道, 2013年秋季洱海大规模蓝藻水华发生期间胞外藻毒素平均含量低于0.005 μg /L, 胞内浓度均值也在0.016—0.069 μg/L[9],水中微囊藻毒素接近但仍低于我国饮用水卫生标准。但洱海频繁发生的蓝藻水华, 在持续时间、面积、藻密度方面各有不同, 其对水生态系统退化的作用究竟有多大?如何准确判断各种程度的蓝藻水华危害?急需有针对性地开展水华的水生态风险评价研究。
为了研究洱海微囊藻水华的水生态风险, 本研究借鉴生态毒理学风险评价思路, 从洱海水生态系统保护的角度出发, 测试微囊藻水华对洱海水生生物的综合影响, 受试物种(包括文献搜集)包含了底栖动物、浮游动物、鱼类和沉水植物, 以此为影响参数, 再按照美国环保部推荐的水生生物基准推导方法制定洱海的微囊藻水华生态效应阈值, 并根据效应阈值进行风险评价。本研究获得的洱海微囊藻水生态风险评价标准将有助于洱海水环境管理和治理, 对其他水体的微囊藻水华风险评估也有参考价值。
1 材料与方法
1.1 实验材料与仪器设备
微囊藻采自大理喜洲镇湖边池塘以及洱海湖湾中。微囊藻藻浆经筛网过滤除杂质并用蒸馏水冲洗, 再用25号浮游植物网(64 μm孔径)浓缩备用。经镜检, 浓缩藻液藻密度约为(2.19—3.55)×109cells/L, 主要是铜绿微囊藻(Microcystis aeruginosa)和惠氏微囊藻(Microcystis wesenbergii), 微囊藻细胞相对丰度大于95%。实验用的鲫(Carassius auratusLinnaeus)、麦穗鱼(Pseudorashora parva(Temminck et Schlegel))、钩虾(Gammarussp.)从洱海捕获, 春鲤(Cyprinus longipectoralis(ChenetHuang))购于洱源茈碧湖渔场, 挑选活泼无伤痕, 体长一致的鱼、虾在盛山泉水的实验水池中驯养一周。金鱼藻(Ceratophyllum demersumLinn)、狐尾藻(Myriophyllum spicatumLinn)、光叶眼子菜(Potamogeton lucensLinn)、微齿眼子菜(Potamogeton maackianusA. Benn)采集自喜洲镇附近湖湾, 摘剪长势良好、长度一致, 基本无分枝的茎段在实验水池中驯养一周。各实验材料初始基本信息见表1。
藻细胞计数方法参照《水和废水监测第四版》, 吸取0.1 mL充分震荡摇匀的样品注入0.1 mL计数框, 在10×40倍下显微镜(舜宇光学 EX30)计数。溶解氧使用哈希HQ30d溶氧仪进行测定, 水体Chl.a、TN、TP等水质参数参照《水和废水监测第四版》方法测定。
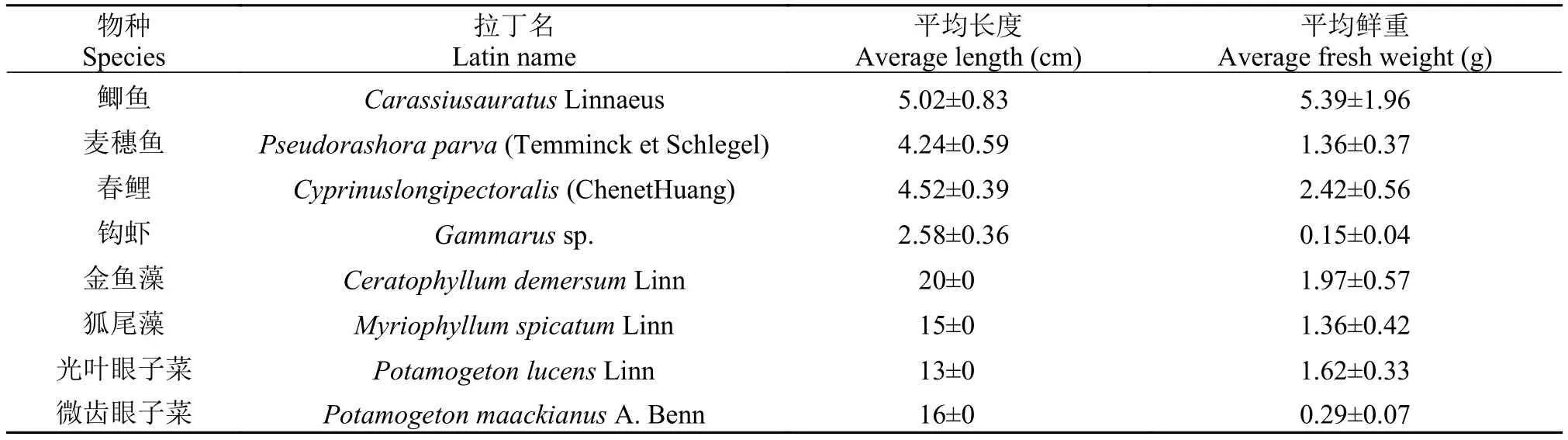
表1 受试生物基本信息Tab. 1 Basic information about the main objectives of the study
1.2 微囊藻水华对鱼类的急性效应实验
用水将浓缩微囊藻藻液稀释成4个浓度梯度,藻细胞密度梯度在107—109cells/L, 根据预实验及鱼种的耐受性, 不同鱼种的梯度实验水体藻密度略有差异。由于洱海土著鱼量少无法捕捞, 则选择洱海中优势度较大的自然繁殖鱼类麦穗鱼、鲤和鲫。实验容器为18 L的塑料桶, 每桶投鱼7尾, 每个藻浓度设置3个重复, 同时以水作为对照组, 所有实验水体均提前曝气处理, 保持各组初始溶解氧一致。实验开始后每12h观察鱼类状态, 记录死亡数量并监测溶解氧变化。相关细则参考《工业废水的试验方法 鱼类急性毒性试验 GB/T 21814-2008》进行。
1.3 微囊藻水华对钩虾急性效应实验
将浓缩藻液稀释成4个浓度梯度, 藻密度分别为6.56×107、3.28×108、5.47×108和1.64×109cells/L,以洱海入湖溪水为对照组, 保持各组初始溶解氧一致。实验开始后每12h观察钩虾状态, 记录死亡数量并监测溶解氧变化。
1.4 微囊藻水华对沉水植物的慢性效应实验
在洱海湖内构建封闭围隔(直径1.5 m, 深4 m),在围隔内设置微囊藻水华浓度梯度, 将沉水植物种植于塑料桶中悬吊于围隔内进行水华的暴露实验。挖取洱海岸边土壤晒干后过筛混匀作为沉水植物培植土。受试沉水植物为洱海的优势种, 包括金鱼藻、狐尾藻、光叶眼子菜和微齿眼子菜, 栽种前测定每株植物的鲜重和长度, 吊盆置于水深1.0—1.2 m。围隔微囊藻水华浓度设置成5个梯度,以洱海清洁湖水为对照, 实测各组为3.29×106、1.12×107、2.60×107、7.59×107、1.91×108和5.09×108cells/L, 每个梯度4个平行。每天取样测定各围格实际藻浓度, 如测定值与设定值相差较大则补加浓缩微囊藻藻液。实验第14和第24天取样测定沉水植物鲜重和长度, 同时取表层水测定藻细胞数。根据与对照组鲜重减少量计算24d微囊藻水华的最低效应浓度(LOEC)。
1.5 微囊藻水华的急性和慢性水生态风险推导
本研究借鉴生态毒理学中有毒物水生态风险评估的毒性百分数排序法[10,11], 做出相应调整, 形成适用于水华风险评价的推导方法(图1)。毒性百分数排序法是USEPA1985年推导水生生物毒性基准的标准方法[10,11]。该方法同时考虑了污染物的急性和慢性毒性效应, 其得到基准最大浓度(CMC)。CMC表示短期暴露不会对水生生物产生显著影响的最大浓度。计算CMC时, 是将所获得属的平均急性毒性数据按从高到低的顺序进行排列,再按公式P=R/(N+1)计算累计概率, 其中R是毒性数据在序列中的位置,N是所获得的毒性数据量。选择其中4个累积概率接近0.05的属, 用所选择的属平均急性毒性值和它们的累积概率根据相关公式[12]可计算出最终急性值(FAV), 基准最大浓度CMC=FAV/2。CMC值被用来急性风险评价。洱海微囊藻对沉水植物生长的长期影响非常显著, 从保护沉水植物的角度出发, 本研究选择沉水植物无效应浓度(NOEC)作为慢性风险评价终点。
最终急性效应值(FAV, Final Acute Value)FAV需要至少来自3门8科物种的急性毒性数据(如水生动物的LC50), 如果可以获得足够的数据且这些数据符合相关要求, 则计算出各自累计概率,再按Charles E. Stephen等[12]的方法计算。
风险评价推导1998年USEPA正式出台《生态风险评价指南》, 文中指出用风险商值一般评价步骤[12]:
①确定效应评价终点值(EP)
效应评价终点值, 对于急性风险评价选择急性效应浓度(CMC), 再除以不确定系数(UF)和修正系数(MF)。不确定系数一般为10—10000, USEPA推荐当以水生生物急性毒性数据推导时, UF可取10,修正系数, 此处MF=1。对于慢性风险评价选择最低NOEC浓度。它们分别反映急性风险程度和慢性风险程度, 即分别是急性风险评价EP=CMC/(UF×MF)和慢性风险评价EP=NOEC。
②计算环境暴露浓度(EC): 本研究中EC即为洱海水体浮游植物实际监测值。
③计算风险商值指数RQ: 本研究的RQ=EC/EP, 风险评价中RQ值在0.1以下、0.1—1.0之间和1.0以上分别定义为低风险、中风险和高风险。
1.6 数据处理方法
鱼类和钩虾实验以实验终点时刻的死亡率为y轴, 藻密度对数为x轴, 在SPSS提供的曲线估计过程(Curve Estimation)进行曲线拟合, 选出最佳的回归模型来拟合, 再根据拟合公式反推中点效应值,即该物种的LC50。沉水植物实验则以24d的鲜重增长抑制率为y轴, 藻密度对数为x轴, 计算半效应浓度(EC50), NOEC 值为经Dunnett’sT检验与对照组相比其生长速率无显著性差异 (P>0.05) 的最高浓度[13]。
2 结果
2.1 微囊藻水华暴露下的水生生物LC50 和NOEC值
本研究通过微囊藻水华暴露实验获得的受试物种的LC50和NOEC 值, 以及文献中报道的其他水生生物的微囊藻水华半效应浓度值见表2。研究表明多数物种的效应-剂量响应关系较符合二次模型(Quadratic)拟合, 相关系数R2均大于0.85。结合本研究和文献数据发现, 浮游动物的LC50普遍高于鱼类, 可能是因为浮游动物在微囊藻存在的条件下产生了抵御机制, 如降低滤水率[14]。也可能是增强了对毒素的遗传的抵抗性[15]。
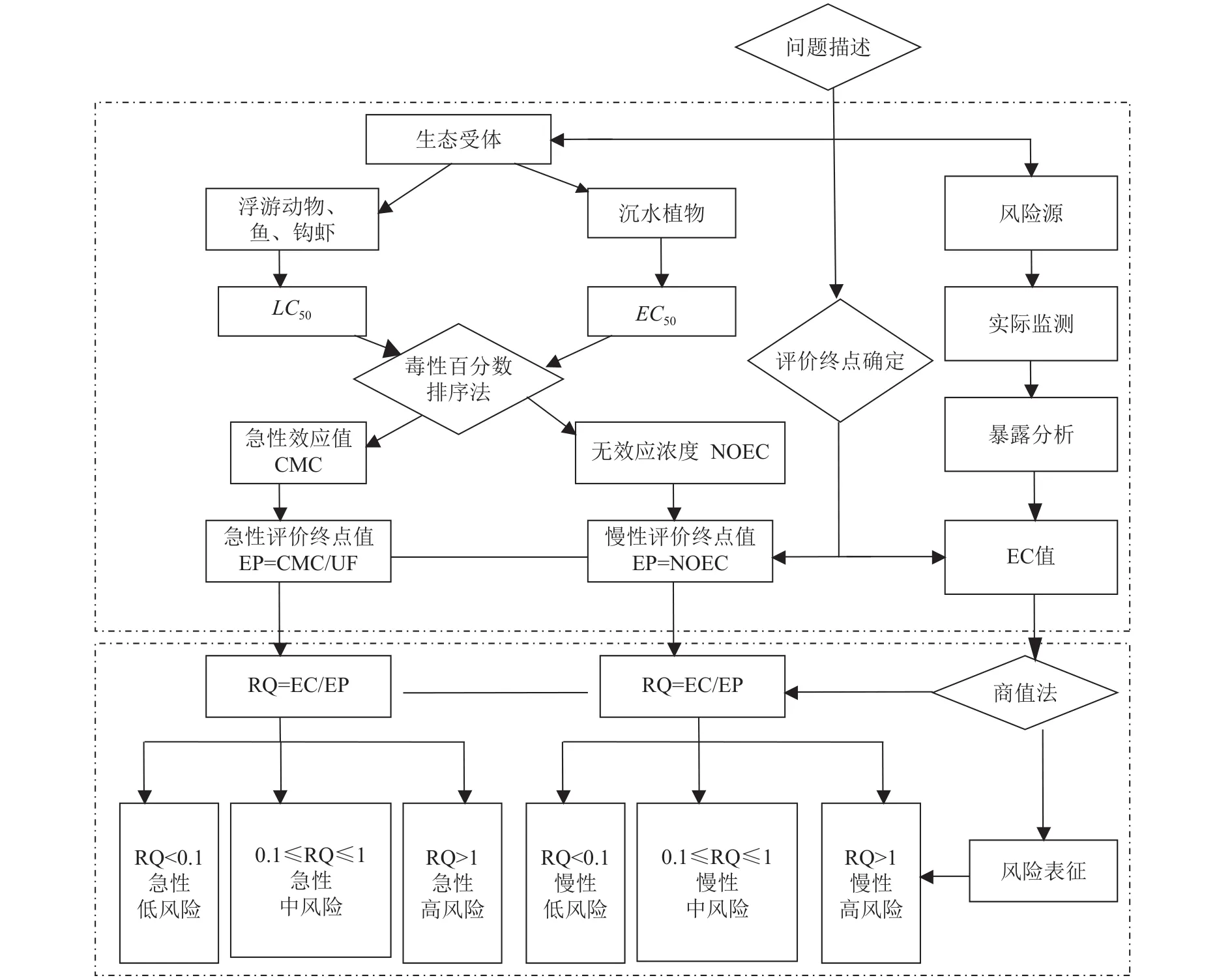
图1 微囊藻水生态风险评估技术路线Fig. 1 Illustration of an effective strategy for aquatic ecological risk assessment of Microcystis bloom
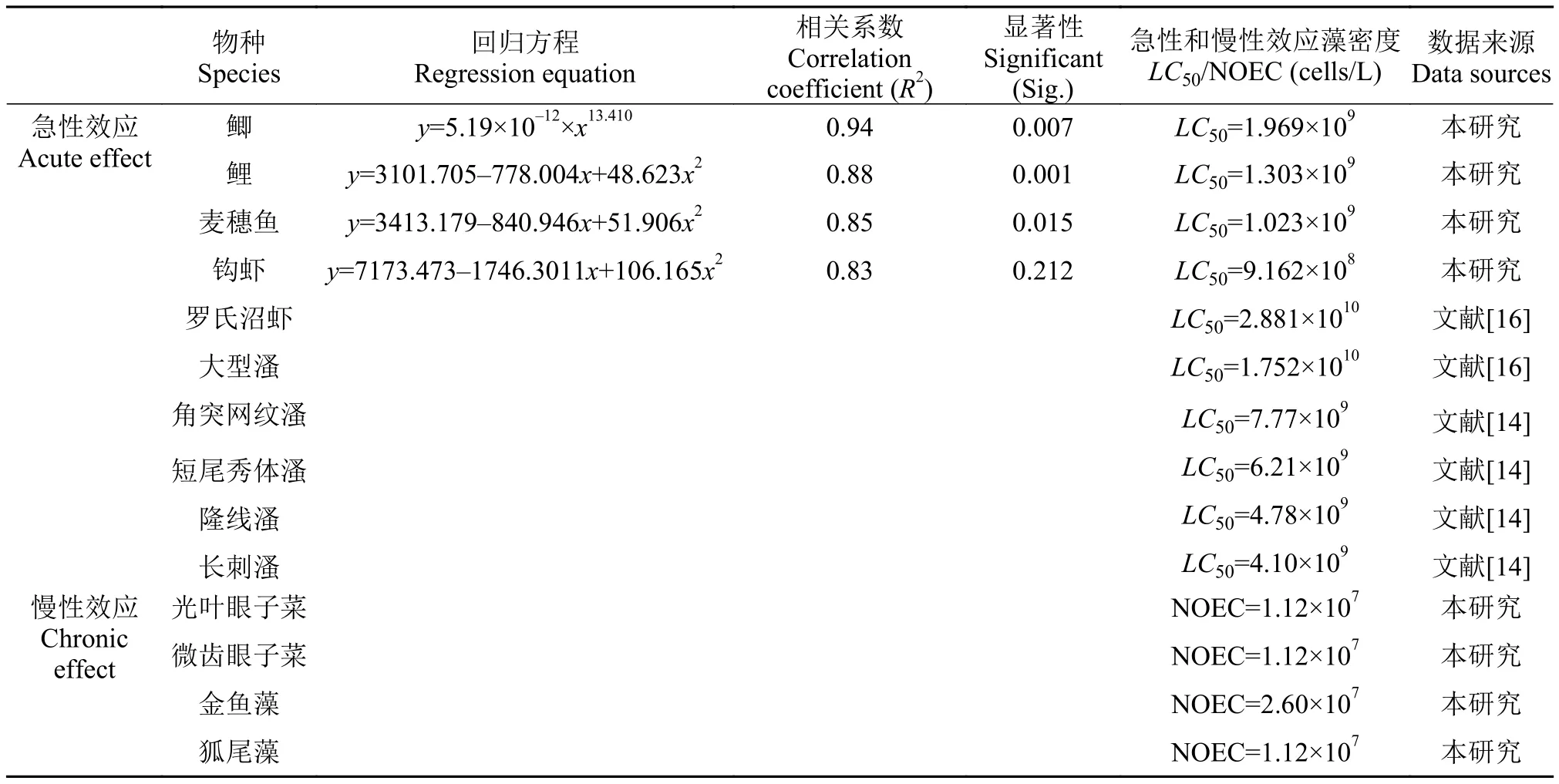
表2 受试物种急性和慢性效应统计Tab. 2 Calculating the algal cell densities using TPR method
钩虾24hLC50为9.162×108cells/L, 为本研究中对微囊藻最为敏感的物种, 鲤鱼、鲫鱼对微囊藻的耐受性也略高于麦穗鱼。
2.2 微囊藻水华的急性效应值、慢性效应值和无效应浓度的推导
将表2中急性试验属平均急性效应值从高到低排列, 通过公式计算出最终急性效应值(FAV)=6.744×108cells/L, 基准最大浓度(CMC)=3.372×108cells/L。沉水植物深度设置是根据洱海实地调查, 取沉水植物在洱海分布的最常见水深, 代表洱海实际情况。对沉水植物各浓度鲜重增长量进行Dunnett’sT检验, 光叶眼子菜、微齿眼子菜、金鱼藻和狐尾藻的无效应浓度(NOEC)浓度分别为1.12×107、1.12×107、2.60×107和1.12×107cells/L。取最小值, 则沉水植物的NOEC浓度为1.12×107cells/L。因此, 从急性效应考虑, 洱海水华CMC=3.372×108cells/L, 从长期慢性效应看, 洱海水华对沉水植物的NOEC=1.12×107cells/L。
2.3 根据效应阈值的风险评价
急性风险评价: 计算得EP≈3.4×107cells/L, 根据急性风险商值(RQ)分级标准, 当环境暴露浓度即洱海水体藻密度在3.4×106cells/L以下、3.4×106—3.4×107cells/L、3.4×107cells/L以上时分别处于急性低风险、中风险和高风险水平。当RQ=1时, 洱海水体藻密度为3.4×107cells/L, 根据洱海实验模拟得到的藻密度-透明度回归模型(y=0.3506x2–6.7023x+32.128,R2=0.9968,x,y分别代表藻密度对数和透明度), 计算出此时洱海水体透明度(SD)≈1.5 m, 根据实验中测定的藻密度-叶绿素a模型(y=0.0002e1.6607x,R2=0.9861,x,y分别代表藻密度对数和叶绿素a含量), 计算出此时Chl.a≈50.7 μg/L。
慢性风险评价, 计算得EP≈1.1×107cells/L, 根据慢性风险商值(RQ)分级标准, 当环境暴露浓度即洱海水体藻密度在1.1×106cells/L以下、1.1×106—1.1×107cells/L和1.1×107cells/L以上时分别处于慢性低风险、中风险和高风险水平。同样当RQ=1时,洱海水体藻密度为1.1×107cells/L, 计算出此时SD≈2.4 m, Chl.a≈18.7 μg/L。综上所述, 藻浓度风险分级见表3、表4。
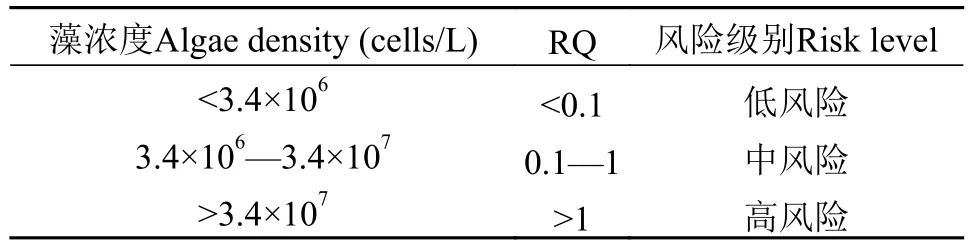
表3 洱海水华急性风险分级Tab. 3 The ecological risk of an acute toxicity based on cell density for Erhai Lake
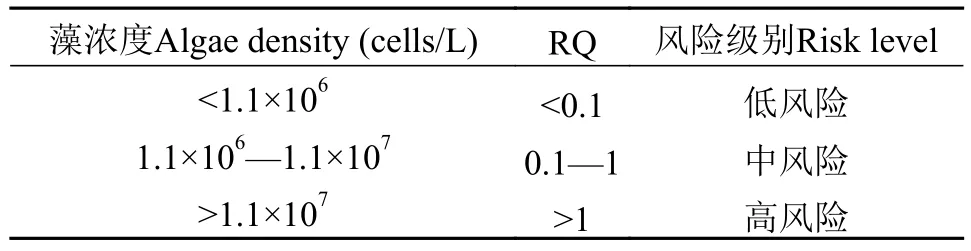
表4 洱海水华慢性风险分级Tab. 4 The ecological risk of a chronic toxicity based on cell density for Erhai Lake
微囊藻的形成和消亡通常需要一定的时间积累, 作为有害生物, 慢性影响较为突出, 且有报道洱海水华爆发持续时间一般较长, 如1996年持续半月余, 1998年持续达50d, 2013年超过一个月[9,18]。因此针对洱海, 采用慢性效应进行评价更为适宜, 本研究建议以慢性风险分级进行风险管理。
3 讨论
3.1 评价方法的可行性分析
微囊藻水华的水生态风险是通过对水生生物产生直接(如毒性)和间接(如降低透明度、溶氧)影响, 从而影响水生态系统群落结构, 降低生物多样性, 尤其是降低沉水植被盖度, 导致水生态系统发生稳态转换, 引起水生态系统退化。
水华对水生态系统的风险大小与水华藻种类、藻密度、水华盖度、水华延续时间长度、具体的水体状况有关[19]。本研究仅针对洱海微囊藻水华, 通过藻密度梯度和急慢性暴露实验, 可以获得与藻密度、水华延续时间相关的数据。而水华覆盖面积比例, 则需要结合洱海的水环境条件进行探讨分析。
目前国内外针对有害生物生态风险评价还没有统一标准的方法, Macleod等[20]建立以生物因子为起点的多指标综合评估法来评估外来有害生物,如美洲豚草(Ambrosia artemisiifoliaL)、松突圆蚧(Hemiberlesia pitysophilaTakagi)等, 评价指标有有害生物的寄主范围、扩散能力、受威胁农作物在当地的重要性、处理的难易程度等。但多指标综合评估法中许多参数依赖专家经验判断分级, 评价过程人为主观因素较多, 可能影响获得真实客观的结论; 魏淑秋[21]通过农业气候相似距分析法预测有害生物的适生区来评估其风险程度, 如美国白蛾(Hyphantria cunea)、假高粱(Sorghum halepense)等,该方法根据气候相似性原理, 以有害生物高发地为参照, 筛选出关键环境因子, 并与待评估区进行相似距计算预测有害生物潜在分布区域, 从而评价其扩散风险。农业气候相似距分析法是用于评价预测有害生物的扩散定居风险, 而本文的目标是评价微囊藻水华对生态系统的危害风险, 因此该方法并不适合本研究。
为评价微囊藻密度的水生态风险大小, 本研究参照了生态毒理学中有毒化学品的生态风险评价思路和方法。虽然化学品的生态风险是通过直接的生物毒性产生, 而微囊藻水华的生态风险有直接的毒性效应和间接效应, 但直接和间接效应的最终结果都反映在生物的生长抑制和死亡率上, 该方法能够客观量化洱海微囊藻对各营养层级物种的影响程度, 且同时包含直接的毒性效应和间接效应(如降低溶解氧、光照等), 因此借鉴生态毒理学中生态风险评价思路是可行的。目前国际上普遍使用的推导水生态风险基准有3种, 即评价因子法、毒性百分数排序法和物种敏感度分布法。评价因子法所需数据少, 计算简单易行, 但基准值主要依赖于敏感物种, 有一定经验成分; 毒性百分数排序法和物种敏感度分布法能够覆盖更多受试生物的毒性数据, 具有统计学意义[22], 物种敏感度分布法操作过程中如果毒理数据不够好, 则通过拟合得到方程所计算出来的水质基准会出现较大偏差[23]。而本研究受试生物包括底栖动物、浮游动物、鱼类和沉水植物等各营养级生物, 适合毒性百分数排序法。且所选生物尽量取自洱海, 具有很强针对性,因而实验结果较符合洱海当地生态环境。
本研究结果表明, 洱海微囊藻达到1.1×107cells/L开始有慢性高风险。由于风险对象和保护目标不同, 这与其他蓝藻相关标准有一定差别, 比如Sulis等[24]从饮用水安全的角度出发, 提出用蓝藻细胞浓度1×108cells/L作为淡水水华风险阈值。加拿大卫生组织从保护敏感人群(儿童)健康安全的角度制定娱乐用水限值为蓝藻密度1×108cells/L[6]。美国华盛顿州对娱乐用水的规定是, 如果用蓝藻细胞密度来衡量, 则采用WHO提出的1×108cells/L限值,但微囊藻和浮丝藻水华限值为2×107cells/L(见美国环保部网站: https://www.epa.gov/nutrient-policy-data/guidelines-and-recommendations#what1)。韩国政府对主要湖泊提出藻类预警系统(见韩国环保部政府网站: http://eng.me.go.kr/eng/web/index.do?menuId=279&findDepth=1), 规定蓝绿藻密度达到5×105cells/L为藻类警示(Algae advisory), 达到5×106cells/L为藻类警报(Algae warning), 超过1×109cells/L为藻类爆发(Algae outbreak)。这些相关标准是基于水功能用途, 从人类健康安全角度出发制定的, 而本研究的结果是以洱海水生态系统为保护目标所确定的生态风险阈值。
3.2 水华面积和持续时间的评价
显然评价微囊藻水华的生态风险, 单纯考虑藻密度是不够的, 还需要考虑湖泊中水华的面积和水华持续的时间。而水华面积对水生态系统的影响大小难以通过模拟实验进行分析, 目前相关研究是通过经验确定。比如南京地理湖泊研究所刘聚涛等[19]研究确定的太湖蓝藻水华灾情评价标准, 将蓝藻水华面积百分比(%)划分为≤5、5—20、20—30、30—45、>45, 分别对应轻灾、中灾、重灾、极重灾、巨灾五个等级。本研究发现沉水植物的慢性效应阈值较低, 即沉水植物对微囊藻水华比较敏感,因此以洱海沉水植被面积为参考确定微囊藻水华面积风险是合理的。历史上, 20世纪70年代以前洱海沉水植物全湖覆盖度超过40%, 20世纪80年代到90年代覆盖度在30%左右波动, 目前分布区面积仅占8%[25]。洱海水华发生时, 水华藻类在风浪的作用下易在湖滨带聚集, 而此区域也正是沉水植被分布的区域。本研究组通过遥感影像反演洱海近30年叶绿素a分布发现(数据未发表), 全年水华(Chl.a>20 μg/L)面积≤2%的年份极少, 而1996年之前并无水华发生的报道, 因此可推测水华面积≤2%产生的生态风险很低。以目前洱海仅存的沉水植物覆盖度8%为保护目标, 将水华面积百分比(%)划分为≤2、2—8、>8三级, 分别对应低风险、中风险、高风险。当考虑急性效应时, 底栖动物钩虾的阈值较低, 在进行急性风险评价时成为需要受先保护的物种。钩虾为营底栖生活物种, 多分布在入湖口、出湖口和湖滨带等饵料丰盈、空间异质性高的地区[26]。根据洱海全湖调查估算该类型区域约占全湖面积的7.3%, 与沉水植物覆盖度差别不大,因而急性风险评价保护面积目标基本与慢性评价一致。
洱海水华持续时间可长可短, 有报道的能长达50d之久[18]。水华持续时间与生态风险的关系, 也可借鉴生态毒理学风险评估思路划分为短期水华(急性)和长期水华(慢性)来进行评估。急性和慢性暴露效应结果是风险评估的主要依据。Calow等[27]在水生态毒理学研究中, 将暴露期分为急性、亚急性和慢性三类, 并列举部分物种(虹鳟(Oncorhynchus mykiss)、肥头鲤(Pimephales promelas))急性暴露期是≤7d。Timbrell 等[28]认为, 亚慢性试验指动物暴露时间较为延长的试验, 通常28d或30d, 慢性试验指将动物暴露时间延长至12月—2年(啮齿类)或6—16月(非啮齿类)的试验。考虑到水华持续时间不可能超过一年, 因此可以考虑将持续时间≤7d的水华进行急性生态风险评估, 超过7d的水华进行慢性生态风险评估。综合微囊藻水华密度、面积和持续时间, 制定洱海微囊藻水华水生态风险评价标准见表5、表6。进行风险等级判断时, 3个条件需同时满足。

表6 洱海微囊藻水华慢性生态风险评价表Tab. 6 Chronic ecological risk assessment of Microcystis bloom in Erhai Lake
3.3 评价标准在洱海微囊藻水华上的应用
洱海水华持续时间一般较长, 但也有少数年份水华持续时间较短[18], 因此大部分洱海微囊藻水华应参考慢性生态风险评价标准。根据本研究确定的微囊藻慢性生态风险评价标准, 对洱海发生的几次微囊藻水华进行评价。
据文献报道2009年7月暴发微囊藻水华, 藻密度达到2.08×107cells/L, 为慢性高风险阈值的1.9倍[29];2013年9—10月份洱海浮游植物丰度均值为1.3×107cells/L, 优势种为微囊藻属[9], 达到慢性高风险阈值; 2015年11月份浮游植物密度达到3×107cells/L, 优势种为微囊藻属, 为慢性高风险阈值的2.7倍[30]。近年来, 微囊藻属成为洱海水华的优势种属, 适用于本研究评估体系。
水华面积缺乏常年监测资料, 仅能通过有限的遥感影像推测, 本研究组通过遥感影像反演了洱海近30年叶绿素a分布(未发表内容), 以Chl.a>20 μg/L判定为微囊藻水华, 反演结果表明2009、2013、2015年水华面积百分比>8%。据当地监测部门反映以上蓝藻水华持续时间超过7天。综合藻密度、面积、持续时间, 2009、2013、2015年等洱海微囊藻水华均达到慢性高风险水平。洱海自20世纪90年代以来多次暴发大规模蓝藻水华, 藻密度的增高导致水体透明度从20世纪80年代4m降低到2009年的1.6 m[25], 从而引起沉水植被退化, 沉水植被盖度由2004年的40%降低至2009年的8%左右[25]。洱海水生态系统退化现象证实本研究的水生态风险评估标准符合实际情况。
4 结论
——以武汉紫阳湖为例

