紫皮洋葱低聚糖的提取及分离研究
贾 甜,曾 洁,张瑞瑶,曹 蒙,宋孟迪,胡雅婕,高海燕,张 浩
(河南科技学院食品学院,河南新乡 453003)
洋葱,又名玉葱,百合科葱属植物,被誉为“蔬中皇后”、“菜中玫瑰”。洋葱营养丰富,含有硫化合物、低聚糖、类黄酮化合物、多糖、前列腺素类和甾体皂苷等多种生理活性物质,具有抗癌,抗菌,抗衰老,降血压,抗动脉硬化,治疗糖尿病等生理作用[1-2]。其中,洋葱中含有丰富的低聚糖,低聚糖是由2~10个单糖通过糖苷键连接形成的直链或支链低度聚合糖[3],洋葱低聚糖不仅具有低热、稳定、安全无毒的理化性质,而且具有预防、抑制和杀死肿瘤细胞,提高机体免疫力,激活巨噬细胞的吞噬活性,提高机体的抗感染能力的重要作用[4-6]。目前多采用溶剂直接浸提、微波和超声波辅助萃取及酶水解法提取低聚糖,但由于聚合度或极性相近,低聚糖的分离是一大难题。本文对紫皮洋葱低聚糖的提取进行优化,并对提取物进行Bio gel P-2生物胶层析分离检测及水解研究,为紫皮洋葱低聚糖的进一步研究提供了理论依据,同时也为植物低聚糖的分离方法及水解方法提供一种参考。
1 材料与方法
1.1 材料与仪器
鲜紫皮洋葱 市售;蒽酮 天津市科密欧化学试剂有限公司;硫酸 郑州派尼化学试剂厂;乙酸乙酯、甲醇、乙醇、葡萄糖(TLC检测用) 天津市光复科技发展有限公司;果糖(TLC检测用) 合肥博美生物科技有限责任公司;蔗糖(TLC检测用) 天津市德恩化学试剂有限公司;棉子糖(TLC检测用) Alfa Aesar;磷酸氢二钠、磷酸二氢钠 天津市东丽区天大化学试剂厂;葡萄糖(HPLC分析用)、果糖(HPLC分析用)、蔗糖(HPLC分析用)蔗果三糖、蔗果四糖、蔗果六糖 量子高科(中国)生物股份有限公司;β-D-呋喃果糖苷酶(酶活力为330 U/mg)、硅胶板(GF254) 美国sigma公司;生物胶Bio-gel P-2 美国BIO-RAD公司;4-甲氧基苯甲醛 国药集团化学试剂有限公司。
WBL25B26型榨汁机 美的公司;ME104E型电子天平 梅特勒-托利多仪器(上海)有限公司;SHZ-95B型循环水式多用真空泵 巩义市予华仪器有限责任公司;SHA-C型水浴恒温振荡器 金坛市杰瑞尔电器有限公司;冰箱 青岛海尔股份有限公司;TDL-40B台式离心机 上海安亭科学仪器厂;YRE-52AA型旋转蒸发仪 巩义市予华仪器有限责任公司;HZ-2S型恒流泵 上海泸西分析仪器厂有限公司;玻璃点样毛细管 华西医科大学仪器厂;721型分光光度计 上海舜宇恒平科学仪器有限公司;恒温鼓风干燥箱 上海琅玕实验设备有限公司;FL-1型可调式封闭电炉 北京市永光明医疗仪器有限公司;10 μL微量进样器 上海高鸽工贸有限公司;Waters 510型高效液相色谱仪 Waters公司(Milford,MA,USA)。
1.2 实验方法
1.2.1 紫皮洋葱低聚糖的提取 将新鲜紫皮洋葱剥去外层干皮,破碎其组织,得到匀浆液,准确称取匀浆10 g置于250 mL烧杯中,量取100 mL 95%乙醇用于除去洋葱匀浆中的可溶性单糖,抽滤,滤渣重复洗涤两次,采用热水浸提法,将一定料液比的滤渣和超纯水装入锥形瓶中,并加上封口膜,置于水浴振荡器中,在一定提取温度、一定提取时间条件下,得到紫皮洋葱糖类物质,加2.5倍无水乙醇搅拌并置于4 ℃冰箱过夜,以4500×g转速离心5 min,弃沉淀,将上清液旋转蒸发即可得到紫皮洋葱低聚糖提取液,定容至50 mL备用[2,7-9]。
1.2.2 低聚糖含量的定性分析 紫皮洋葱低聚糖提取液经过蒽酮-硫酸比色法显色后[13-15],采用紫外-可见光谱仪扫描显色后的溶液[13],采集吸收波长为400~800 nm,分辨率为1 nm的吸收光谱。
采用蒽酮-硫酸比色法制作葡萄糖标准曲线[12]。
紫皮洋葱低聚糖的测定:取1 mL紫皮洋葱低聚糖提取液,采用蒽酮-硫酸比色法在紫外光谱最大波长处测定其吸光值,平行测定3次,取平均值,代入标准曲线,计算出低聚糖提取量,再根据以下公式计算得率。
得率(mg/g)=低聚糖提取量(mg)/紫皮洋葱重量(g)
1.2.3 紫皮洋葱低聚糖提取试验设计
1.2.3.1 单因素实验 在提取温度为70 ℃、提取时间80 min的条件下,探究料液比1∶1、1∶2、1∶3、1∶4、1∶5 g/mL对洋葱低聚糖得率的影响;在料液比1∶3 g/mL,提取温度70 ℃的条件下,探究提取时间60、70、80、90、100 min对洋葱低聚糖得率的影响;在料液比为1∶3 g/mL,提取时间为80 min的条件下,探究温度50、60、70、80、90 ℃对洋葱低聚糖得率的影响。
1.2.3.2 正交试验 为确定最佳提取工艺参数,采用L9(34)正交设计,比较料液比(A)、提取时间(B)和提取温度(C)对洋葱低聚糖得率的影响,以洋葱低聚糖得率作为指标。

表1 正交实验因素水平表Table 1 Experiment design
1.2.4 低聚糖的TLC检测分析 TLC染色液:准确量取12.5 mL 4-甲氧基苯甲醛于212.5 mL冰浴甲醇中,搅拌,防止液体飞溅,小心加入25 mL浓硫酸于冰浴甲醇中,60 min内加完,淡黄色的染色液贮存于-20 ℃备用。根据点样个数,将薄层层析板裁取适当大小,用铅笔在距薄层板一端大约 1 cm处每隔适当距离画点,同时在下方做好标记,然后用移液器分别吸取0.3 μL浓度为10 mmol/mL的葡萄糖、果糖、蔗糖、棉子糖及0.3 μL样品点于对应点上,放入45 ℃干燥箱中烘干。把点好样的薄层板放进展开槽中展开,以V(乙酸乙酯)∶V(甲醇)∶V(水)∶V(冰醋酸)=6∶2 ∶1∶0.2为展开剂进行展开,展开完毕后,进行染色,记下斑点位置[16-17]。
1.2.5 质谱分析 本实验将提取到的紫皮洋葱低聚糖进行LC-MS/MS分析得到质谱图,根据质谱峰的位置及峰的强度对产物进行成分分析和结构分析,本实验采用TQD LC/MS system(Waters,USA),配有真空脱气系统,设置扫描范围为150~1800 m/z,流动相为超纯水[18-19],使用微量进样器进样,每次进样10 μL。
为更迅速、便捷地处理稿件,本刊于2011年初建立了《临床神经病学杂志》网上采编系统。此系统可方便作者投稿、查询,亦可方便本刊编委审稿及内部编辑人员日常工作,现已正式投入使用。广大作者及本刊编委均可登录本刊网站(http://lcsjbxzz.cnbh.com),点击“投稿及审稿办公系统”,进行在线注册,注册成功后即可在线投稿、办公。欢迎广大读者踊跃投稿。
1.2.6 高效液相色谱分析(HPLC) 采用高效液相色谱法对所提取到的低聚糖及该低聚糖水解后的产物进行定性分析。
标准品配制:分别称取葡萄糖、果糖、蔗糖、蔗果三糖、蔗果四糖、蔗果六糖10 mg,加超纯水溶解并定容至10 mL,配制成1 mg/mL的单一标准品存于4 ℃冰箱备用,根据使用需求进行稀释,配制成不同浓度的混合标准样品,过0.22 μm滤膜待用。
样品处理:称取紫皮洋葱低聚糖10 mg,加超纯水定容至10 mL,过0.22 μm滤膜待用。紫皮洋葱低聚糖的水解:将一定量的紫皮洋葱低聚糖加入到pH为5.5浓度为 50 mmol/L的磷酸缓冲液中,配制成浓度为10%的糖液,取4 mL于55 ℃预热10 min,加入等量β-呋喃果糖苷酶液调节pH至4.0,在转速为200 r/min的55 ℃气浴蒸荡器中反应40 min后放入沸水浴15 min终止反应,过0.22 μm滤膜待用[20-22]。
参数设置:HPLC分析在Waters 510高效液相色谱仪(Milford,MA,USA)上进行;分离柱:Hypersil-NH2柱(4.6×250 mm;5 μm);流动相:水∶乙腈=32∶68;流速:1.0 mL/min;柱温:30 ℃;进样量:10 μL。
1.2.7 紫皮洋葱低聚糖的分离纯化 准确称取20 g紫皮洋葱匀浆,按优化后的方法提取紫皮洋葱低聚糖,提取液经抽滤后浓缩至约2 mL,然后用Bio gel P-2凝胶层析柱纯化[23-27]。将处理好的Bio gel P-2凝胶装柱,上样,洗脱剂为去离子水,调整自动收集器收集,每8 min收集1管,每管6 mL,利用重力作用洗脱平衡1~2个柱体积。对收集到的100管分离液进行TLC快速检测,用微量移液枪依次吸取各管0.3 μL溶液,点样,烘干,置于254 nm紫外灯下观察是否有显紫外的点,做好标记,然后对硅胶板进行染色,烘烤,挑选出不显紫外且显色点的管号做进一步TLC检测分析,并以葡萄糖、果糖、蔗糖、棉子糖为标准样品作为参照。
从经快速检测显色的管中吸取1.0 mL分离液,以蒽酮-硫酸比色法在紫外光谱图最大吸收峰处测定吸光值,处理数据,作紫皮洋葱低聚糖提取液的糖分分布曲线。
1.3 数据统计分析
采用Excel 2007软件、正交助手软件及Origin 8.0软件处理分析实验数据并绘图,每个样品平行测定三次。
2 结果与分析
2.1 紫皮洋葱低聚糖的可见光谱分析及标准曲线建立
紫皮洋葱低聚糖的可见光谱图如图1所示。从图1中可看出,在628 nm处有最大吸收峰,故选择628 nm为吸收波长。标准曲线如图2所示,实验测得标准回归方程为:y=0.0111x+0.0116,相关系数为:R2=0.9995。
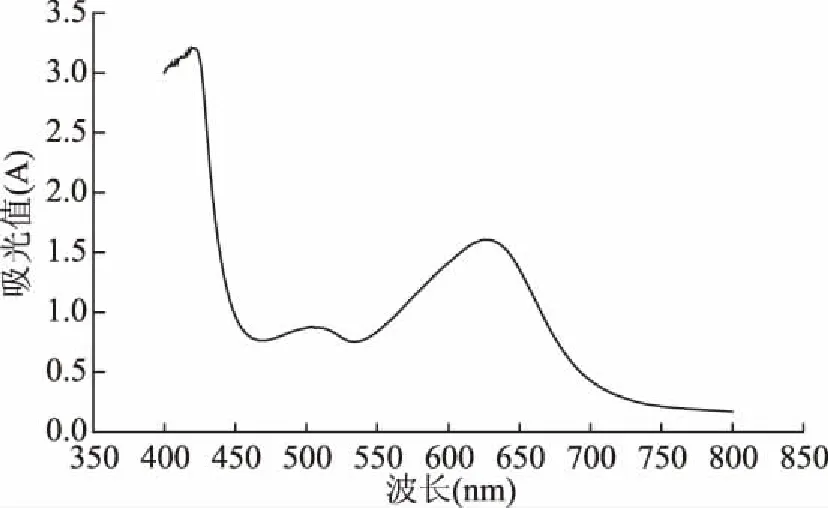
图1 紫皮洋葱低聚糖的可见光谱分析Fig.1 Visible spectrum analysis of oligosaccharides from purple onion
2.2 单因素实验
2.2.1 料液比的确定 由图3可知,料液比在1∶1~1∶4 g/mL之间时,低聚糖提取量随着水提取剂用量的增加不断增加,这可能是由于提取剂用量的增大提高了原料与溶剂之间的传质推动力[22],提高了糖分子的扩散速率,从而低聚糖不断溶出。当料液比达到1∶4 g/mL,再增加提取剂的量时,低聚糖提取量没有明显增加,趋于稳定状态,可能是在此条件下,低聚糖已经近乎全部浸出,再增加提取剂只会增加旋转蒸发浓缩难度以及成本,所以,选择料液比为1∶3、1∶4、1∶5三个水平为正交试验考察因素。

图3 料液比对低聚糖提取量的影响Fig.3 Effect of liquid ratio on the extraction of oligosaccharides
2.2.2 提取时间的确定 低聚糖的提取过程十分复杂,包括浸泡、扩散、渗透、溶解、再扩散、平衡等多个步骤[8]。由图4可知,提取时间在50~90 min时,随着时间的延长,低聚糖能不断的溶出,提取量随着时间的增加而增加。但是当提取时间大于90 min时,低聚糖提取量反而减小,提取时间过长,会造成提取液中部分寡糖分解,导致得率下降。所以,选择提取时间为80、90、100 min三个水平为正交试验考察因素。

图4 提取时间对低聚糖提取量的影响Fig.4 Effect of extracting time on the extraction of oligosaccharides
2.2.3 提取温度的确定 由图5可知,温度在50~70 ℃之间时,低聚糖提取量随提取温度的升高而增加,在此温度范围内,低聚糖溶解度随着温度的升高而增大。当温度高于70 ℃后,温度越高低聚糖提取量反而减少,这可能是某些热稳定性较差的寡糖在较高温度下分解,从而导致较低的提取量。所以,选择温度为60、70、80 ℃三个水平为正交试验考察因素。

图5 提取温度对低聚糖提取量的影响Fig.5 Effect of extraction temperature on the extraction of oligosaccharides
2.3 正交试验结果与分析
由表2可知,影响紫皮洋葱低聚糖得率的主次因素是提取温度>提取时间>料液比,由K值可知,紫皮洋葱低聚糖提取条件的最佳组合为A3B1C2,即料液比1∶5 g/mL,提取时间80 min,提取温度70 ℃,经验证,所提取到的低聚糖得率为3.92 mg/g,其他条件下都高。

表2 正交试验结果Table 2 The orthogonal experiment results
2.4 TLC检测与质谱分析
由图6可知,紫皮洋葱提取液的TLC图谱中显示了主要的两大类糖分,其中位置较高的斑点与果糖的Rf值相近,位置较低的斑点与蔗糖的Rf值相近,并且样品点靠下部分有拖尾现象,可能是其它聚合度的糖类物质但其所占比例很低,难以清晰显现。由图7质谱图及表3质谱分析表可知,所提取的紫皮洋葱低聚糖中存在二糖(360.13 m/z)、三糖(521.95 m/z)、四糖(683.86 m/z)、六糖(1029.64 m/z),可能因为某些聚合度的糖含量较低,所以在TLC检测中难以清晰显现,其中测得的分子量中,1146.26、1302.27、1486.58 m/z为上述聚合度的低聚糖在质谱测量过程中不同聚合度的叠加,1146.26 m/z为三糖和四糖的叠加,1302.27 m/z为二糖和六糖的叠加或者是两个四糖的叠加,1486.58 m/z为三个三糖的叠加。关于低聚糖组分的定性分析及其活性评价,将在后续实验中进一步研究,以确定其单糖组分与活性的关系。

图6 紫皮洋葱低聚糖的TLC图谱Fig.6 TLC analysis of carbohydrates from purple onion

图7 紫皮洋葱低聚糖的质谱图Fig.7 MS of oligosaccharides from purple onion

表3 紫皮洋葱低聚糖质谱分析表Table 3 The MS analysisTable of oligosaccharides from purple onion
2.5 HPLC结果分析
由图8、图9可知,紫皮洋葱低聚糖中含有蔗糖、蔗果三糖、蔗果四糖、蔗果六糖,其中,蔗果三糖含量较高,蔗果四糖,蔗果六糖含量相对较低,同时,发现葡萄糖和果糖含量较低,说明乙醇沉淀法能较好的除去单糖。由图10可知,紫皮洋葱低聚糖经β-呋喃果糖苷酶水解后,蔗糖、蔗果三糖、蔗果四糖、蔗果六糖含量明显降低,果糖和葡萄糖含量升高,该水解后的HPLC分析说明β-呋喃果糖苷酶在适宜条件能较好的水解紫皮洋葱低聚糖中的蔗果低聚糖。

图8 混合标准溶液的HPLC分析Fig.8 HPLC analysis of the mixed standard solution注:1:果糖;2:葡萄糖;3:蔗糖;4:蔗果三糖; 5:蔗果四糖;6:蔗果六糖;图9、图10同。

图9 紫皮洋葱低聚糖的HPLC分析Fig.9 HPLC analysis of oligosaccharides from purple onion

图10 紫皮洋葱低聚糖水解后的HPLC分析Fig.10 HPLC analysis of oligosaccharides after hydrolysis from purple onion
2.6 Big gel p-2分离纯化
由图11可知,经Big gel p-2凝胶柱层析后,所收集的分离样品中53~71管均有糖类物质存在,53~63管有和蔗糖Rf值相近的糖类物质存在,61~69管有和果糖Rf值相近的糖类物质存在,而粗样品中的拖尾点可能是浓度较低的低聚糖点,经分离后浓度太低,在薄层层析板上未能清晰显现。由图12为紫皮洋葱低聚糖经Big gel p-2凝胶柱层析后得到的糖分分布曲线,Big gel p-2凝胶能起到将具有一定特点的糖类聚集分离的作用,但是并不能完全将洋葱中单一聚合度的低聚糖分离。

图11 紫皮洋葱低聚糖分离后的TLC检测注:1:葡萄糖;2:果糖;3:蔗糖;4:棉子糖; 5:样品;6~14:53管~69管中单数管。Fig.11 TLC analysis of carbohydrates from purple onion after separation

图12 紫皮洋葱低聚糖洗脱曲线Fig.12 Elution curve of carbohydrates from purple onion
3 结论
采用热水浸提法对新鲜紫皮洋葱进行低聚糖的提取,通过单因素实验及正交试验确定影响紫皮洋葱低聚糖提取量的主次因素是提取温度>提取时间>料液比,最佳提取工艺为料液比1∶5 (g/mL)、提取温度70 ℃、提取时间80 min,在此提取工艺下,所提取到的低聚糖含量为3.92 mg/g。TLC检测和MS分析对粗寡糖进行检测,研究表明,所提取的紫皮洋葱低聚糖中存在二糖、三糖、四糖、六糖。同时,对粗寡糖及其水解产物进行HPLC分析,结果显示,紫皮洋葱低聚糖主要组成为蔗果低聚糖,在适宜条件下,β-呋喃果糖苷酶能较好的对其水解。粗寡糖经Bio gel P-2凝胶柱层析后,虽然不能将紫皮洋葱低聚糖不同聚合度的糖组分完全分开,但能对其进行初步分离。

