量子化学计算 对自由基清除肽的构效关系
董梦依,王倩芸,刘科梅,陆 豫,余 勃,*
(1.南昌大学资源环境与化工学院,江西南昌 330031; 2.南昌大学食品科技学院,江西南昌 330031; 3.南昌大学中德联合研究院,江西南昌 330047)
本研究选取12种具有代表性的短肽链RSP作为研究对象,采用半经验AM1和密度泛函理论(DFT)等量子化学计算方法对这些多肽清除自由基活性进行理论计算研究,从而对RSP中的活性基团进行定性判断。同时通过试验测定这些多肽对DPPH自由基、超氧阴离子自由基、羟自由基的清除活性,探讨RSP自由基清除能力与量化参数之间的关系。
1 材料与方法
1.1 材料与设备
1,1-二苯基-2-三硝基苯肼(1,1-Diphenyl-2-picrylhydrazyl radical,DPPH)试剂盒 美国Sigma;天冬氨酸-谷氨酸-谷氨酸(Asp-Glu-Glu,DEE)、甘氨酸-丙氨酸-组氨酸(Gly-Ala-His,GAH)、甘氨酸-甘氨酸-谷氨酸(Gly-Gly-Glu,GGE)、亮氨酸-丙氨酸-精氨酸(Lue-Ala-Arg,LAR)、色氨酸-脯氨酸-亮氨酸(Trp-Pro-Lue,WPL)、酪氨酸-亮氨酸-谷氨酸(Tyr-Lue-Glu,YLE)、甘氨酸-丙氨酸-色氨酸-丙氨酸(Gly-Ala-Trp-Ala,GAWA)、丝氨酸-丝氨酸-甘氨酸-谷氨酸(Ser-Ser-Gly-Glu,SSGE)、组氨酸-缬氨酸-苏氨酸-谷氨酸-谷氨酸(His-Val-Thr-Glu-Glu,HVTEE)、亮氨酸-亮氨酸-脯氨酸-组氨酸-组氨酸(Lue-Lue-Pro-His-His,LLPHH)、甘氨酸-丙氨酸-亮氨酸-丙氨酸-丙氨酸-组氨酸(Gly-Ala-Lue-Ala-Ala-His,GALAAH)、酪氨酸-苯丙氨酸-酪氨酸-脯氨酸-谷氨酸-亮氨酸(Tyr-Phe-Tyr-Pro-Glu-Lue,YFYPEL)片段(纯度>95%) 上海楚肽生物技术有限公司进行固相合成而得;Tris-HCl 缓冲液(pH=8.2)、邻苯三酚、无水乙醇 天津市大茂化学试剂厂。
TU-1810PC紫外可见光分光光度计 北京普析公司;Finnpipette微量移液器 美国热电公司;T型恒温水浴锅 德国LAUDA公司;ER-180A型电子分析天平 日本AND公司。
1.2 自由基清除能力的测定

式中:ΔA0为邻苯三酚的自氧化速率(吸光度每分钟的增值);ΔA为加入样品溶液后邻苯三酚的自氧化速率(吸光度每分钟的增值)。
1.2.2 羟自由基(·OH)清除活性的测定 根据Chen[14]等的实验方法。用蒸馏水溶解多肽至浓度1 mg/mL。分别取多肽溶液、6 mmol/L的FeSO4溶液以及6 mmol/L的H2O2溶液1 mL,混合摇匀后静置10 min,再加入用乙醇溶解的6 mmol/L的水杨酸溶液1 mL,摇匀后再静置30 min,最后用紫外分光光度计测定溶液在510 nm下的吸光值,以二次蒸馏水为对照。
·OH清除率(%)=[1-(Ai-Aj)/A0]×100
其中:A0为用蒸馏水代替多肽时测得的吸光值;Ai为不同多肽浓度下测得的吸光值;Aj为用蒸馏水水代替水杨酸时,不同多肽浓度下测得的本底吸光值。
1.2.3 二苯基-三硝基苯肼(DPPH·)清除活性的测定 根据Je[15]、熊双丽[16]等的实验方法。用蒸馏水溶解多肽至浓度1 mg/mL。取5 mL多肽溶液与5 mL 1×10-4mol/L DPPH无水乙醇溶液充分混合,避光反应30 min,取样在517 nm下测定吸光值Ai。用等体积的无水乙醇替代DPPH溶液作空白对照,等体积的蒸馏水替代样品溶液作为对照。
DPPH·清除率(%)=[1-(Ai-Aj)/A0]×100
其中:Ai为样品组吸光值;Aj为空白组吸光值;A0为对照组吸光值。
1.3 量子化学计算方法
本文采用Gaussian09程序对十二种多肽进行量子化学计算。通过GaussView构建分子模型,使用半经验算法AM1对多肽结构进行初步优化,再利用高精度的密度泛函法(DFT,Density Functional Theory)B3LYP/6-31G(d)基组进一步地进行频率分析与结构优化,直到无虚频后,确定最终的分子构型,并计算其单点能,对得到的NBO净电荷分布、前线轨道系数等量化参数数据进行分析[17]。
2 结果与分析
2.1 多肽清除自由基活性
将12种多肽对3种自由基的清除率分别进行排序。

·OH清除率:HVTEE>GGE≈GALAAH≈GAWA>LAR>LLPHH>>YFYPEL>WPL≈SSGE>GAH>DEE>YLE

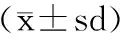
表1 十二种多肽的自由基清除率Table 1 The radical scavenging rate of
2.2 净电荷分布
分子结构理论认为,原子间的电荷差值越大,电子越容易发生跃迁,因此电荷差值较大的位点为分子活性位点,更容易发生化学反应[18-19]。通过计算12种多肽分子上各原子的净电荷,发现电荷差值大的位点多集中在Trp的吲哚结构、Tyr的酚羟基结构、Ser与Thr的羟基结构、His的杂环结构,以及氨基的氮原子、羧基的氧原子和肽键上,这些都是多肽的活性位点。
这里选取了HVTEE与YFYPEL的部分NBO净电荷分布,见图1与表2。可以看出,HVTEE与YFYPEL中,末端氨基N原子电荷值都高达-0.8,与旁边氢原子电荷差值超过了1,活性很强;末端羧基C原子电荷分别为0.82862、0.77980,与带负电荷的O原子电荷差值达到1.4;肽键上C原子电荷值为0.66左右,与带负电荷N原子、O原子都具有很大的电荷差值。可见,不同氨基酸序列的多肽结构中,肽键、末端氨基、末端羧基都是主要的活性位点。在HVTEE上,His杂环结构中N原子与H原子之间的电荷差值为0.9,相比杂环上其他原子间电荷差值(0.3/0.4左右)要大,说明N-H键较易断裂,释放活泼性氢与自由基结合,进行抽氢反应;而Glu的-COOH结构中,C原子与-OH上的O原子间具有最大的电荷差值;Thr的-OH结构中,O原子电荷值达到了-0.77670,是带净电荷最大的O原子,与H原子电荷差值达到1.2,因此O-H键容易发生解离。在YFYPEL上,Tyr酚羟基结构中O原子的净电荷值最大,O-H键易断裂与自由基结合,达到清除自由基的目的。这些活性基团都能促进肽清除自由基。
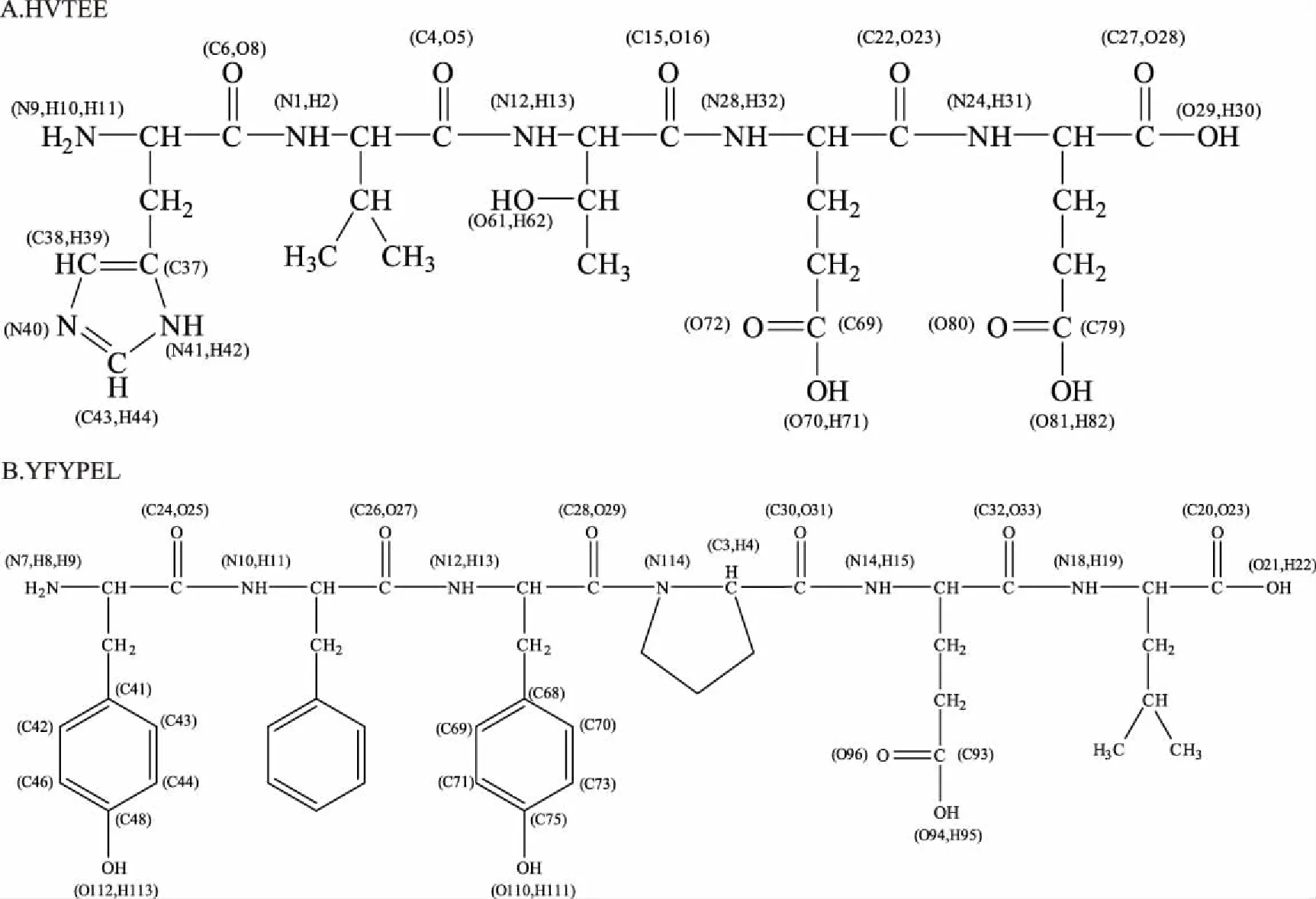
图1 HVTEE与YFYPEL的结构图Fig.1 The structure chart of HVTEE and YFYPEL注:图中序数与表2中序数一致。
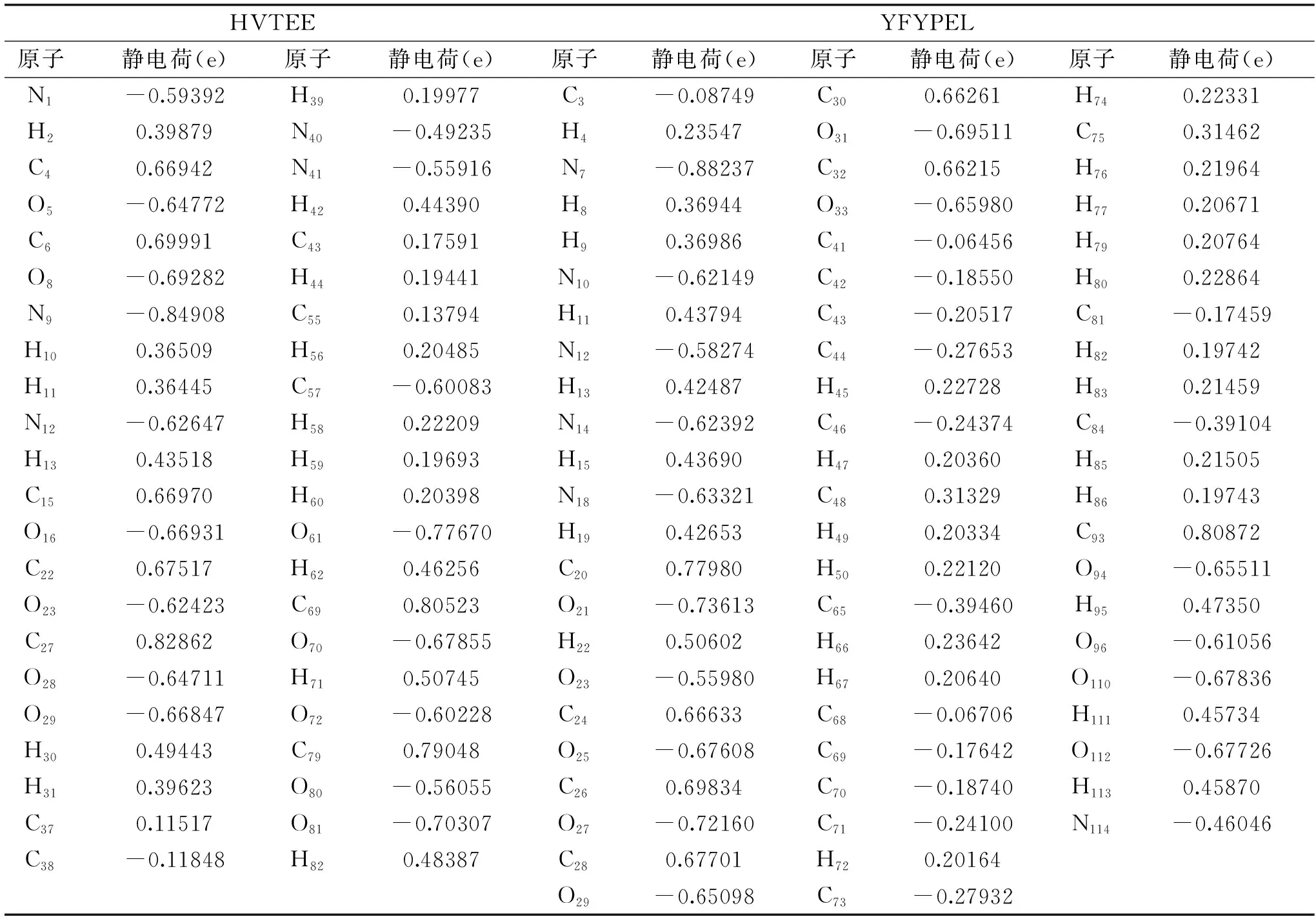
表2 HVTEE与YFYPEL的部分NBO净电荷分布Table 2 The distribution of atomic net charge of HVTEE and YFYPEL
2.3 前线分子轨道分布
分子轨道理论认为,最高占据轨道能与分子的给电子能力密切相关,而最低空分子轨道能则表征了分子接受电子的能力[20]。12种多肽前线分子轨道分布图见图2。从图中可以看出,最高占据轨道能多分布在末端氨基及靠近氨基端的活性基团上,而最低空分子轨道能则主要分布在端链羧基及靠近羧基端的基团上。而含有Trp、Tyr、His、Arg等氨基酸的多肽,其最高占据轨道的电子云主要集中在这些氨基酸上。如WPL、GAWA等带Trp的多肽,吲哚环N-H结构上的电子云密度最大;YLE、YFYPEL等带Tyr的多肽,酚羟基上的电子云密度最大;LAR等带Arg的多肽,胍基上的电子云密度最大;GAH、LLPHH等带His的多肽,杂环上的电子云密度大,说明这些基团都是自由基清除反应中重要的活性位点。而含有Glu、Asp酸性氨基酸的多肽,如DEE、GGE、HVTEE等,其最低空分子轨道的电子云密度受到Glu、Asp中-COOH的影响,提高了其接受电子的能力。对比GAH、HVTEE、GALAAH、LLPHH的最高占据轨道,GAH、HVTEE中电子云都集中在His上;而GALAAH中电子云集中在末端氨基上,原因可能是His距离氨基端太远;而含有两个His的LLPHH,电子云密度主要集中在靠近氨基端的His上,由此推测末端氨基与其他活性基团产生共轭效应,提高了其他基团的给电子能力。

图2 十二种多肽的前线分子轨道分布图Fig.2 The frontier molecular orbital of twelve kinds of peptides注:a:DEE;b:YLE;c:GAH;d:GGE;e:LAR;f:WPL;g:SSGE;h:GAWA;i:HVTEE; j:LLPHH;k:GALAAH;l:YFYPEL,H为HOMO轨道图,L为LUMO轨道图。
2.4 能隙(Egap)与清除自由基活性关系
能隙即最高占据轨道能(EHOMO)与最低空分子轨道能(ELUMO)之差,是指分子从基态到激发态所需要的能量,是抗氧化剂清除自由基能力的一个重要量化参数。能隙越小,则形成反应所需的活化能越小,分子中的电子越容易发生跃迁,分子的自由基清除活性越强[19]。十二种多肽的能隙值见表3。根据能隙值推测其对自由基清除活性能力由强到弱排序为:HVTEE>GALAAH>WPL>SSEG>GAWA>LAR>YFYPEL>LLPHH>GGE>GAH>DEE>YLE。这与RSP清除DPPH·的能力顺序一定程度上吻合,推测通过能隙值可以大致判断出多肽清除DPPH·的活性大小。
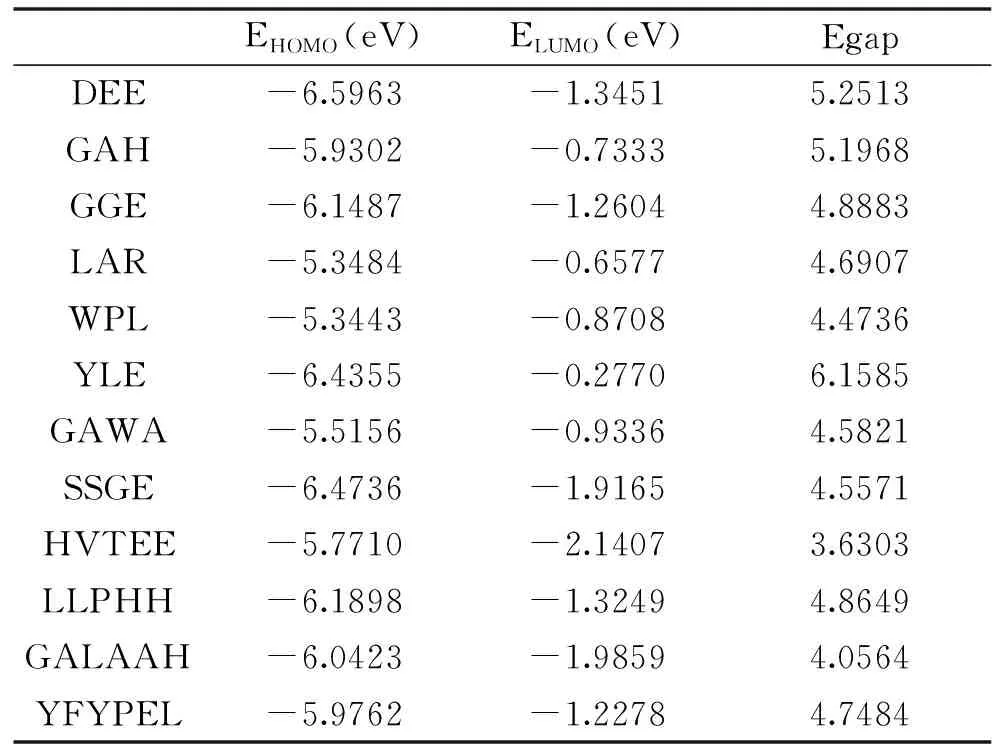
表3 十二种多肽的前线分子轨道能隙值Table 3 The frontier molecular orbital energy of twelve kinds of peptides
3 结论

根据量子化学理论计算我们发现了RSP的活性位点,但具体的RSP清除自由基机理尚不明确。量子化学计算作为预测手段在多肽清除自由基的构效关系、作用机制上,还具有很大的探讨空间。

