超声波法提取紫薯茎叶中总黄酮的工艺优化
郑 丽,彭 雪,张 悦,周瑾琨,催静蕾,邹基豪,刘振春
(吉林农业大学食品科学与工程学院,吉林长春 130118)
紫薯(Ipomoeabatatas(L.)Poir)为旋花科番薯属紫薯种,又名黑薯,薯肉呈紫色至深紫色。它除了具有普通红薯的营养成分外,还富含硒元素和花青素[1],我国紫薯亩产量达2000~3000 kg[2]。国内外大量研究表明,总黄酮具有抗氧化[3]、消除体内自由基[4]、抗衰老[5]、抗肿瘤[6]以及抗心血管疾病[7]等功能。在紫薯秧蔓的顶部约5~15 cm及嫩叶、叶柄统称为紫薯茎叶[8],紫薯茎叶作为一种营养丰富的紫薯副产物,主要用作牲畜饲料或废弃物,在东北地区这种现象普遍存在[9-12]。若可以将紫薯的茎叶中大量潜在的总黄酮资源加以综合利用,不仅会使紫薯的经济价值最大化,而且还可以保护环境。
黄酮类化合物根据其理化性质,常用的提取方法有热水提取法、有机溶剂提取法、超声波提取法、酶解法、微波提取法以及超临界流体萃取法[13-16]等。目前,超声辅助乙醇提取技术在总黄酮类成分提取过程中的优势日益凸显,超声提取法是依据超声波的空化作用、机械效应和热效应等加速细胞内有效物质的释放、扩散和溶解,进而显著提高提取效率的一种方法[17],具有操作简单、无需加热、减少提取时间等优点。另有研究表明,响应面法优化提取工艺能直观地反应各因素的交互作用[18-19]。因此,本研究以紫薯茎叶为原料,主要考察了影响总黄酮提取的几个单因素如超声波功率、提取时间、提取温度、液料比和乙醇体积分数,通过统计软件Design-Expert里响应面法的Box-Behnken模式,对提取工艺条件进行优化,以期获得适宜的提取方法,为总黄酮的高效提取及紫薯茎叶的综合利用提供参考。
1 材料与方法
1.1 材料与仪器
紫薯茎叶 采摘于吉林省长春市蔬菜研究所范家屯镇种植基地,俗名紫玫瑰,自然风干后置于60 ℃的干燥箱中烘24 h,然后经样品粉碎机粉碎后过60目筛,密封于塑料袋中备用;芦丁(标品级) 天津一方科技有限公司;无水乙醇、亚硝酸钠、硝酸铝、氢氧化钠 分析纯,天津市天力化学试剂有限公司。
FZ102型微型植物式样粉碎机 天津泰斯特仪器有限公司;JY92-IIDN超声波细胞粉碎机 宁波新芝生物科技股份有限公司;FA2104型电子分析天平 上海精密科学仪器有限公司天平仪器厂;Anki TDL-4型离心器 上海安亭科学仪器厂;TU-1901型紫外可见分光光度计 北京普析通用仪器有限公司;101A-3ET型电热鼓风干燥箱 上海实验仪器厂有限公司;FD-IB-50型冷冻干燥机 北京博医康实验仪器有限公司;SHB-III循环水式多用真空泵 郑州长城科工贸有限公司;RE-52A旋转蒸发仪 上海亚荣生化仪器厂。
1.2 实验方法
1.2.1 工艺流程 新鲜紫薯茎叶自然风干除杂→粉碎过筛(60目筛)→称取紫薯茎叶粉末→石油醚脱脂(液料比10∶1 mL/g)→抽滤、干燥→乙醇溶解→超声辅助提取→离心(5000 r/min,10 min)→上清液定容→NaNO2-Al(NO3)3显色法显色(参照文献[20])→测定吸光度→计算总黄酮得率
1.2.2 标准曲线的绘制 配制浓度为0.2 mg/mL的芦丁标准溶液,硝酸铝显色法制作芦丁标准曲线,经分析处理得到线性回归方程。
1.2.3 总黄酮含量的测定 总黄酮测定参照倪晓霞等[21]报道的硝酸铝显色法略作改动。将在不同条件下所得的样品滤液稀释到一定体积,准确移取待测液0.5 mL于10 mL比色管内,加入5% NaNO20.3 mL,振荡摇匀、静止5 min,再加入10% Al(NO3)30.3 mL,摇匀、静止5 min,然后加入4% NaOH 3.0 mL,用蒸馏水稀释至刻度,摇匀、静止15 min,空白对照采用相同体积的蒸馏水代替样品溶液,在波长510 nm处测定吸光度,结合公式(1)和标准曲线回归方程,求出紫薯茎叶总黄酮的得率。
式(1)
式中:Y-紫薯茎叶总黄酮得率,%;C-紫薯茎叶总黄酮质量浓度,mg/mL;N-稀释的倍数;m-称取紫薯茎叶粉末的质量,g;V-提取液体积,mL。
1.2.4 单因素实验
1.2.4.1 提取温度的选择 设定液料比为20∶1 (mL/g),提取时间为50 min,乙醇体积分数75%,超声波功率为200 W,按以上提取方法考察提取温度为30、40、50、60、70 ℃对紫薯茎叶总黄酮得率的影响。
1.2.4.2 超声功率对紫薯茎叶总黄酮的影响 设定乙醇体积分数为75%,液料比为20∶1 (mL/g),提取时间为50 min,超声温度控制在50 ℃,考察超声波功率为100、200、300、400、500、600 W时对紫薯茎叶总黄酮得率的影响。
1.2.4.3 提取时间对紫薯茎叶总黄酮的影响 设定乙醇体积分数为75%,液料比为20∶1 (mL/g),超声功率为200 W,超声温度控制在50 ℃,考察提取时间为10、20、30、40、50、60 min 时对紫薯茎叶总黄酮得率的影响。
1.2.4.4 乙醇体积分数对紫薯茎叶总黄酮的影响 设定液料比为20∶1 (mL/g),超声功率为200 W,提取时间为50 min,超声温度控制在50 ℃,考察乙醇体积分数为55、60、65、70、75、80%时对紫薯茎叶总黄酮得率的影响。
1.2.4.5 液料比对紫薯茎叶总黄酮的影响 设定乙醇体积分数为75%,超声功率为200 W,提取时间为50 min,超声温度控制在50 ℃,考察液料比为10∶1、20∶1、30∶1、40∶1、50∶1、60∶1 (mL/g)时对紫薯茎叶总黄酮得率的影响。
1.2.5 响应面优化实验设计 根据单因素实验结果,选取对得率影响显著的因素,按照Box-Behnken中心组合设计原理,设计4因素3水平响应面分析实验,进一步优化提取总黄酮条件。实验因素水平和编码如表1所示。
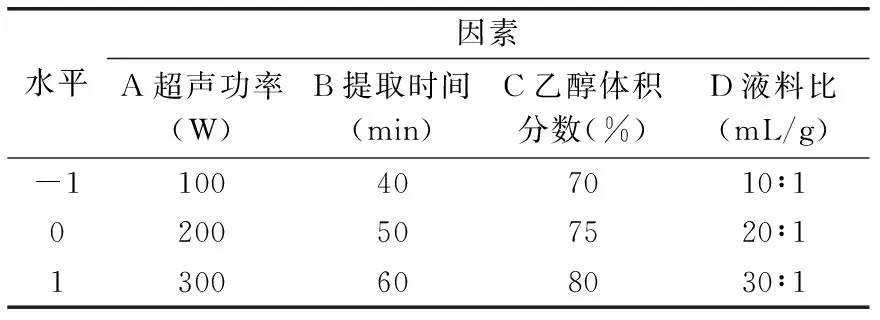
表1 响应面实验因素水平表
1.3 数据处理与统计分析
实验操作重复三次取平均值,计算标准误差并制图分析。实验方案设计和模型构建采用Design Expert 8.0.6软件,数据处理采用Origin Pro 8.5进行,统计分析采用SPSS 18.0软件中的单因素ANOVA进行,显著性水平为p<0.05,极显著水平为p<0.01。
2 结果与分析
2.1 标准曲线的绘制
在波长510 nm处测定吸光度,并以芦丁标准品的浓度为横坐标,吸光度为纵坐标绘制标准曲线。如图1所示,线性回归方程为:y=0.26x+0.0215,R2=0.9922。

图1 芦丁标准曲线
2.2 单因素实验结果
2.2.1 提取温度的选择 由图2可知,提取温度对紫薯茎叶总黄酮的得率影响较小,其得率随提取温度的增加而增加,但是当温度超过50 ℃后,紫薯茎叶总黄酮的得率略有下降。本实验中总黄酮的得率随提取温度的变化趋势与一些报道是相符的[22]。本研究选择提取温度为50 ℃。

图2 提取温度对紫薯茎叶总黄酮得率的影响
2.2.2 超声功率对总黄酮得率的影响 超声波功率对黄酮类化合物的提取有着很重要的影响[23-25]。由图3可知,当超声功率小于200 W时,随着功率的升高,得率增加;当超声功率大于200 W时,随着功率的升高,得率减少;在超声功率200 W时,达到最大值3.25%。这可能是因为,在一定的超声波作用时间下,随着超声功率的增加,超声波的空化作用、机械效应和热效应等加速细胞内有效物质的释放、扩散和溶解,但是,当功率过高,温度升高过快,加速乙醇有机溶剂的挥发,黄酮类物质溶出减少。这种现象与其它报道类似[26]。本研究选择超声功率为200 W作为响应面实验设计的中心点。

图3 超声功率对总黄酮得率的影响
2.2.3 提取时间对总黄酮得率的影响 由图4可知,紫薯茎叶中总黄酮的得率在10~50 min内逐渐提高,在超声时间50 min时,得率获得最大值,这可能是因为超声时间小于50 min时,超声波的空化作用加速了细胞内有效物质的释放;当超声达到一定时间后,继续延长,总黄酮得率反而下降,可能因为超声时间过长,引起温度升高,导致紫薯茎叶中部分黄酮类物质结构遭到破坏,进而影响了总黄酮的溶出。在一些报道中,有些原材料提取总黄酮也观察到类似现象[27]。本研究选择提取时间50 min作为响应面实验设计的中心点。

图4 超声时间对总黄酮得率的影响
2.2.4 乙醇体积分数对总黄酮得率的影响 由图5可知,当乙醇体积分数小于75%时,随着乙醇体积分数的提高,得率增加;当乙醇体积分数大于75%时,随着乙醇体积分数的提高,得率减少;在体积分数75%时达到最大值。这可能是因为乙醇体积分数不同导致极性有所差异,当乙醇体积分数逐渐增加时,总黄酮与蛋白质等物质之间形成的氢键遭到破坏,疏水相互作用力变强,增加了黄酮类化合物的溶出,得率变大;而乙醇体积分数过高,增加了紫薯茎叶中总黄酮与试剂间的极性差异,使得黄酮类物质溶出减少。这种现象与其它报道类似[28]。本研究选择乙醇体积分数75%作为响应面实验设计的中心点。

图5 乙醇体积分数对总黄酮得率的影响
2.2.5 液料比对总黄酮得率的影响 由图6可知,随着液料比的增加,紫薯茎叶总黄酮得率不断增大,在液料比为20∶1 (mL/g)时有最大值,而后液料比再增加,得率反而减少,可能原因是,当乙醇体积用量多时,溶解能力增加,总黄酮溶出增加,但是,溶剂用量过多,将一些醇溶性杂质也溶出,致使得率减少。在一些报道中,有些原材料提取总黄酮也观察到类似现象[29-31]。本研究选择液料比20∶1 (mL/g)作为响应面实验设计的中心点。

图6 液料比对总黄酮得率的影响
2.3 响应面法优化总黄酮提取工艺条件
2.3.1 回归模型的建立与显著性分析 根据Box-Behnken中心组合设计原理,以紫薯茎叶中总黄酮得率为响应值,利用Design-Expert 8.06对表2中的数据进行分析,经因素回归拟合,得到编码值的二次多项回归方程为:

表2 响应面分析设计及结果
Y=3.46+0.16A+0.12B+0.15C-0.063D-0.12AB-0.052AC+0.037AD+0.028BC-0.25BD+0.36CD-0.26A2-0.40B2-0.32C2-0.15D2


表3 回归模型显著性检验与方差分析
2.3.2 响应面及等高线分析 各个因素之间的相互作用对紫薯茎叶中总黄酮得率的影响可以由响应面及等高线反映出来,如图7所示。根据表3与图7可以得到,超声时间(B)与超声功率(A)交互作用对总黄酮得率影响显著(p<0.05),BD和CD两个交互作用比较明显之外,其余交互项均不显著(p>0.05)(影响不显著的交互作用响应面图未列出)。交互作用不显著可能是因素的主效应在起作用[32]。曲线走势越陡峭,表明该因素对总黄酮的得率影响越大;曲线走势越平缓说明该因素对总黄酮得率影响较小[33-34]。研究结果表明,对紫薯茎叶总黄酮的得率影响最大的是超声功率,其次是乙醇体积分数和超声时间,这与表3中回归分析结果相吻合。

图7 各因素交互作用响应面及等高线
2.4 提取工艺的优化与验证实验
经Design-Expert 8.06分析优化,得到超声波法提取紫薯茎叶中总黄酮的最佳工艺条件为:液料比17.63∶1 (g/mL)、超声时间51.88 min、超声功率225.19 W、乙醇体积分数75.41%,在此条件下,根据方程得到总黄酮得率的预测值为3.51%。为检验模型的准确性,采用优化后的最佳提取条件进行实验,为了实验的可操作性,将最佳实验条件修正为:液料比18∶1 (g/mL)、超声时间50 min、超声功率200 W、乙醇体积分数75%,进行5次实验结果如表4所示,结果表明,采用上述优化条件进行实验,总黄酮得率为3.46%,预测值与实际值接近,说明该回归模型优化的配合工艺是有效的,由响应面法优化得到的提取紫薯茎叶中总黄酮的工艺有较强的实用价值。

表4 优化条件下的总黄酮得率
3 结论
针对东北地区紫薯茎叶资源,以优化紫薯茎叶总黄酮的超声辅助提取方法为目的,在单因素实验的基础上优化提取工艺。确定最佳提取工艺为:液料比18∶1 (mL/g)、提取时间50 min、超声功率200 W、乙醇体积分数75%,在此条件下验证实验,紫薯茎叶中总黄酮得率为3.46%。超声波法辅助乙醇提取紫薯茎叶总黄酮,成本低,操作简洁方便。利用响应面分析方法对超声波辅助提取紫薯茎叶中黄酮的提取工艺条件进行优化,可以获得最佳的工艺参数,从而为进一步的实验研究提供依据,同时,也为东北紫薯茎叶资源的开发利用提供可行性依据。

