镉对中华圆田螺抗氧化酶活性和脂质过氧化的影响
周妍英,罗正明
(1.忻州师范学院生物系,山西忻州 034000;2.山西大学黄土高原研究所,山西太原 030006;3.忻州师范学院地理系,山西忻州 034000)
镉在工、农业中的广泛应用对水生生态系统造成了严重破坏。目前,镉已被公认为水体中主要的重金属污染物之一[1]。研究表明,镉会对水生动物的鳃、肝脏、肾脏和性腺等器官造成损害,进而影响其生长、代谢、生殖及免疫等重要生理功能[2-7]。镉在水生生物体中的富集,会通过食物链传递效应进入人体,富集在人体的组织器官中。由于镉具有高毒性、半衰期长和难降解等特点,一旦进入人体,就会严重影响着人体健康[8-10]。
研究表明,镉能引起机体的氧化应激反应,诱导机体产生活性氧自由基(Reactive Oxygen Species,ROS)。在正常情况下,生物体自身由抗氧化系统来维持体内的氧化-还原平衡。当机体处于胁迫状态时,体内的抗氧化酶(超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GPx)、过氧化氢酶(CAT)和谷胱甘肽转硫酶(GST)等)会发挥作用来调控ROS水平[11],以维持动态平衡。机体的抗氧化系统遭到抑制或破坏时,ROS会不断堆积,对细胞或组织造成毒性损害。研究表明,ROS会攻击细胞膜上的脂肪酸发生脂质过氧化反应,进而产生丙二醛(MDA),引起氧化损伤反应[12-13],MDA可作为检测脂质过氧化程度的常用指标。因此,研究污染物影响下抗氧化酶活性的变化规律和氧化损伤程度,探索其致毒机理,引起了学者们的重视。
田螺在水中活动空间小,对重金属污染有一定的耐受性,能真实地反映周围水和底泥的实际污染状况,是一种理想的生物指示物种。中华圆田螺(Cipangopaludinacathayensis)是淡水腹足类中的优势种群,也是我国湖泊、河流、水库及稻田等淡水水域中一种主要的大型底栖软体动物[14],在水生生态系统中起着重要的作用。郭明新等[15]以中华圆田螺为实验材料研究发现,中华圆田螺是一种理想的底泥重金属毒性的指示物种。鉴于此,本研究以中华圆田螺为实验材料,研究了镉对其肝胰腺组织中抗氧化酶(CAT、SOD、GPx和GST)活性、谷胱甘肽(GSH)和氧化损伤指标MDA含量的影响,为水环境重金属污染的控制及生态风险评价提供科学依据。
1 材料与方法
1.1 材料与仪器
中华圆田螺 山东省济宁市微山县微山湖;CdCl2·2.5H2O、Na2HPO4、KH2PO4等 天津市博迪化工厂;SOD、GPx、CAT、GSH、GST、MDA和蛋白质含量等检测试剂盒 南京建成生物工程研究所。
Thermo MR23冷冻离心机、-80 ℃超低温冰箱 日本Thermo公司;SpectraMaxM5多功能酶标仪 美国Molecular Devices公司;电子分析天平 上海菁海仪器有限公司;电动匀浆器 美国Pro Scientific公司。
1.2 实验方法
1.2.1 实验设计 依据我国渔业水质标准[16],设置4个Cd2+染毒浓度(1.5、3.0、6.0、12.0 mg/L)和1个空白对照组(不染毒组)。中华圆田螺在实验室水族缸中暂养20 d以上,养殖水条件为:循环水族缸中水温(20~25 ℃)和pH(7.5左右)。暂养结束后,随机选取个体大小相近、健康的120只田螺进行染毒,空白组放置20只个体,每个染毒组放置25只个体,处理时间为24、48、72和96 h。染毒期间水质条件同暂养期间的水质条件,染毒期间不喂食、不换水。
1.2.2 样品制备 染毒结束后,随机从每个染毒缸中取出5只田螺置于冰上解剖,去壳、迅速取出肝胰腺,称重放入离心管中,-80 ℃冰箱保存待用。
1.2.3 指标检测 将所得肝胰腺组织按1∶10 (g/mL)的比例加入预冷的磷酸缓冲液PBS(0.01 mol/L,pH7.8),匀浆并离心(12000 r/min,10 min,4 ℃),取上清液测定各种生化指标。SOD、CAT、GPx、GST、GSH活性及MDA和蛋白质含量的测定均依据试剂盒说明书中的步骤测定。
1.3 数据处理
利用SPSS 17.0统计分析软件,检验实验数据的正态分布性,采用单因素方差分析法(One-WayANOVA)中的Duncan法进行多组样本间差异显著性,且p<0.05表示差异显著。
2 结果与分析
2.1 镉对中华圆田螺肝胰腺组织中SOD活性的影响
由图1可知,随着Cd2+浓度的增加和暴露时间的延长,中华圆田螺肝胰腺组织中SOD的活性表现为先上升后下降的趋势。与对照组相比,3个Cd2+处理组(24 h、6.0 mg/L,48 h、3.0 mg/L和72 h,3.0 mg/L)肝胰腺中SOD活性最高,当Cd2+暴露时间延长至96 h,随着Cd2+浓度增加,SOD 活力均出现下降趋势(p<0.05),且在浓度为12.0 mg/L时活性降至最低。

图1 Cd2+对中华圆田螺肝胰腺组织中SOD活性的影响
2.2 镉对中华圆田螺肝胰腺组织中CAT活性的影响
由图2可知,随着暴露时间的延长,同一浓度组不同处理时间中华圆田螺肝胰腺组织中的CAT活性表现为先升后降的趋势。同一暴露时间作用下,随着Cd2+浓度的增加,肝胰腺中CAT活性也表现为先升后降的趋势。与对照组相比,每个时间段(24 h、6.0 mg/L,48 h、3.0 mg/L浓度组,72 h、1.5 mg/L和96 h、1.5 mg/L)肝胰腺组织中CAT活性,均显著升高(p<0.05)。当时间延长到96 h时,与对照组比较,1.5 mg/L浓度组显著升高(p<0.05),6.0和12.0 mg/L浓度组显著降低(p<0.05)。
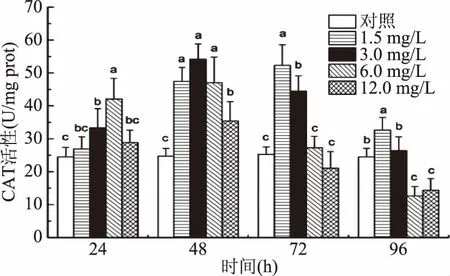
图2 Cd2+对中华圆田螺肝胰腺中CAT活性的影响
2.3 镉对中华圆田螺肝胰腺组织中GPx活性的影响
由图3可知,随着Cd2+浓度的升高,在短时间内(24、48 h),中华圆田螺肝胰腺GPx活性先升高后下降,在Cd2+浓度为3.0 mg/L和1.5 mg/L时GPx活性达到最高值,与对照组有显著差异(p<0.05)。暴露时间为72、96 h时,GPx活性一直呈现下降的趋势,在Cd2+浓度为12.0 mg/L活性GPx降至最低。除1.5 mg/L浓度组的GPx活性随时间的延长呈先升后降的趋势,其余浓度组的GPx活性均随着时间的延长而降低。
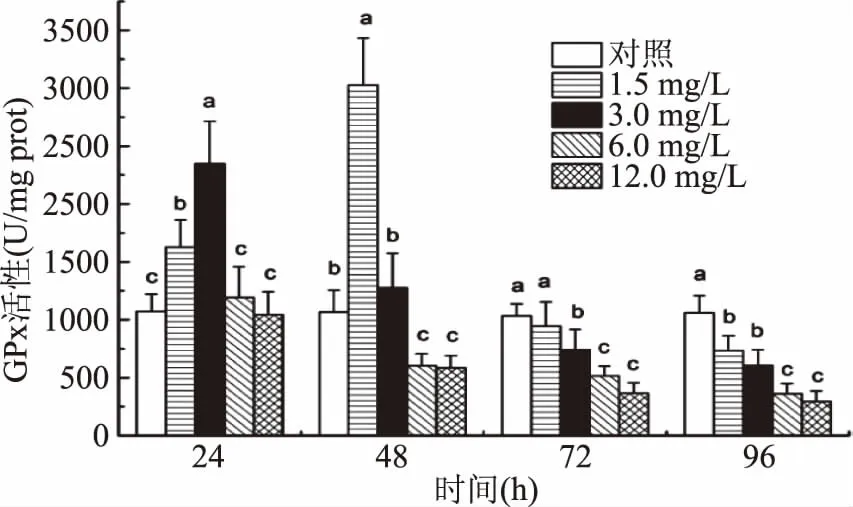
图3 Cd2+对中华圆田螺肝胰腺组织中GPx活性的影响
2.4 镉对中华圆田螺肝胰腺组织中GST活性的影响
由图4可知,随着Cd2+浓度的增加,中华圆田螺肝胰腺组织中GST活性表现为先升高后降低的趋势。除高浓度组(12.0 mg/L)的GST活性随时间的延长呈下降的趋势,其余浓度组的GST活性均随着时间的延长呈先升后降的趋势。与对照组相比,四个处理组当Cd2+暴露24 h、1.5 mg/L,48 h、3.0 mg/L,72 h、1.5 mg/L,96 h、1.5 mg/L时,GST活力最高。暴露时间为24 h时,随着Cd2+浓度的增加,与对照组相比,1.5 mg/L时GST活力显著升高(p<0.05),达到最大值,然后开始下降,6.0 mg/L时GST活性回到正常水平。
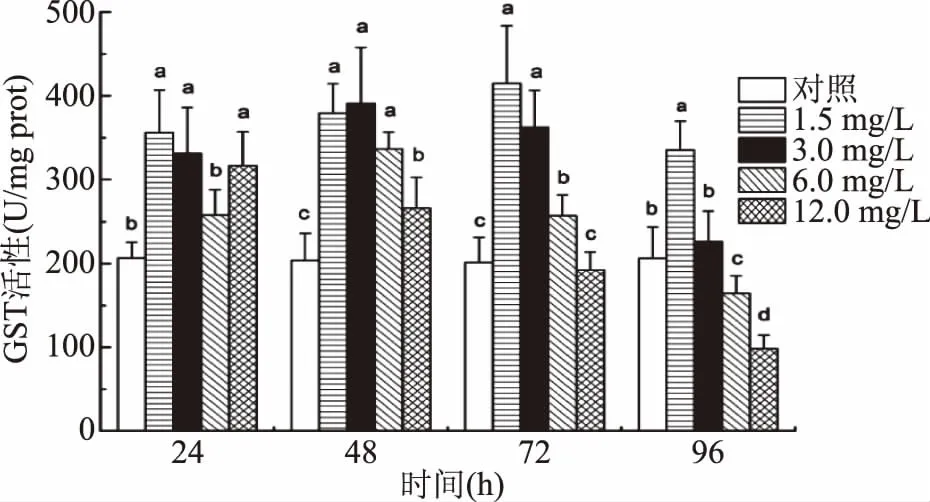
图4 Cd2+对中华圆田螺肝胰腺GST活性的影响
2.5 镉对中华圆田螺肝胰腺组织中GSH含量的影响
由图5可知,随着Cd2+浓度的增加,中华圆田螺肝胰腺中GSH含量均呈先升后降的趋势。低浓度Cd2+(1.5 mg/L)对中华圆田螺肝胰腺组织中的GSH水平无显著影响(p>0.05),中浓度Cd2+(3.0、6.0 mg/L)导致肝胰腺组织中的GSH水平显著升高(p<0.05),高浓度Cd2+(12.0 mg/L)时,与低、中浓度Cd2+(3.0、6.0 mg/L)相比,48 h和96 h两个时间段肝胰腺组织中的GSH含量显著降低(p<0.05)。1.5、6.0和12.0 mg/L浓度组,GSH含量随着时间的延长基本呈先升后降的趋势,与对照组相比,1.5 mg/L浓度组每个时间段的GSH含量均无显著差异(p>0.05),6.0 mg/L浓度组均显著升高(p<0.05)。

图5 Cd2+对中华圆田螺肝胰腺组织中GSH含量的影响
2.6 镉对中华圆田螺肝胰腺组织中MDA含量的影响
随着Cd2+浓度的升高和暴露时间的延长,中华圆田螺肝胰腺组织中MDA水平均呈逐渐升高的趋势(图6)。除了低浓度(1.5 mg/L)Cd2+组,其它浓度组肝胰腺组织中MDA含量显著高于对照组(p<0.05)。与对照组相比,当Cd2+浓度为12.0 mg/L时,各时间段MDA含量均升至最高水平,并在96 h达到峰值。
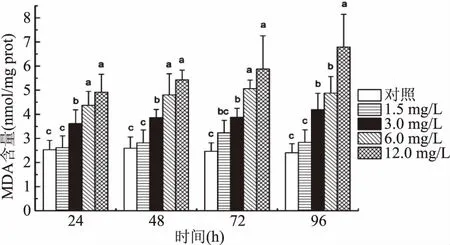
图6 Cd2+对中华圆田螺肝胰腺组织中MDA含量的影响
3 讨论
水生动物的肝胰腺组织不仅是各种生物大分子代谢和储存的重要场所,而且在解毒方面发挥着重要的作用。研究发现,肝胰腺是水生动物镉蓄积的主要器官[3,17],也是镉毒性作用的主要靶器官之一。在正常情况下,生物体中活性自由基(ROS)的产生与清除处于动态平衡状态。为维持ROS的动态平衡状态,生物体自身形成了一套抗氧化系统,分为两类:一类是抗氧化酶,如:SOD、GPx和CAT等,这些酶能清除机体中过量的ROS,从而减少外界胁迫物对机体造成的氧化损伤[11,18-19];而另一类是抗氧化非酶物质,GSH作为一种抗氧化非酶物质,是生物体内抗氧化防御系统中最重要的小分子活性寡肽。作为GPx和GST的作用底物,GSH可以清除生物体内的ROS或脂质过氧化物,使其转化成脂肪酸和水[20],而GSH被氧化成氧化型谷胱甘肽(GSSG)。如果机体长时间处于胁迫状态,ROS不能及时清除,会干扰抗氧化系统的正常运转[21-22],进而对机体产生氧化损伤效应[23-24]。
据报道,低浓度镉暴露下,机体的抗氧化酶活力短时间内会升高,而高浓度的镉会抑制抗氧化酶的活力,对机体造成损害[11]。研究表明,将中华绒螯蟹(Eriochersinensis)暴露于低浓度镉环境中,蟹体由于氧化应激反应,其SOD活性会升高,随着浓度升高,其SOD活性降低[25]。镉对长江华溪蟹(Sinopotamonyangtsekiense)肝胰腺线粒体中SOD活性的影响有类似的变化趋势[26]。同时,在本实验中,镉会引起中华园田螺肝胰腺组织中SOD的活性发生变化,即呈现先升后降的趋势。
CAT广泛存在于机体中各个组织器官或细胞中,能迅速分解H2O2生成H2O和O2。本实验发现,镉可显著诱导田螺肝胰腺组织中CAT活性升高,随着镉浓度增加,CAT 活性开始下降,这与张清顺等[27]的研究结果类似。研究报道,在急性镉暴露下,斑马鱼(Daniorerio)脑组织中CAT酶的活性会升高[28];急性或者亚慢性镉暴露下,绿唇贻贝(Pernacanaliculus)鳃、消化腺和血淋巴细胞中CAT活性也会升高[29]。当少量的镉离子进入机体,诱导机体产生ROS,这时,CAT活性升高来分解H2O2。然而随着机体内镉离子浓度的升高,ROS过多堆积,CAT的合成过程被阻[12,26],从而导致其活性下降。
GPx是在GST的催化作用下,清除机体内H2O2、·OH等自由基的含量[30]。本实验结果显示,田螺肝胰腺中GPx活力呈先升后降趋势,这与SOD和CAT两种抗氧化酶活性变化趋势一致。究其原因,可能是镉离子可以与GPx的活性中心(Se-Cys)结合[26],一方面降低了镉对机体造成的损伤,另一方面导致其活性部位构象发生改变,进而抑制其活性。GST是机体重要的抗氧化酶之一,广泛分布于各种组织细胞与血液中,GSH是生物体内重要的抗氧化物质,在GPx和GST的催化作用下,可以还原ROS生成水,而GSH本身被氧化成GSSH[31]。有研究发现,随着镉处理时间的延长,在48、72、96 h时,背角无齿蚌(Anodontawoodianawoodiana)鳃组织中GST活性被低浓度镉诱导,高浓度镉作用下,GST活性降低[32],这与本实验得到的结果是一致的。抗氧化酶活性变化在整体上表现出“低促高抑”现象,即低浓度镉暴露时,可诱导机体抗氧化酶活性升高,引发“毒性兴奋效应”,而高浓度时,则会使抑制抗氧化酶活性。推测其原因可能涉及:a.低浓度镉诱导产生ROS,促机体自身的防御系统产生应答,抗氧化酶活性升高;b.镉通过与抗氧化酶活性部位的必须金属元素竞争而结合在活性中心,改变了酶的空间构像,进而使其活性降低;c.随着镉暴露浓度的升高或者时间延长,镉通过耗尽体内重要的抗氧化物质GSH和金属硫蛋白MT,使抗氧化系统遭到破坏,使抗氧化酶活性降低。
当机体长时间暴露在被污染的环境中,机体自身的抗氧化系统遭到破坏,ROS会大量堆积在机体内得不到及时清除,这时,ROS首先会攻击细胞膜上的脂质产生脂质过氧化反应生成MDA。目前,MDA含量被认为是细胞氧化损伤机制的主要标志之一[33]。本实验结果显示,随着镉暴露时间延长,浓度的升高,肝胰腺组织中MDA含量也显著升高,这样的结果也有类似的报道[13,21]。原因可能有两方面:一方面,镉会间接诱导机体产生ROS从而攻击细胞膜上的不饱和脂肪酸发生氧化反应[11],进而产生MDA;另一方面,在长时间高浓度镉暴露下,机体中的抗氧化酶活力被抑制[12],从而清除自由基的能力下降,引起MDA含量升高,最终对机体产生氧化损伤。
4 结论
镉暴露引起中华圆田螺肝胰腺组织抗氧化酶活性的变化出现“低促高抑”现象,随着镉浓度增加和暴露时间的延长,中华圆田螺肝胰腺组织中的MDA含量呈持续升高趋势,中华圆田螺的抗氧化酶系统受到镉的破坏,进而引起了氧化损伤效应。抗氧化酶活性和MDA含量的变化均可以灵敏反映镉对水生生物肝胰腺组织的胁迫程度,可以作为水环境重金属毒性效应机理研究的评估指标。总之,中华圆田螺可作为监测水环境重金属污染的一种指示生物物种。

