海洋湿地环境中拮抗水产品腐败菌的乳酸菌筛选与鉴定
孙梦桐,林 洋,白凤翎,*,刘心雨,邢晓红,马欢欢,吕欣然,励建荣,沈 琳
(1.渤海大学食品科学与工程学院,辽宁省食品安全重点实验室,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁锦州 121013;2.北京林业大学生物科学与技术学院,北京 100083;3.大连东霖食品股份有限公司,辽宁大连 116101)
水产品富含优质蛋白、不饱和脂肪酸和多种微量元素,是人类不可或缺的营养要素来源[1]。腐败菌是导致生鲜水产品腐败的主要因素之一,水产品腐败菌主要包括假单胞菌、希瓦氏菌和弧菌等。生物防腐技术具有安全、绿色、无损等优势,已逐渐成为食品防腐保鲜技术的发展方向。乳酸菌(lactic acid bacteria,LAB)通过生态位竞争、营养物竞争、形成酸性环境以及产生拮抗性代谢产物等方式抑制其他微生物的生长[2-3],从天然生态环境中分离的优良菌株已广泛应用于乳制品、肉制品、水产品及发酵果蔬制品等的防腐保鲜[4-5],乳酸菌生物制剂具有良好的发展前景[6-9]。
乳酸菌生物菌株主要来源于传统发酵食品、动物肠道、饲料及自然生态环境中[10-14]。海洋环境中如鱼肠道、体表及水体环境也栖息着大量的拮抗性乳酸菌。Picchietti等[15]从鲷鱼肠道微生物分离的果糖乳杆菌(Lactobacillusfructivorans)AS17B能显著提高鲷幼虫和鱼苗的存活率。Rajaram等[16]从海洋环境的泥沙中分离的乳酸乳杆菌(Lactobacilluslactis)02对枯草芽孢杆菌、巨大芽孢杆菌、金黄色葡萄球菌、铜绿假单胞菌、粪肠球菌、大肠杆菌和志贺氏菌都显示出广泛的抗菌活性。Hwanhlem等[17]在泰国南部红树林的土壤、水、叶、枝和果实中分离出对冷藏虾中单增李斯特菌、热死环丝菌有拮抗作用的乳酸乳球菌(Lactococcuslactissubsp.lactis)KT2W2L,该菌株可用于控制食品腐败菌和致病菌。
比较而言,海洋湿地环境中拮抗性乳酸菌的研究相对较少,因该环境中乳酸菌具有耐盐性特征,对控制海产品腐败菌具有较好的应用价值。芦苇和碱蓬草是渤海北岸普遍生长的耐盐性植物,其根部也栖息着丰富微生物资源,目前国内对沿海植物乳酸菌资源开发的研究较少。本文从渤海锦州海岸湿地植物芦苇和碱蓬草根部分离筛选拮抗性乳酸菌,对水产品中希瓦氏菌、假单胞菌和副溶血弧菌等进行拮抗作用研究,旨在获得性能优良乳酸菌拮抗菌株用于生物制剂,对控制海产品腐败菌和致病菌具有一定的理论和应用价值。
1 材料和方法
1.1 材料与仪器
红色碱蓬草须状根、芦苇白色须状主根 采自锦州滨海新区渤海湾海岸湿地;腐败希瓦氏菌(ShewanellaputrefaciensATCC 8071)、副溶血弧菌(VibrioparahaemolyticusATCC 33847)、铜绿假单胞菌(PseudomonasaeruginosaATCC 9027) 上海北诺生物科技有限公司;MRS琼脂、LB肉汤、琼脂粉 北京奥博星生物技术有限公司;胰蛋白酶(250000 U/g)、木瓜蛋白酶(200000 U/g)、中性蛋白酶(200000 U/g)、碱性蛋白酶(200000 U/g)、胃蛋白酶(15000 U/g) 华蓝化学有限公司;乳酸菌生化鉴定管 杭州天和微生物试剂有限公司;细菌基因组DNA快速抽提试剂盒、DNA marker-D、Taq PCR Master mix 上海生工生物工程有限公司。
DL-CJ-2N型超级洁净工作台 北京市东联哈尔(北京)仪器制造有限公司;SPX-250智能生化培养箱 宁波海曙赛福实验仪器厂;IKA Vortex GENIUS 3振荡器 德国IKA公司;5804R冷冻高速离心机 德国艾本德股份有限公司;ABI stepone plus PCR仪 德国艾本德股份有限公司;Cheimdox XRS凝胶成像仪 美国Bio-Rad公司;DYY-8C电泳仪 北京市六一仪器厂;V3型全自动菌落计数仪 杭州迅数科技有限公司;GI54DS立式高压蒸汽灭菌锅 致微(厦门)仪器有限公司;Labconco Free Zone 2.5台式真空冷冻干燥机 美国LABCONCO公司;RE-2000A旋转蒸发器 上海亚荣生化仪器厂。
1.2 实验方法
1.2.1 乳酸菌分离 在无菌条件下,取碱蓬草须状根和芦苇白色主根根部各10.0 g于90.0 mL无菌生理盐水三角瓶中,充分振荡5 min后,用接种针挑取一环菌悬液在1.0% CaCO3的MRS固体培养基划线接种,37 ℃培养48 h。挑取有溶钙圈的白色菌落进一步分离纯化,挑取单菌落进行革兰氏染色和过氧化氢酶实验[18]。
1.2.2 乳酸菌对腐败菌和致病菌的拮抗实验 将分离得到的乳酸菌菌株在MRS液体中活化3代得到菌悬液,4 ℃ 8000 r/min离心5 min后,0.45 μm滤器过滤得到无细胞上清液(cell free supernatant,CFS)和菌体细胞;S.putrefaciens在LB肉汤中30 ℃恒温静置培养12 h活化至3代,无菌条件下取1.0 mL菌液于9.0 mL 0.85% NaCl中获得10倍稀释液并进行梯度稀释,取10-6、10-7稀释液1.0 mL于平板中(每稀释度3个平行),倒入20~25 mL(45±1) ℃灭菌LB固体培养基,摇匀在30 ℃下培养48 h后,进行菌落计数,得到菌液107CFU/mL,4 ℃条件下保存。稀释10倍得106CFU/mLS.putrefaciens菌悬液为指示菌,利用牛津杯打孔法进行拮抗性实验。将10.0 mL素琼脂倒入无菌平板中,将牛津杯放在凝固后素琼脂表面。吸取125 μL 106CFU/mL菌悬液置于25 mL,(45±1) ℃ LB固体培养基,摇匀,倒入置有牛津杯的平板中(不要倒进牛津杯的孔里)。凝固后取出牛津杯,分别在牛津杯孔中加入180 μL的菌悬液、CFS和菌体细胞,37 ℃培养24 h后用V3型全自动菌落计数仪记录抑菌圈直径,参照文献[19]每个菌株设3个平行实验。V.parahaemolyticus、P.aeruginosa的测定方法同上。
1.2.3 乳酸菌生长与拮抗活性曲线 在15.0 mL MRS液体培养基中接种0.3 mL乳酸菌培养液,37 ℃恒温培养40 h,每隔4 h分别测定菌株细胞生长量OD600值和pH,并按照1.2.2测定菌株CFS对S.putrefaciens的抑菌圈直径,以时间为横坐标绘制乳酸菌拮抗活性生长曲线。
1.2.4 乳酸菌抗菌性能研究
1.2.4.1 酶对乳酸菌抑菌活性的影响 将乳酸菌CFS调至各蛋白酶最适pH后,加入木瓜蛋白酶(pH7.0)、胃蛋白酶(pH2.0)、胰蛋白酶(pH7.5)、中性蛋白酶(pH7.0)和碱性蛋白酶(pH10.0),使其终浓度为1.0 mg/mL,37 ℃水浴2 h,按1.2.2测定其对S.putrefaciens的抑菌活性,计算乳酸菌CFS的抑菌活性丧失率。

式中:φ(对照)为对照组乳酸菌CFS对S.putrefaciens的抑菌圈直径(mm);φ(酶处理)为酶处理后乳酸菌CFS对S.putrefaciens的抑菌圈直径(mm)。
1.2.4.2 温度对乳酸菌抑菌活性的影响 乳酸菌CFS分别在40、60、80、100、121 ℃下处理30 min后,按1.2.2方法测定抑菌活性。
1.2.4.3 pH对乳酸菌抑菌活性的影响 用1.0 mol/L的HCl溶液和1.0 mol/L的NaOH溶液调节菌株CFS pH分别为pH3.0、3.5、4.0、4.5和5.0,按1.2.2测定抑菌活性。
1.2.4.4 NaCl浓度对乳酸菌抑菌活性的影响 将100 μL乳酸菌菌悬液分别加入5.0 mL含有0.5%、1.0%、1.5%、2.0%、2.5%、3.0%、3.5%、4.0% NaCl的MRS液体培养基中,37 ℃培养24 h。按1.2.2测抑菌活性。
1.2.5 乳酸菌菌株鉴定
1.2.5.1 生理生化鉴定 参照《乳酸细菌分类鉴定及实验方法》将筛选出的乳酸菌菌株在37 ℃MRS液体培养基中培养24 h,用接菌环接入各个细菌微量生化反应管中,37 ℃培养24 h,记录反应管颜色变化,并参照《常见细菌系统鉴定手册》进行鉴定[20-21]。
1.2.5.2 16S rRNA鉴定 将所选乳酸菌培养至对数生长期,用DNA快速抽提试剂盒提取其DNA。正向引物为27f(5′-AGAGTTTGATCCTGGC TCAG-3′),反向引物为1492r(5′-TACGGYTACC TTTGTTACGACTT-3′)[22]。PCR 扩增反应体系(25μL):上游引物、下游引物各加入1.0 μL,DNA模板加1.0 μL,取Taq PCR Master mix12.5 μL,超纯水加9.5 μL。PCR扩增:94 ℃条件下预变性2 min,94 ℃条件下变性1 min,60 ℃条件下退火1 min,72 ℃条件下延伸 90 s后循环30次,4 ℃下保温。经1.0%琼脂糖凝胶电泳检测验证后的PCR产物送生工生物工程(上海)股份有限公司测序。登陆GenBank并对测得序列进行BLAST同源性比较,应用MEGA5.0构建系统发育进化树。
1.3 数据处理
实验数据分析处理采用Origin 8.0进行,结果用平均值±标准偏差表示。
2 结果与讨论
2.1 乳酸菌菌株分离结果
从芦苇根和碱蓬草根中共分离获得98个典型乳酸菌菌落,经革兰氏染色(阳性)和过氧化氢酶实验(阴性)初步鉴定出23株乳酸菌,纯化后按乳酸菌来源和挑取顺序进行命名。
2.2 乳酸菌对水产品腐败菌和致病菌拮抗结果
采用牛津杯打孔法从23株乳酸菌中筛选出6株对S.putrefaciens、V.parahaemolyticus、P.aeruginosa有拮抗作用的菌株,其中2株LW-4、LW-7来自芦苇根,4株JP-3、JP-8、JP-11、JP-12来自碱蓬草根。图1为菌株LW-4、LW-7、JP-3、JP-8、JP-11、JP-12的CFS抑制S.putrefaciens和P.aeruginosa的结果,可以看出牛津杯孔周围均出现明显抑菌圈,说明6株乳酸菌对菌株S.putrefaciens和P.aeruginosa均有一定的拮抗作用。

图1 乳酸菌CFS对S. putrefaciens和P. aeruginosa拮抗作用
表1为6株乳酸菌菌悬液和CFS对S.putrefaciens、V.parahaemolyticus、P.aeruginosa拮抗作用结果,从表中可看出,对3株指示菌拮抗作用相对较强的是来自碱蓬草根的菌株JP-12,菌悬液抑菌圈直径分别为19.04、16.09、17.18 mm,CFS抑菌圈直径为18.63、15.54、16.97 mm。菌悬液与菌体细胞、CFS与菌体细胞的抑菌结果有显著性差异(p<0.05),说明菌株抑菌活性物质主要存在于CFS中。因此,选取菌株JP-12进行后续抑菌活性研究。

表1 乳酸菌菌悬液和CFS对三种腐败菌抑菌作用
2.3 乳酸菌生长与拮抗活性曲线
图2是菌株JP-12对S.putrefaciens的拮抗活性和pH变化曲线,从图中可以看出,菌株JP-12对S.putrefaciens的拮抗活性与菌体生长呈现同步增长,pH则呈现逐步下降趋势,24 h后维持在pH3.5左右。到28 h时,菌株JP-12的CFS对S.putrefaciens的抑菌活性达到峰值,抑菌直径为18.90 mm,说明菌株JP-12在此时的抑菌作用最强。因此选择28 h菌株JP-12 CFS作为后续拮抗性实验研究。
2.4 乳酸菌拮抗活性的影响因素的分析
2.4.1 蛋白酶对拮抗活性的影响 表2是各种蛋白酶对S.putrefaciens的抑菌结果,从中可以看出经蛋白酶处理后菌株JP-12 CFS抑菌直径与对照组抑菌直径差异显著(p<0.05)。

表2 蛋白酶对菌株JP-12 CFS拮抗活性影响
从抑菌活性丧失率来看,经胰蛋白酶、胃蛋白酶、中性蛋白酶、碱性蛋白酶、木瓜蛋白酶处理后,CFS抑菌能力均有下降,对各种蛋白酶的抑菌活性丧失率在19.07%至24.21%之间。其中胃蛋白酶处理后抑菌直径为15.62±0.33 mm,活性丧失率为24.21%;碱性蛋白酶为16.68±0.35 mm,抑菌活性丧失率为19.07%,虽然两者之间有差异性显著(p<0.05),但五种酶对菌株JP-12拮抗活性的影响差异性不大。由此说明,菌株JP-12 CFS中抑菌活性物质具有蛋白质特性,酶处理只使其丧失部分活性,这与Ponce和Taheur等[23-24]的研究结果相似。
2.4.2 温度对拮抗活性的影响 经不同温度处理后菌株JP-12 CFS对S.putrefaciens的拮抗作用结果如图3所示,从中可以看出,不同温度处理的CFS,其抑菌直径与对照组无显著差异(p>0.05),表明温度对拮抗活性影响不大,抑菌活性物质具有热稳定性。Hwanhlem等[25]对分离自鸡肠道中产细菌素乳酸菌CFS进行热稳定研究,结果显示抑菌物质具有良好的热稳定性,本研究结果与其相似。

图3 温度对菌株JP-12 CFS拮抗S. putrefaciens的影响
2.4.3 pH对拮抗活性的影响 表3是不同pH下菌株JP-12 CFS对3株目标菌的拮抗作用结果,可以看出随着pH的上升,菌株JP-12 CFS对目标菌的抑菌活性均逐渐下降,pH3.0~3.5时,菌株JP-12 CFS抑菌直径与对照组无显著差异;当pH5.0时,对3株目标菌的抑菌活性基本丧失。由此可以说明CFS中抑菌活性物质在低pH下活性较强,这与Argyri等[26]从发酵橄榄中筛选的乳酸菌菌株Lb.pentosusB282,Lb.plantarumB281和Lb.paracaseisubsp.paracaseiE93在不同pH下对Listeriamonocytogenes,Salmonellaenteritidis及EscherichiacoliO157∶H7的抑菌作用结果相似。

表3 pH对菌株JP-12 CFS抑菌作用的影响
2.4.4 NaCl浓度对拮抗活性的影响 图4是菌株JP-12在0.5%~4.0% NaCl条件下对S.putrefaciens的抑菌结果,从图中可以看出,在0.5%~3.0% NaCl范围内,菌株JP-12对S.putrefaciens的抑菌直径从16.56 mm上升到18.46 mm,表明其抑菌活性逐渐增加;当浓度增加至3.0%~3.5%时,菌株JP-12抑菌直径分别达到18.46 mm和18.15 mm,表明在此范围内菌株JP-12抑菌活性相对较高;当浓度为4.0%时,抑菌直径为17.04 mm,呈下降趋势,与3.5% NaCl具有显著性差异(p<0.05)。由此可见,菌株JP-12在3.0%~3.5% NaCl具有较强的抑菌活性。

图4 NaCl浓度对菌株JP-12抑菌活性影响
2.5 乳酸菌菌株的鉴定
2.5.1 生理生化鉴定 对菌株JP-12进行各种糖代谢实验,结果见表4。依据实验结果对照文献[21]初步判定菌株JP-12为乳杆菌属植物乳杆菌(Lactobacillusplantarum)。

表4 菌株JP-12的糖代谢实验
2.5.2 16S rRNA鉴定 图5为菌株JP-12的16S rRNA基因电泳图,可看出1500 bp左右出现特异性亮带,说明目标片段扩增成功。扩增产物送至生物工程(上海)股份有限公司进行测序后,获得菌株JP-12的核苷酸序列,测序结果在NCBI数据库中进行BLAST比对,构建系统发育树见图6。从中可以看出,菌株JP-12与AB761309.1(Lactobacillusplantarum)在同一个分支上,置信度为98%。因此,鉴定菌株JP-12为植物乳杆菌,此鉴定结果与生理生化鉴定结果相一致。
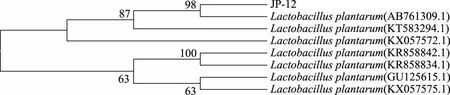
图6 菌株JP-12的16S rRNA基因系统发育树

图5 菌株JP-12的16S rRNA基因扩增电泳图
3 结论
本文从锦州渤海湾海洋湿地碱蓬草根部分离获得1株对腐败希瓦氏菌、铜绿假单胞菌和副溶血弧菌具有较强拮抗活性的乳酸菌菌株JP-12。经生理生化和16S rRNA鉴定菌株JP-12为植物乳杆菌。经分析得出菌株JP-12发酵液在3.0%~3.5% NaCl时抑菌活性较强,表明对海洋水体环境有良好的适应性。依据菌株CFS的蛋白酶、温度、pH等实验结果,可初步判断其抑菌活性物质具有蛋白质特性,并具有良好的热稳定性,且在酸性条件下仍能够保持稳定。研究结果表明,海洋湿地环境也是拮抗性乳酸菌的重要来源,该类拮抗性乳酸菌资源的开发对海产品防腐保鲜具有潜在的应用价值。

