急诊肝动脉栓塞治疗肝癌破裂出血23例临床分析
王 勇,李 浩,祖茂衡,徐 浩
肝癌破裂出血是肝癌患者的一种严重而致命的常见并发症,发生率为2.5%~20%,死亡率高达33%~67%[1,2]。 肝癌破裂出血以往多行内科保守止血和外科手术治疗,但大部分患者多有严重的肝硬化,肝功能分级多在Child B-C级,对外科手术耐受性差,术后并发症和病死率较高。随着介入治疗技术的发展,肝动脉栓塞术 (transcatheter arterial embolization,TAE)对于肝癌破裂出血的治疗价值备受关注。该文通过回顾性分析笔者所在医院2010年9月—2016年12月的23例自发性肝癌破裂出血患者急诊行TAE的治疗过程,探讨其优点及疗效。
1 资料与方法
1.1 一般资料 收集笔者所在医院2010年9月—2016年12月行肝动脉栓塞急诊治疗肝癌破裂出血23例患者的临床资料,其中男19例,女4例;年龄40~74 岁,平均(57.5±2.4)岁。 临床表现主要为突发的右上腹剧痛,腹胀,不同程度出现休克前期症状,所有患者急诊行腹部CT(图1)平扫或增强示肝内占位性病变伴腹腔积血,16例诊断性腹腔穿刺抽出不凝血,所有病例均经临床综合诊断为肝癌破裂出血。CT检查显示:巨块型肝癌10例,肿瘤位于肝右叶15例,肝左叶8例,伴有肝内转移9例。肿瘤直径3.2~18.5 cm,平均7.8 cm。肝功能:A级3例,B级15例,C级5例。
1.2 仪器和材料 肝弯导管(4F RH COOK),4F导管鞘,GE3100数字减影血管造影机,微导管(TERUMO,BOSTON SCIENCE),造影剂(碘海醇、碘克沙醇),超液化碘油,吸收性明胶海绵颗粒,PVA颗粒。
1.3 治疗方法 诊断明确后积极给予止血、扩容、输血等对症治疗后行急诊TAE治疗。采用Seldinger技术穿刺右侧股动脉,引入4F导管鞘,超滑导丝引导下引入4F肝弯导管,将导管插至肝固有动脉造影,观察肿瘤染色、血供及出血情况,并延迟至静脉期观察门静脉情况。结合CT、彩超等影像资料明确肿瘤供血动脉及出血部位后,使用肝弯导管或使用微导管超选择至肿瘤供血动脉,注入超液化碘油、PVA或者吸收性明胶海绵颗粒,边栓塞边造影直至出血停止。门静脉通畅时可以进行栓塞,如有门静脉主干癌栓,应先判断责任血栓管,后选择至责任肝动脉分支栓塞。如有肝动脉门静脉瘘时,应先用PVA或明教海绵颗粒封堵瘘口后再行栓塞。术后予以抗感染、扩容、保肝等对症治疗,并积极预防肝功能衰竭。术中监测患者心电图、血压、血氧饱和度等情况。术后:右下肢制动6 h,卧床24 h,给予辅助止血药,预防性抗感染,护肝、补液及对症处理。腹胀严重者行腹腔穿刺引流治疗,1周后复查上腹部CT显示肝内病灶内碘油沉积情况(图2)。

图1 箭头所示可见肝癌位于肝脏表面,肝脏及脾脏周围可见积液

图2 箭头所示可见肝肿瘤内碘油沉积,肝脏周围积液减少,脾脏周围积液消失
2 结果
2.1 整体疗效 该组23例全部插管成功并行TAE术,其中出血来源于肝右动脉15例,肝左动脉8例。肝动脉造影示肿块血供丰富,表现为供血动脉增粗、紊乱,肿瘤染色明显,5例患者可见对比剂外溢征象 (图3),18例患者未见明显对比剂外溢现象,可见肿瘤染色(图4),4例合并门静脉癌栓,门静脉主干血流通畅,遂予超选择性栓塞。术中使用超液化碘油联合明胶海绵或PVA颗粒进行栓塞,所有病例均成功行TAE术,技术成功率达100%,栓塞后肿瘤染色及对比剂外溢征象消失(图5)。22例患者术后活动性出血停止,贫血及失血性休克得到迅速纠正;1例术后再次出血,再次行TAE术(图6)成功止血。所有患者术后出现不同程度的栓塞后综合征,主要表现为上腹痛、腹胀、发热等症状。给予对症处理,病情稳定后于术后1~2周后出院。
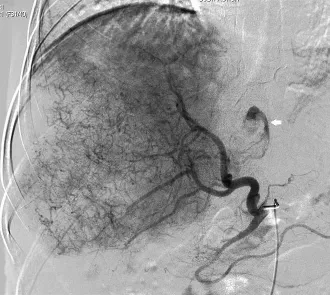
图3 肝动脉DSA造影可见巨块型肿瘤染色,箭头所示可见造影剂外溢征象
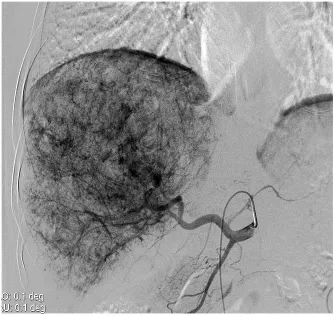
图4 肝动脉DSA造影可见巨快型肿瘤染色,未见造影剂外溢
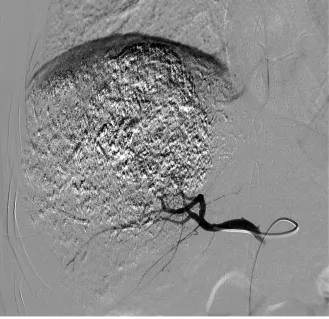
图5 肝动脉术后DSA造影可见肿瘤染色大部分消失,可见碘油沉积影
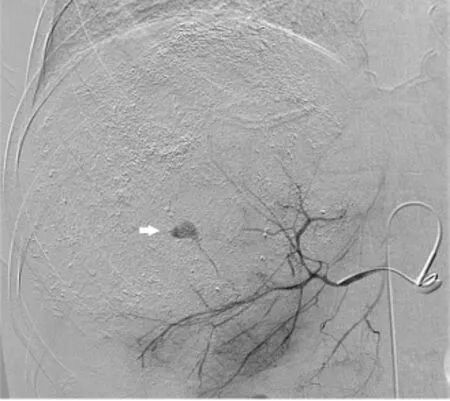
图6 第二次TAE术中肝动脉DSA造影可见造影剂外溢
2.2 预后 23例患者随诊治疗中,3例1个月后死于肝肾功能衰竭;15例1个月后行肝动脉化疗栓塞术(transcatheter arterial chemoembolization,TACE)或TACE联合微波消融术,后多次行介入手术治疗;5例1个月后择期行外科肝癌切除术。患者的肿瘤得到有效控制,延长了生存期。
3 讨论
肝癌破裂出血的机制目前尚属推测,大多数学者[3,4]认为肝癌破裂出血可能与下列因素有关:(1)肿瘤位于肝脏表面,由于缺乏肝组织的覆盖,咳嗽、呕吐、碰撞等各种原因致腹腔内压力突然升高时即可发生破裂出血;(2)肿瘤位于肝脏表面时,呼吸运动引起膈肌与肿瘤摩擦致肿瘤破损出血;(3)凝血功能障碍;(4)肿瘤较大时,肿瘤内部因自身血供不足而出现缺血坏死或肿瘤内部出血,肿瘤内部压力过高致肿瘤破裂出血;(5)肿瘤自身分泌生长因子,诱导肿瘤血管的生成,肿瘤新生血管组织学上缺乏肌层,血管无收缩性及通透性增高致易破裂出血;(6)肿瘤压迫致肿瘤中央静脉及周围门静脉血流不畅,压力升高而易于破裂;(7)癌栓堵塞肝静脉,造成输出道梗阻使瘤体内压力升高致破裂出血;(8)肿瘤直接侵蚀血管致出血。
肝癌破裂出血患者常以突发的剧烈腹痛为首要表现,伴有或不伴有腹膜刺激征。出血量较多时有血压下降、心率增快等低血容量表现,诊断性腹腔穿刺可抽出不凝血[5,6]。 CT、MRI及超声检查常表现为肝占位及腹水。CT检查简便快捷,可快速明确病灶部位、大小及数量,初步评估出血量,可作为诊断首选[7]。 有学者[8]通过超声造影检查诊断肝癌破裂出血取得不错的效果。通过造影诊断肝癌的同时可见造影剂经破裂口向肝外呈“云雾状”移动。术中DSA造影也可诊断,出血量较大时DSA造影可见造影剂外溢征象(图5),大部分DSA造影只可见肿瘤染色。结合临床表现及影像学检查,肝癌破裂出血多可明确诊断。
肝癌破裂出血的治疗方案的选择原则[9]应根据患者生命体征、全身血流动力学、肿瘤大小数目及肝功能状态等因素而综合评定。出血量小生命体征平稳时可先行保守治疗,后再择期行手术治疗。急诊手术包括肝动脉栓塞术和外科切除术,两种治疗方法都能取得较好的疗效,但两种方法的选择存在一定的争议[10]。有研究表明急诊肝癌切除术是肝癌破裂出血患者在院死亡的独立高危因素[11]。TAE治疗与外科手术相比操作简便,创伤小,术后并发症少,止血效果明显,应作为肝癌破裂出血急诊止血的首选[12,13]。该组23例TAE技术成功率达100%,22例患者术后活动性出血停止,1例术后再次出血,再次成功行TAE术,术中及术后无严重并发症发生。
TAE治疗时注意事项:(1)超选择动脉造影,明确责任血管后栓塞,在不影响血流动力学情况下最大程度地保护正常肝组织,避免过度栓塞致肝功能衰竭。对于肝癌破裂出血合并门静脉癌栓大部分学者认为应根据血流情况而定[14,15]。门静脉癌栓导致门静脉部分阻塞可行TAE术;门静脉癌栓致门静脉主干梗阻伴侧枝建立,应采用超选择动脉栓塞技术;门静脉癌栓致门静脉主干梗阻无侧枝建立,应采用超选择动脉栓塞术,术后可行门静脉支架置入开通门静脉血流。如门静脉主干和分支弥漫性癌栓形成,TAE术后发生肝衰竭的风险较高,术前应充分告知患者家属。该组有4例合并门静脉血栓,门静脉主干血流通畅,予超选择肝动脉栓塞后未发生肝功能衰竭。(2)栓塞材料建议使用碘油加栓塞颗粒,如吸收性明胶海绵、PVA、Embosphere微球等。单纯碘油栓塞再出血概率明显高于碘油联合颗粒栓塞[16,17],考虑原因为碘油为液体栓塞剂,颗粒较小,在血管内形成血栓机化的时间较长,并易被血流冲刷引起血流再通。该组1例巨块型肝癌,术中只使用超液化碘油栓塞,术后再次出血,考虑与此原因有关。不建议使用弹簧圈和可脱球囊栓塞,影响肝癌的后续治疗。(3)不建议TAE的同时使用化疗药物。肝癌破裂出血患者肝功能多为CHILD B-C级,化疗药物可加重肝功能损害,严重可致肝功能衰竭。
该试验只是对ODN鼻腔温敏凝胶基质进行了筛选,相关加入药物以后,体内外相关性研究正在进行中。

