中山市4 370例新生儿耳聋基因筛查联合听力筛查结果分析*
张艳芳,谢丰华,李闪闪,钟裕恒,黄 湘
(南方医科大学附属中山市博爱医院产期诊断中心,广东中山 528403)
耳聋是指听觉系统中各转导通路及神经功能发生病变引起的听力功能障碍,对患者的工作、学习和生活产生明显影响[1]。流行病学调查结果显示,我国新生儿耳聋的发病率约为0.8%~1.0%,约80%的患儿除耳聋症状外不合并其他临床症状,此类为非综合征型耳聋[2]。近年来大量临床研究证实,基因突变是引起非综合征型耳聋的主要遗传因素,GJB2基因、SLC26A4基因、线粒体12S rRNA基因、GJB3基因是非综合征型耳聋的主要致聋基因[3-4]。现探讨中山市耳聋基因的携带情况及其与听力筛查的相关性,为新生儿听力筛查的方案选择和听力障碍的防治提供科学依据,分析中山市非综合征型耳聋新生儿常见耳聋基因突变状况及耳聋基因突变致病性的影响。
1 资料与方法
1.1一般资料 选取2015年11月至2017年10月该院分娩并做耳聋基因筛查的4 370例新生儿,男2 256例,女2 114例,年龄0~45 d。纳入标准:(1)孕周:38~41周,足月分娩。(2)出生时体质量≥2 500 g。(3)出生后3 min新生儿阿氏(Apgar)评分>8分。(4)未合并耳聋外其他临床症状。本研究获得该院伦理委员会批准,且患儿家属知情同意。
1.2仪器与试剂 基因扩增采用东胜ETC811 PCR仪,浓度和纯度检测使用博奥晶芯NanoQ微型分光光度计,芯片杂交采用CapitalBio BioMixerTMⅡ杂交仪,应用CapitalBio LuxScan-10K/B微阵列芯片扫描仪分析杂交结果。采用自动听性脑干反应(AABR)听力筛查仪完成新生儿听力学筛查。DNA提取试剂盒购自厦门致善生物全血提取试剂盒;遗传性耳聋基因初筛试剂盒购自北京博奥生物(晶芯九项,微阵列芯片法),筛查4个耳聋基因最常见的9个突变位点;基因初筛阳性标本送至北京博奥生物有限公司进行耳聋相关基因测序(毛细管电泳法)。
1.3方法
1.3.1听力学筛查 由中山市博爱医院儿保科或耳鼻喉科在新生儿出生2 d内进行。听力筛查双耳均通过记为“均通过”;左耳通过右耳未通过、左耳未通过右耳通过均记为“单侧通过”; 双耳均未通过记为“均未通过”;“单侧通过”“均未通过”者合记为“未通过”。对初筛“未通过”者在出生30~42 d内进行“复筛”。听力学筛查环境条件和标准均符合国家相关规定。
1.3.2耳聋基因的分子学筛查 本研究共检测4个基因9个位点,包括GJB2基因位点(35delG、176 del16、235 delC、299 delAT)、SLC26A4基因位点(2168A>G、IVS7-2A>G)、线粒体12S rRNA基因位点(1494C>T、1555A>G)、GJB3基因位点(538C>T),检测过程遵守试剂盒相关操作要求及国家关于分子实验室相关规定。具体操作:(1)DNA提取:采集新生儿脐带血2~3 mL EDTA抗凝,24 h内按照使用说明书步骤提取DNA。提取DNA浓度和纯度,4 ℃保存24 h内用于下游耳聋基因的筛查。(2)耳聋基因筛查:取适量已提取的DNA稀释至浓度为100~200 ng/μL ,纯度为OD 260/280=1.7~2.0,剩余标本―80 ℃保存。PCR扩增、杂交、芯片的洗涤、干燥、读片均依照晶芯九项遗传性耳聋基因检测试剂盒和相关仪器使用要求进行。
1.4耳聋相关基因突变确诊 耳聋相关基因测序分析(毛细管电泳法)。对初筛阳性或听筛未通过的新生儿根据突变基因和监护人意愿选择性进行耳聋相关基因的毛细管电泳法测序分析。
1.5统计学处理 采用SPSS 20.0统计软件进行数据分析,计数资料以例数、百分率表示,使用χ2检验和秩和转换的非参数检验,P<0.05为差异有统计学意义。
2 结 果
2.1新生儿脐血标本耳聋基因筛查结果 4 370例新生儿有159例检测到耳聋基因突变,检出率为3.64%(159/4 370),其中GJB2、SLC26A4、线粒体12S rRNA、GJB3基因突变检出率分别为2.29%、1.08%、0.21%、0.07%。男性检出率为4.03%(90/2 256),女性检出率3.26%(69/2 114),差异无统计学意义(P>0.05)。见表1。
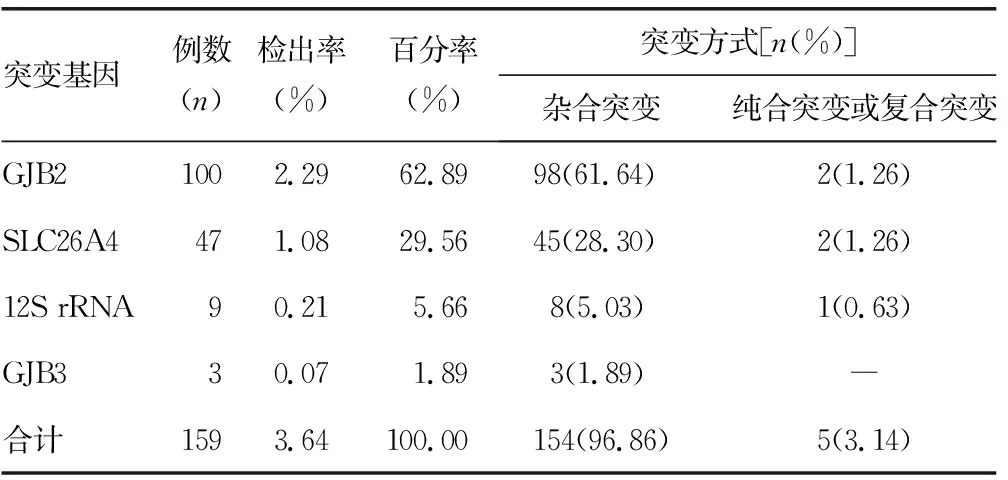
表1 159例新生儿耳聋基因筛查突变类型及百分率结果比较
注:-表示无数据
2.2非综合征型耳聋患儿耳聋基因突变
2.2.1非综合征型耳聋基因阳性患儿一般资料 159例非综合征型耳聋患儿男性占56.60%(90/159),女性43.30%(69/159),差异无统计学意义(P>0.05);初筛阳性患儿选择测序49例(30.82%,49/159),未测序110例(69.18%,110/159),测序和初筛结果符合率为98.00%(48/49)、不符率2.00%(1/49);159例均接受AABR,其中“均通过”率85.53%(136/159),“单侧通过”率6.92%(11/159),“均未通过”率7.55%(12/159),合并“未通过”率14.46%(23/159)。4例复合杂合突变或纯合突变,1例均质突变“均未通过”。
2.2.2非综合征型耳聋患儿耳聋基因突变筛查阳性结果 耳聋基因突变的GJB2、SLC26A4、线粒体12S rRNA、GJB3基因突变百分率依次为62.89%、29.56%、5.66%、1.89%。GJB2基因和SLC26A4基因为主要突变基因,其中GJB2基因突变患儿62.89%(100/159),主要突变位点为235delC,主要突变形式为杂合突变,复合杂合突变2例;SLC26A4基因突变患儿29.56%(47/159),主要突变位点为IVS7-2A>G,主要突变形式为杂合突变,纯合突变、2168A>G/IVS7-2A>G复合杂合突变各1例;线粒体12S rRNA基因突变5.66%(9/159),主要突变形式为均质突变,异质突变型1例。GJB3 538C>T杂合突变1.88%(3/159)。耳聋基因突变百分率差异有统计学意义(P<0.05)。见表2和图1。
2.2.3耳聋基因筛查突变阳性患儿的听力学筛查结果 159例耳聋基因初筛突变阳性患儿的听力学筛查结果显示,听力学筛查“均通过”“单侧通过”“均未通过”分别为85.53%(136/159)、6.92%(11/159)、7.55%(12/159),合并未通过为14.47%(23/159);GJB2基因突变患儿听力学筛查通过率为84.00%(84/100)、未通过率为16.00%(16/100);SLC26A4基因突变患儿通过率为87.23%(41/47)、未通过率为12.77%(6/47);线粒体12S rRNA基因突变患儿通过率为88.89%(8/9)、未通过率为11.11%(1/9)。3例GJB3基因突变患儿均通过。共18例杂合突变、1例IVS7-2纯合子突变、3例235delC/299delAT、35delG/235delC、2168A>G/IVS7-2A>G复合突变听力学筛查双耳均未通过。4个基因突变对听力的影响进行比较,差异无统计学意义(χ2=0.839,P=0.840)。见表2。
2.4耳聋相关基因测序分析(毛细管电泳法) 49例阳性筛查患儿的耳聋相关基因的毛细管电泳法测序结果和初筛结果符合率为98.00%(48/49),不符率为2.00%(1/49);不符1例是初筛为SLC26A4 2168A>G杂合突变而测序未检出突变,其余测序结果均和初筛芯片检测覆盖基因位点的检测结果相符合。但耳聋基因测序检出初筛未覆盖的位点14例,其中位点109G>A异常4例,79G>A、341A>G、299-300deIAT异常各2例,608A>G、608T>C、426A>T、176-191deI16异常各1例, 109G>A、341A>G、299-300deIAT位点异常共4例,为听力学筛查“未通过”。共5例耳聋基因筛查突变阳性且“未通过”听力学筛查的患儿选择耳聋相关基因测序确诊,测序证实2例GJB2 235delC为235delC复合109G>A突变,2例GJB2 235delC和1例SLC26A4 IVS7-2杂合突变与初筛结果一致。见表3。

表2 159例新生儿耳聋基因初筛突变的听力学筛查结果
注:―表示无数据

注:1表示235delC/299delAT双重杂合突变;2表示235delC杂合突变;3表示235delC纯和突变
图1 筛查阳性芯片扫描示意图
注:―表示无数据
3 讨 论
本研究对中山市4 370例新生儿进行耳聋基因筛查表明,耳聋基因突变检出率为3.64%(159/4 370),与湖北市(实时荧光定量PCR法)和佛山市[基质辅助激光解吸附/电离飞行时间质谱法(MALDI-TOF MS)]报道的一致[5-6];低于石家庄(实时荧光定量PCR法)和2016年中山市(微阵列芯片法)对906例新生儿进行耳聋基因筛查的检出突变率[7-8];高于武汉市(实时荧光定量PCR法)检出的3.00%突变率。本研究结果显示,GJB2、SLC26A4、线粒体12S rRNA、GJB3基因突变检出率分别为2.29%、1.08%、0.21%、0.07%,基因突变百分率依次为62.89%、29.56%、5.66%、1.89%,与佛山市的结果一致,与中山市2016年的906例新生儿结果有差异。比较中山市与湖北、合肥(微阵列芯片法)、深圳(MALDI-TOF MS )、广州(微阵列芯片法)、石家庄、中国西北地区(耳聋相关基因测序法)等地的筛查结果,差异有统计学意义(P<0.05)[9-10]。提示各个地区、单个地区不同时期扩大研究样本数后检出率、基因构成百分率存在差异,各个地区建立合适的研究模型、定期更新分析该地区的耳聋基因谱有助于为当地临床开展非综合征型耳聋的相关诊疗活动提供指导和支持。
本研究对耳聋基因筛查阳性的159例患儿进行听力学筛查,结果显示双耳均通过率为85.53%、未通过率为14.47%,与湖南的研究结果一致;高于武汉市耳聋基因突变患儿的听力学筛查未通过率(8.75%)。听力学筛查通过率为未通过率的6倍,其中SLC26A4(PDS)、线粒体12S rRNA基因突变患儿的听力学通过率为87.50%(49/56),表明仅从听力学筛查对耳聋基因突变患儿的早期防治不准确,而耳聋基因筛查能及早发现突变患儿,及时采取指导和预防治疗措施减少患儿听力损失。对各个基因的既往研究报道,SLC26A4(PDS)基因突变主要与大前庭导水管综合征有关,使大前庭导水管或内淋巴囊扩大,患儿头部碰撞和感冒等颅内压变化引起听力下降[11];线粒体12S rRNA基因为母系遗传,主要与氨基糖苷类药物性耳聋有关,低剂量的氨基糖苷类药物即可引起严重的听力减退。对SLC26A4(PDS)、线粒体12S rRNA基因突变患儿做好指导和防护,减少外界因素所致的患儿耳聋加重,发药物性卡片提醒患儿及母系家庭成员终生禁止服用氨基糖苷类药物,可避免患儿成长中因未进行耳聋基因筛查造成漏诊而未采取防护措施导致的一针致聋及耳聋加重。GJB2基因为隐性遗传,与重度、极重度感音神经性耳聋有关,发病年龄主要在婴、幼儿期,随发病年龄的增大,听力损失比例下降;GJB3为常染色体显性和隐性遗传,与后天高频感音神经性耳聋有关。本研究GJB3基因突变患儿听力学筛查通过率为100.00%(3/3),对GJB3突变患儿定期检查,注意高频听力损失可减少后天耳聋或耳聋加重[12]。本研究GJB2基因突变患儿的听力学筛查通过率为84.00 %(84/100),患儿早期使用助听器和电子耳蜗植入治疗,可减少患儿成长过程中因发现较晚导致的不可挽回的耳聋加重。
筛查阳性测序和初筛符合率为98.00%。1例初筛阳性而测序未发现突变患儿提示本研究耳聋基因初筛实验方法存在假阳性;其余48例测序结果均包括初筛阳性检出位点,共14例测序检测到阳性突变而初筛未覆盖的耳聋基因位点,其中109G>A、341A>G、299-300deIAT共4例为听力学筛查“未通过”,其他地区如北京、深圳、广东、天津、石家庄、广西、宁夏等地开展耳聋基因筛查研究覆盖位点较多,包括299-300delAT检测位点,但无109G>A、341A>G基因突变初筛位点报道。除本研究外,中国西北地区也报道耳聋基因测序发现109G>A、341A>G、299-300deIAT阳性病例[13]。结合本研究耳聋基因初筛位点的局限性和筛查阳性的测序结果,提示可将109G>A、341A>G、299-300deIAT纳入中山市新生儿耳聋基因筛查位点,以提高耳聋基因初筛的敏感性。因本研究该类阳性例数较少,有待于进一步扩大研究证实该位点的突变对听力损失的影响。
综上所述,中山市耳聋基因检出率处于全国耳聋基因检出率中等水平,对比各地耳聋基因突变检出率和构成百分率,表明进行该地区耳聋基因筛查结果可指导临床合理使用耳聋基因筛查,对各个基因突变患儿采取相应的指导和防护措施,可有效避免耳聋及耳聋加重。本研究测序和筛查结果显示初筛准确率高,可早期筛查携带耳聋基因患儿,为临床早期发现、早期诊断、早期治疗非综合征型耳聋提供参考依据和医学咨询,减少耳聋的发生及加重,提高患儿的社会适应能力和生活质量。

