荧光/表面增强拉曼散射双模式纳米光学探针的构建及性能研究
宿 健, 张谷令, 彭洪尚*
(1. 中央民族大学 生命与环境科学学院, 北京 100081; 2. 中央民族大学 理学院, 北京 100081)
1 引 言
随着纳米复合材料的不断发展,整合多种分析方式的多模式纳米探针越来越多地应用于生物成像与传感等领域。荧光分析法是一种众所周知的分析检测方法,由于其具有高灵敏度、良好的选择性和非侵入性等优点,在生物医学领域得到了广泛应用。但目前大部分荧光有机染料具有较宽的发射谱,且易发生光学漂白,所以需要发展更加灵敏且稳定的探针。表面增强拉曼光谱(SERS)是一种能够反映分子特征结构的分子振动光谱,它具有指纹分析特征、较好的光稳定性、谱线带宽较窄、受生物样品自身荧光及水的干扰小和无损伤的定性定量分析等优点,在细胞领域的研究及应用发展迅速。但是单一的SERS检测存在一定不足,在实际检测过程中难以及时地聚焦定位检测分子,从而会影响检测效率。若将荧光与SERS信号整合到同一纳米粒子上,使该粒子同时具有荧光和SERS成像能力,便可首先通过荧光信号进行快速定位和成像,再用SERS技术进行多目标跟踪和定量研究,从而能够有效解决荧光和SERS成像技术存在的问题。
近年来,基于荧光与表面增强拉曼散射技术的双模式纳米探针在生物医学领域得到广泛关注,研究者们提出了多种双模式纳米颗粒的制备方案。崔一平等[1-4]利用金核银壳纳米棒作为SERS增强基底,表面连接拉曼分子,然后通过二氧化硅对其进行包覆,再通过在二氧化硅壳层连接量子点作为荧光源,即合成双模式探针,并将其成功用于免疫检测。另一种常用的制备方法是首先在金纳米棒或纳米球聚集体表面连接拉曼分子,然后表面吸附荧光物质以形成双模式纳米颗粒,其可用于标定癌细胞和免疫检测。Kim等[5]和Yu等[6]制备了以二氧化硅包覆银纳米颗粒作为拉曼增强基底的纳米探针,其表面吸附拉曼分子及荧光分子,可用于分子识别和生物传感。这些双模式探针制作过程较为繁琐复杂,且荧光信号源(有机荧光分子或量子点)均吸附在纳米颗粒表面,易受溶剂及杂质等影响发生猝灭。Lee[7]通过共沉淀法制备二氧化硅纳米颗粒,并在二氧化硅表面修饰银纳米颗粒,然后依次连接拉曼分子与荧光分子以制备双模式纳米探针。Kim等[8]通过油包水型微乳液法将染料分子嵌入二氧化硅微球中,然后通过化学镀层法在二氧化硅表面包覆活性银,再修饰拉曼分子形成双探针传感器,其中掺杂的染料荧光信号可用于分子识别的快速显现系统,SERS信号则用于显示特定分子相互作用的信号。该双模式探针通过二氧化硅包覆荧光染料分子,使荧光分子与外界环境隔离开来,可有效地避免溶剂及杂质的猝灭影响。但该双模式探针制作过程极其复杂,且整个实验过程均在有机溶剂中进行,会产生一定的生物毒性,因此对纳米探针应用于细胞及生物组织存在一定的影响。
本文提出了一种新型的具有荧光及SERS双模式的复合纳米粒子制备方法,首先采用再沉淀法制备二氧化硅包覆香豆素6的纳米颗粒,其表面静电吸附多聚赖氨酸分子(PLL),然后通过PLL表面氨基对银离子的络合作用,将银纳米颗粒原位固定在PLL表面,最后在银纳米颗粒表面吸附拉曼分子即合成双模式纳米探针。该探针以染料有机分子作为荧光信号源,以PLL表面的银纳米颗粒作为SERS增强基底,通过拉曼活性分子提供SERS信号。二氧化硅层可有效防止荧光分子受外部银纳米颗粒猝灭影响,PLL分子层不仅能够给银纳米颗粒提供附着点,还能够提高纳米颗粒的生物相容性。通过不同激发光照射该探针粒子,纳米探针分别产生较强的荧光信号和高信噪比的SERS信号。
2 实 验
以罗丹明6G(R6G)为拉曼分子的探针制备过程及信号产生过程如图 1 所示。
2.1 材料与仪器
香豆素 6(C6)、聚苯乙烯(PS)、多聚赖氨酸(PLL,MW 3w-7w)、十二烷基三甲氧基硅烷(DTS)、四氢呋喃(THF)、罗丹明6G(R6G)、罗丹明B(RhB)、4,4-联吡啶(4,4′-Bipyridine)、硝酸银(AgNO3)均购自Sigma-Aldrich。抗坏血酸(AA)和氨水购自国药集团化学试剂有限公司。全部试剂均购买后直接使用,实验过程中均使用18 MΩ/cm去离子水。
实验过程中纳米颗粒的发射光谱由日本日立公司生产的型号为F-4500的光谱仪测得;样品的消光光谱由日本分光株式会社生产的型号为V-550 的紫外分光光度计测得;样品的透射电子显微镜成像由日立公司生产型号为 JEM 1400EX的透射电子显微镜测得;实验中利用马尔文公司生产的型号为 Nano ZS90的激光粒度仪对纳米颗粒的动态光散射粒径进行表征;利用LabRAM HR800显微共聚焦激光拉曼光谱仪表征SERS信号(激发光为632.8 nm,曝光时间为10 s)。

图1 双模式光学探针制备过程示意图
2.2 样品制备方法与步骤
2.2.1 PLL包覆荧光纳米探针的制备
PLL包覆荧光纳米探针的制备方法是改进的再沉淀-包覆法[9-10],首先配置溶解于THF中的C6(400×10-6)、PS(2 000×10-6)和DTS(2 000×10-6)溶液,然后按照质量比3∶47∶50进行混合,最终混合溶液浓度为200×10-6,随后取0.5 mL混合液在超声震荡条件下迅速注入到 pH 值为9的含有0.02 mg/mL PLL的去离子水中,由此产生的悬浮液静置 2 h后,将其在去离子水中透析24 h以除去有机溶剂,即得到PLL包覆的荧光纳米探针(C6@PLL NPs)。
2.2.2 银纳米颗粒包覆的荧光纳米探针的制备
将1 mL 浓度为1 mol/L 硝酸银溶液在剧烈搅拌条件下加入8 mL PLL包覆的荧光纳米颗粒(C6@PLL NPs)溶液中,待其混合均匀后静置于50 ℃水浴环境中6 h,随后用去离子水透析溶液,去除未被PLL还原的银离子,即得到表面吸附小颗粒银的纳米颗粒(C6@PLL@Ag NPs)。然后取0.1 mL浓度为0.02 mol/L的 AA在搅拌环境下逐渐滴入透析后的纳米颗粒中,振荡反应12 h,PLL表面的小颗粒银进行二次生长,再对上述溶液进行透析以去除未反应的AA,即得到银纳米颗粒包覆的荧光纳米探针溶液(C6@PLL@Ag(AA) NPs)。
2.2.3 银纳米颗粒吸附拉曼分子
取8 mL C6@PLL@Ag(AA)溶液进行高速离心30 min(10 000 r/min),然后将沉淀分散至2 mL去离子水,随后与浓度为10-5mol/L的拉曼分子溶液按体积比9∶1进行混合,室温下震荡12 h后,将该溶液滴在硅片上,待溶剂蒸发后置于拉曼光谱仪样品台上进行测试。
3 结果与讨论
3.1 双模式光学探针的表征
双模式纳米探针的结构如图1所示,其中荧光分子香豆素6(C6)随机地掺杂于纳米颗粒核心,PS和DTS作为核心基质材料,DTS遇水水解成二氧化硅,进而对核心进行包覆形成二氧化硅壳层,二氧化硅带负电性,吸附带正电的多聚赖氨酸分子形成PLL包覆的纳米颗粒。然后通过原位还原方法在纳米颗粒表面生长银纳米粒子,多聚赖氨酸表面的氨基将电子转移给吸附的银离子,银离子还原成银原子并成核,进而形成小颗粒纳米银[11-13],之后通过AA还原PLL吸附的大量银离子,以小颗粒纳米银为种子,继续在PLL表面生长成为大粒径的银纳米颗粒。
PLL包覆荧光纳米探针(C6@PLL NPs)的形貌通过透射电子显微镜照片(TEM)进行表征,如图2(a)所示,纳米颗粒呈球形,表面光滑,颗粒分散性较好,右上角插图中的动态光散射表征结果显示纳米颗粒水合粒径平均值在190 nm左右。图2(b)是C6@PLL@Ag NPs的TEM成像,可以发现纳米颗粒表面生成大量粒径极小的银纳米颗粒,粒径大约为5 nm左右,这是由于多聚赖氨酸将银离子原位还原为银纳米颗粒,插图中动态光散射水合粒径大约为180 nm左右,略小于C6@PLL NPs粒径,猜测可能是由于表面生成的银颗粒对疏松的PLL层产生压缩作用。图2(c)为C6@PLL@Ag(AA) NPs透射电子显微镜成像图,从图中可以看出PLL表面银纳米颗粒进一步生长,颗粒粒径达到50 nm左右,部分银颗粒发生聚集,易于产生SERS热点[14-16],进而能够极大地增强其表面吸附分子的拉曼信号,所以C6@PLL@Ag(AA) NPs中的银纳米颗粒可用于SERS基底。图3为C6@PLL NPs、C6@PLL@Ag NPs和C6@PLL@Ag(AA) NPs的消光光谱。C6@PLL NPs 位于430~470 nm左右的宽消光峰为荧光分子C6的特征峰[17-18]。C6@PLL@Ag NPs的消光光谱位于400~500 nm左右,略高于C6@PLL NPs,因为PLL表面的小颗粒银存在表面等离子体共振吸收[19-20]。而C6@PLL@Ag(AA) Nps在420 nm处存在较高消光峰[21-24],为其表面大颗粒银的特征消光峰。消光光谱进一步证明荧光纳米探针表面复合尺寸较大的银纳米颗粒。
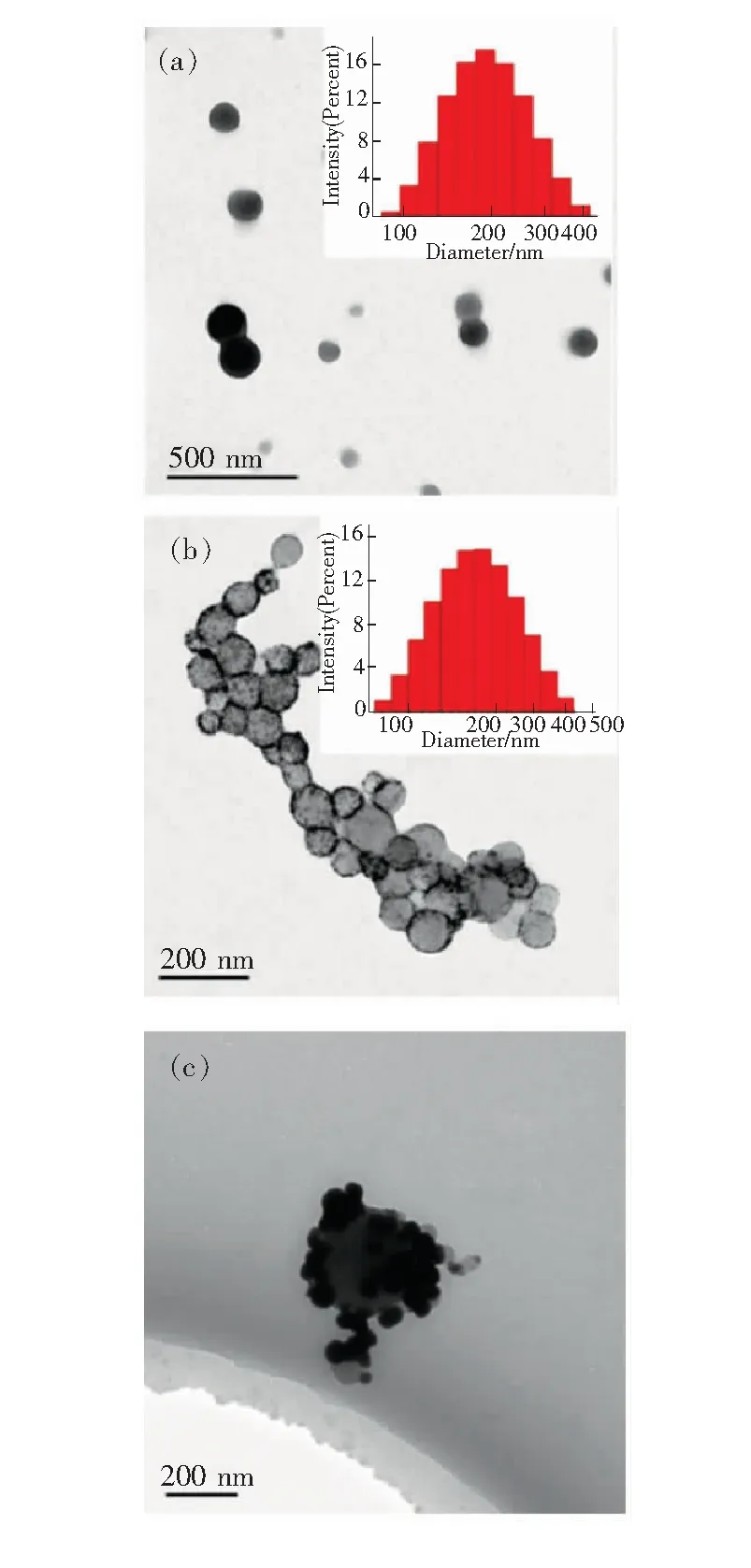
图2 双模式纳米探针制备过程中的TEM图像。(a)C6@PLL;(b)C6@PLL@Ag NPs(50 ℃下加入硝酸银溶液6 h后);(c)C6@PLL@Ag(AA)NPs (加入AA后) 。
Fig.2 TEM image of the process preparing the dual modenanoprobe. (a)C6@PLL NPs. (b)C6@PLL@Ag NPs(reacting 6 h in 50 ℃ after adding AgNO3). (c)C6@PLL@Ag(AA)NPs(after adding AA).

图3 C6@PLL NPs、C6@PLL@Ag NPs和C6@PLL@Ag(AA) NPs的消光光谱。
Fig.3 Extinction spectra of C6@PLL NPs, C6@PLL@Ag NPs and C6@PLL@Ag(AA) NPs.
3.2 双模式纳米探针的SERS及荧光特性
由于适量银纳米颗粒聚集能够产生SERS增强作用,所以我们利用吸附在PLL表面的聚集银纳米颗粒作为SERS基底,相比传统的氯离子诱导产生的聚集[25-26],本结构更容易控制且不易产生沉降作用。为证明该双模式探针的广泛适用性,我们选用同样浓度的罗丹明6G(R6G)、罗丹明B(RhB)和4,4-联吡啶(4,4′-Bipyridine)在相同条件下进行SERS测试。图4为拉曼分子R6G分别吸附在C6@PLL NPs和C6@PLL@Ag(AA)NPs上的SERS光谱(其中插图为R6G的分子结构式),图中可以看出在613,774,1 187,1 313,1 364,1 511,1 650 cm-1处观察到了R6G的拉曼峰。613 cm-1处峰对应C—C—C环面内弯曲振动;774 cm-1处峰对应C—H面外弯曲振动;1 187 cm-1处峰对应C—H面内弯曲振动和C—C伸缩振动,1 313 cm-1处峰为C—C伸缩振动和C—N伸缩振动共同产生,1 364,1 511,1 650 cm-1处峰由C—C伸缩振动产生[27-30]。相比于C6@PLL NPs,R6G吸附于C6@PLL@Ag(AA)NPs后产生明显的SERS信号,SERS活性增强明显。
此外,我们将罗丹明B和4,4-联吡啶分别吸附于C6@PLL@Ag(AA)NPs表面,并进行SERS光谱表征(图5),其中插图分别为其分子结构式。吸附RhB后,SERS光谱中620 cm-1处峰为芳香族环的弯曲振动;1 200 cm-1处峰对应C—H面内弯曲振动;1 280 cm-1处峰对应C—C桥带伸缩振动;1 510,1 359,1 531,1 649 cm-1处峰由芳香族环伸缩振动产生[31-33]。吸附4,4-联吡啶后,SERS光谱中1 018 cm-1处峰对应全对称环呼吸振动峰;1 295 cm-1处为两个吡啶环之间的碳碳伸缩振动峰;1 611 cm-1处为吡啶环伸缩振动峰[34-35]。
双模式探针的荧光性能通过荧光光谱进行表征,如图6所示,在450 nm波长激发下,香豆素6产生位于490 nm左右的发射峰,即为纳米探针的荧光信号。由于二氧化硅层能够有效隔绝香豆素6与表面金属银以及溶剂的接触,所以可以避免荧光分子非辐射跃迁导致的能量损失,从而避免荧光猝灭,实现双模式检测。从图4和图5可以看出,当用632.8 nm的光激发样品时,能够得到强烈的SERS信号;同时从图6中看出,当用450 nm的光激发样品时,能够得到较强的荧光信号。这表明双模式探针的荧光和SERS信号能够通过选择不同激发光波长分别产生,从而避免相互影响,进而提高检测的准确性。
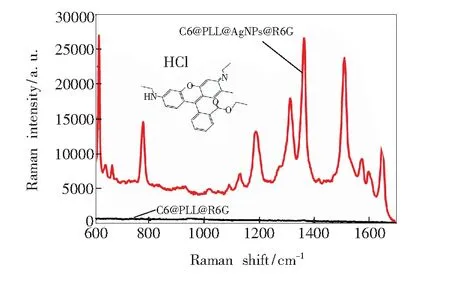
图4 R6G吸附在C6@PLL上的SERS光谱及双模式纳米探针中R6G的SERS光谱
Fig.4 SERS spectra obtained from R6G tagged C6@PLL and dual mode nanoprobes

图5 双模式纳米探针中RhB和4,4-联吡啶的SERS光谱
Fig.5 SERS spectra obtained from dual mode nanoprobes of RhB and 4,4′-Bipyridine

图6 双模式纳米探针的荧光光谱
4 结 论
本文通过简单易制的方法制备了一种具有荧光及表面增强拉曼信号的双模式纳米探针,该探针具有核壳型结构,在二氧化硅包覆的核心部分掺杂C6分子,以产生荧光信号,二氧化硅表层吸附具有良好生物相容性的多聚赖氨酸分子(PLL),然后在PLL表面复合银纳米颗粒形成SERS信号的基底,最后通过吸附拉曼分子获得SERS信号。该探针通过450 nm光激发产生荧光信号,并通过632.8 nm光激发产生SERS信号。这种具有高信噪比光学信号的双模式纳米探针在多模态探针领域具有广阔的应用前景。

