基于柑橘浓缩汁的醋杆菌与酵母发酵特征
付彩霞,余红波,邹涛,陈雄,陈世贵,李欣,*
(1.发酵工程教育部重点实验室,湖北省工业发酵协同创新中心,工业微生物湖北省重点实验室,湖北工业大学,湖北武汉430068;2.湖北土老憨调味食品股份有限公司,湖北宜都443302)
我国是柑橘生产大国,柑橘产量和种植面积均是世界第一[1]。然而,柑橘在我国主要是以鲜果的形式进行销售[2]。大量柑橘集中上市,一方面导致卖柑难和价格波动大,另一面未售出的柑橘腐烂后导致严重的资源损失。这种局面的形成主要是由于我国柑橘加工利用途径狭窄且加工能力薄弱。当前,柑橘果汁、柑橘罐头和柑橘发酵果醋是3种主要的柑橘加工产品[3-4]。橘片罐头是我国柑橘加工一个非常重要的项目,其加工量占柑橘加工的80%以上,但产品科技附加值低。柑橘果醋酸度过强导致口感不佳,还未被消费者广泛接受。可见,开拓柑橘加工利用新途径,研制新型柑橘发酵饮料,对于多渠道消化果品和调节丰缺,增加柑橘资源利用率,延长产业链,提升柑橘产业科技含量,都有积极的意义。由于柑橘自身的含糖量偏低,不足以支撑微生物发酵对碳源的需求。因此,本项目以柑橘浓缩汁为唯一发酵组份,利用鲁氏酵母菌的糖醇转化及其生香特性,并结合醋酸菌的醇酸转化能力,考察单一或混合葡糖醋杆菌和酵母菌的发酵特征,为进一步开发酸甜醇协调匹配的柑橘发酵饮料提供理论指导和支持。
1 材料与方法
1.1 原料、菌株、培养基与试剂
柑橘:湖北土老憨调味食品股份有限公司提供的产自湖北省宜都市新鲜蜜柑。
葡糖醋杆菌(Gluconacetobacter)TLH菌株:湖北土老憨调味食品股份有限公司;鲁氏酵母(Zygosaccharomyces rouxii)菌株:功能酵母与酿造微生物实验室从民间传统酿造食品中分离纯化获得,其菌株保藏号为CCTCC M 2013310。
酵母种子制备培养基(yeast extract peptone dextrose medium,YEPD):酵母粉 10 g,蛋白胨 20 g,葡萄糖 20 g,蒸馏水 1 000 mL,pH 6.0,115 ℃灭菌 20 min。
醋酸菌种子制备培养基(luria-bertani medium,LB):蛋白胨 10 g,酵母粉 5 g,氯化钠 10 g,蒸馏水1 000 mL,pH7.2~pH7.4,121 ℃灭菌 20 min。
发酵培养基:纯柑橘浓缩液(还原糖浓度105.25 mg/mL,总糖浓度213.84 mg/mL),自然pH值,115℃灭菌15 min。
3,5-二硝基水杨酸 (3,5-dinitrosalicylic acid,DNS)(分析纯)、葡萄糖(分析纯)、胰蛋白胨(分析纯)、蛋白胨(分析纯)、无水乙醇(分析纯)、蒽酮(分析纯)、甲醇(色谱级):国药集团化学试剂有限公司;酵母粉(优级纯):安琪酵母股份有限公司;琼脂粉(分析纯):武汉市华顺生物技术有限公司;硫酸(优级纯):信阳市化学试剂厂。
1.2 仪器与设备
CJ-1D超净工作台:天津市泰斯特仪器有限公司;AMR612均质机:中国安蜜尔电器实业有限公司;BL-75A高压灭菌锅:上海博迅实业有限公司;PL2002电子天平:赛多利斯天平有限公司;WFJ 2000可见分光光度计:尤尼柯(上海)仪器有限公司;5804R型离心机:德国Eppendorf公司;CT15RE离心机:日本日立公司;SBA生物传感仪:山东省科学院生物研究所;ZHWY-2102C恒温培养振荡器:上海智城分析仪器制造有限公司。PURELAB Prima超纯水仪:英国ELGA公司;7890B气相色谱仪:美国安捷伦公司。
1.3 方法
1.3.1 柑橘浓缩汁的制备
新鲜宜昌蜜柑去皮后,将柑橘肉放入已用75%医用酒精处理的榨汁机中破碎,再在10 000 r/min、10℃下离心10 min,收集上清。将柑橘肉汁液加热至轻微沸腾,并适当搅拌,至液体体积减少至原体积的三分之一后,静置冷却至室温。将柑橘浓缩汁于-20℃保存以备用。保存时间不超过1个月。
1.3.2 微生物的活化
分别将斜面保存的葡糖醋杆菌和鲁氏酵母菌置于LB和YEPD培养基中,在200 r/min、30℃条件下振荡培养18 h,以用于发酵。
1.3.3 发酵策略
依据接种的微生物种类、比例和设置的溶氧环境,共设置了12组发酵策略,如表1。

表1 本研究中使用的发酵策略Table 1 Fermentation strategies in this research
在已灭菌的柑橘肉汁培养基中,按照3%的总接种量加入已活化的葡糖醋杆菌或/和酵母菌。取1.5、0.5、1.0 mL葡糖醋杆菌或酵母菌种子活化液于已灭菌的2 mL离心管中,8 000 r/min、4℃条件下离心5 min,收集菌泥,并用等体积的已灭菌柑橘肉汁培养基重悬,再全部转入发酵培养基中。250 mL三角瓶装50 mL柑橘肉汁培养基。所有策略下的发酵温度均为30℃。取样间隔时间由发酵初始(24 h内)糖耗速率确定。发酵液样品随取随测,如当时无法检测,发酵样品置于-20℃冰箱中保存,但不超过24 h。
1.3.4 参数检测
取2 mL发酵液于10 000 r/min离心10 min,取上清液,稀释适当倍数后,用于测定总糖、还原糖、乙醇和代谢产物。620 nm(总糖)或540 nm(还原糖)波长下的吸光值。
发酵样品中的还原糖采用3,5-二硝基水杨酸(3,5-Dinitrosalicylic acid,DNS)法检测[5]。对应的葡萄糖标准曲线的标准直线方程为y=321.99x+16.99(x为吸光值,y为糖浓度),R2值为0.999。总糖采用硫酸蒽酮法测定[6]。对应的总糖标准曲线方程为y=194.67x-9.987 8(x为吸光值,y为糖浓度),R2值为 0.990 9。
发酵样品中的乙醇使用SBA生物分析传感仪检测[7]。
代谢产物采用带有FID检测器的安捷伦7890B气相色谱仪检测。色谱柱为HA-INNOWax毛细管柱(30 m×0.53 mm×1 μm)。在 0.1 mL发酵液上清中加入0.2 mL去离子水,再加入0.9 mL甲醇(色谱级),10 000 r/min、4℃离心10 min,取上清过0.22 μm滤膜。取 550 μL滤液,加入 400 μL 0.04%叔戊醇(内标)和50 μL甲酸。混合液用于气相色谱分析。参数:分流比10∶1;流速5 mL/min;进样口温度250℃;检测器温度280℃。升温程序:40℃保留5 min,以20℃/min升到120℃,再以min/10℃升到220℃,并保留3 min。
1.3.5 数据处理
所有试验设置3个平行。通过Excel计算平均值,并采用Origin 8.6软件对发酵数据作图。
2 结果与分析
2.1 单一微生物发酵过程
2.1.1 单一醋酸菌
醋酸菌被广泛应用于果醋等发酵过程中,是一类重要的食品微生物[8]。图1显示了葡糖醋杆菌TLH在柑橘浓缩汁中发酵时的总糖(图1A)、还原糖(图1B)和乙酸(图1C)的变化过程。

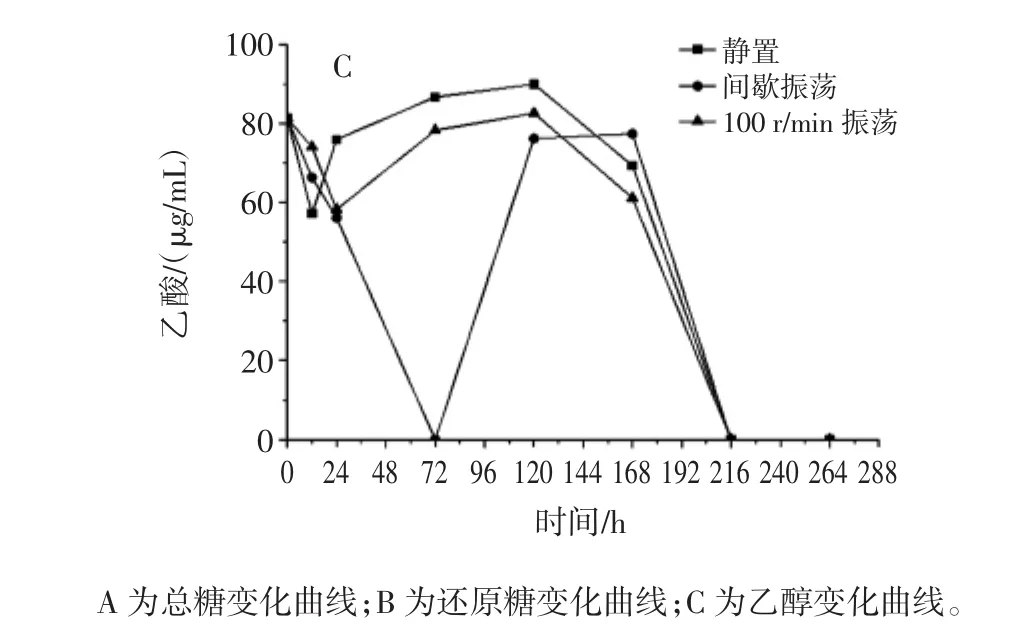
图1 接种葡糖醋杆菌TLH的柑橘浓缩汁的发酵过程Fig.1 The change of the total sugar,reducing sugar and acetate during fermentation period when Gluconacetobacter TLH was added in citrus juice concentrate
整体上,葡糖醋杆菌对糖的利用缓慢,无论是总糖还是还原糖,在发酵72小时后才开始被消耗。到发酵第120小时,总糖和还原糖的变化出现差异。总糖开始持续积累,而还原糖则呈现消耗-积累-再消耗的模式。发酵结束时,3种控氧模式下的残留还原糖差异不大,分布在77.41 mg/mL~88.07 mg/mL之间,但总糖浓度差异明显。间歇振荡模式下所积累的总糖最高,为496.22 mg/mL,而静置发酵模式下的浓度为292.31 mg/mL。静置模式和100 r/min振荡模式具有相似的乙酸变化过程,均在发酵早期(24 h~48 h内)减少,后缓慢积累,但从第120小时开始持续消耗,至第216小时消耗完。然而,在间歇振荡模式下,乙酸在发酵前72小时被持续消耗完,但随后的48 h大量积累,但最终依然会被消耗完全。可见,葡糖醋杆菌既利用了柑橘浓缩汁中的糖类物质,也利用了乙酸,但也会残留大量的糖,而且葡糖醋杆菌先利用糖再利用乙酸。
2.1.2 单一酵母菌
酵母是目前世界应用最广泛的一种微生物,酿造用酵母最大特点是能将糖转化为乙醇,是酒精类饮料和食品的重要成分[9]。当鲁氏酵母添加到浓缩柑橘汁中后,3种发酵模式下的总糖(图2A)、还原糖(图2B)、乙醇(图2C)和乙酸(图2D)的变化过程图2所示。


图2 接种鲁氏酵母CCTCC M 2013310的柑橘浓缩汁的发酵过程Fig.2 The change of the total sugar,reducing sugar,ethanol and acetate during fermentation period when Z.rouxii CCTCC M 2013310 was added in citrus juice concentrate
无论是何种溶氧水平,还原糖在发酵终点几乎都被消耗完,且溶氧水平越高,还原糖消耗的越快。与还原糖不同,总糖主要在发酵第24小时~72小时期间被消耗,此后,总糖浓度变化缓慢,至发酵终点时总糖还有一些残留。3种溶氧控制策略下,乙醇在发酵前120小时持续积累,最大积累浓度分别为65.00 g/L(168 h,静置模式)、55.00 g/L(120 h,间歇振荡模式)和 56.00 g/L(120 h,100 r/min振荡模式),随后被消耗。在发酵终点,乙醇浓度分别为21.00 g/L(静置)、20.00 g/L(间歇振荡)和15.00 g/L(100 r/min振荡)。乙酸在不同的溶氧策略下显示明显的差异。静置和持续振荡模式下,柑桔浓缩汁中的乙酸在72 h内消耗完全,但在随后的发酵过程中,静置模式下的乙酸会有一个积累-消耗的过程,而持续振荡模式下的乙酸一直维持在0。间歇振荡模式下,乙酸在发酵初期(0~24 h)就表现出一个消耗-积累的过程,随后在第120小时被消耗完全,至发酵结束。总体上,鲁氏酵母首先利用浓缩柑橘汁中的糖源生产乙醇,当糖源消耗到一定程度后,鲁氏酵母重新利用乙醇。在发酵的前期和中期,乙酸与糖的利用具有一定的同步性。此外,不同的溶氧控制模式对鲁氏酵母利用柑橘浓缩汁中总糖和还原糖以及代谢乙醇的影响并不大,但会明显对乙酸的代谢产生影响。
2.2 混合微生物共酵过程
当把葡糖醋杆菌和鲁氏酵母按照不同比例混合发酵柑橘浓缩汁后,发酵过程如图3所示。

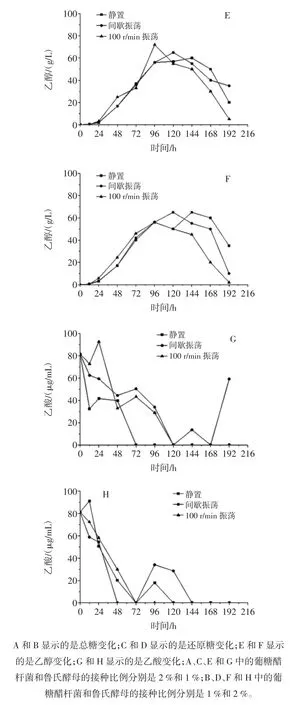
图3 葡糖醋杆菌与鲁氏酵母在柑橘浓缩汁中的共酵发酵过程Fig.3 The change of the total sugar,reducing sugar and ethanol during fermentation period when Gluconacetobacter TLH and Z.rouxii CCTCC M 2013310 was added in citrus juice concentrate
在2∶1(醋酸菌∶鲁氏酵母)的接种比例条件下,柑橘浓缩汁中的总糖(图3A)在3种溶氧控制模式下发酵24 h后均呈现下降过程,且持续振荡模式下的总糖消耗更快,但在发酵结束时残留浓度均在40 mg/mL左右。当增加鲁氏酵母且同时降低葡糖醋杆菌的接种比例后,虽然3种溶氧控制模式下的总糖最终残留浓度均在(35.00±3.00)mg/mL范围,但是静置模式和间歇振荡模式的总糖变化过程与持续振荡模式的差异更明显。柑橘浓缩汁中的还原糖(图3C和图3D)也呈现出与总糖相似的变化趋势,且在发酵结束前所有模式下的还原糖均被完全消耗。总体而言,间断性改善溶氧对混合发酵的总糖和还原糖影响不大,而持续性供氧将显著加快总糖和还原糖的代谢速度。
在这两种接种量条件下,柑橘浓缩汁中的乙醇(图3E和图3F)变化均展现为发酵前期积累-中期短暂稳定-后期消耗的过程。同时,在这两种条件下均显示出过高的溶氧水平并不利于一定程度乙醇在柑橘浓缩汁中的残留。而且,增加鲁氏酵母菌浓度后,发酵终点的乙醇最大浓度从间歇振荡模式(图3E,35.00 g/L)转变为静置模式(图3F,35.00 g/L)。这表明发酵终点的乙醇浓度受到酵母菌浓度和溶氧水平的双重控制。在以葡糖醋杆菌为主体的柑橘浓缩汁中(图3G),乙酸在发酵中期就被完全消耗,但在间歇振荡模式下,乙酸在发酵后期还会出现积累过程,特别是在发酵结束的前24小时内,而其它两种溶氧控制模式下的乙酸浓度一直维持在零。当提高酵母的添加量而减少葡糖醋杆菌的浓度后(图3H),柑橘浓缩汁中的乙酸被消耗的更快,3种溶氧水平下的乙酸浓度不超过72 h就变为零。但是,在静置模式和间歇振荡模式下,乙酸会重新积累并再被消耗。这个过程在静置模式下持续48 h,而在间歇振荡模式下持续72 h,最大积累浓度分别依次为 17.95 g/L(静置,96 h)和 34.10 g/L(间歇振荡,96 h)。
可见,接种量的变化和溶氧水平的差异不会对柑橘浓缩汁中的总糖和还原糖的最终残留浓度产生影响,但明显提升溶氧水平将加快糖的消耗。然而,糖耗速率的提升并没有促进或抑制乙醇的积累,但接种量与溶氧的差异不会显著改变乙醇的积累过程,但将影响乙醇的消耗过程和残留乙醇的浓度。然而,这两个控制条件既改变了乙酸的变化过程也影响了终浓度的高低。
2.3 不同发酵策略中乙偶姻
在代谢产物的检测中,乙偶姻能够被鉴定出来,它是一种重要的风味物质[10-11]。图4展现了柑橘浓缩汁中乙偶姻在12种不同发酵策略下的变化过程。
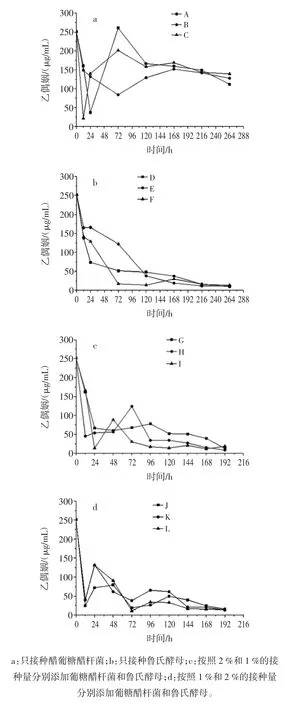
图4 乙偶姻在12种不同发酵策略下的变化过程Fig.4 The change of acetoin in twelve different fermentation strategies
在只接种葡糖醋杆菌的柑橘浓缩汁中,3种溶氧控制模式下的乙偶姻(图4a)虽然在发酵早期呈现振荡变化过程,但是在发酵后期只有少量的减少,且发酵终点时的浓度均不低于100 μg/mL。然而,只要加入鲁氏酵母,无论是单独接种还是与葡糖醋杆菌共发酵,柑橘浓缩汁中的乙偶姻均会被消耗殆尽。只存在单一的鲁氏酵母时,乙偶姻在3种溶氧水平下以不同的速率被逐步利用(图4b)。然而,在混合共酵模式下(图4c和图4d),乙偶姻表现出振荡减少过程。此外,溶氧水平对乙偶姻的代谢也会产生影响,且这种影响还受到存在微生物的种类和接种比例的作用。
3 结论与讨论
柑橘不仅是一种畅销水果,也是发酵饮料的一种重要原料[12-15]。一般情况下,柑橘被榨汁以作为发酵原料,但其含糖量偏低,无法满足微生物生长代谢的需求,往往还需要外加糖源以弥补碳源的不足[16]。本项目通过浓缩的方式提高柑橘汁的含糖量,在不加入任何外源营养物的情况下也能满足醋酸菌和酵母菌生长的要求。
在柑橘浓缩汁中,葡糖醋杆菌只在发酵中期利用部分糖,在发酵后期反而积累大量的糖,但会将浓缩汁中的乙酸完全消耗完。酵母对柑橘浓缩汁中的糖只有消耗,但伴随乙醇的积累,乙酸也会完全被消耗殆尽。溶氧水平的差异对醋酸菌和酵母菌在糖的消耗、乙醇的代谢没有剧烈的影响,但是对乙酸的代谢产生作用。然而,将这两种微生物混合共酵后,接种比例对总糖和还原糖影响不大,但持续提供溶氧将明显加快柑橘汁中糖的下降速率。这两个发酵控制因子对发酵后乙醇浓度和发酵中后期乙酸浓度产生不同的影响。溶氧水平对风味物质乙偶姻的代谢也会产生影响,且这种影响还受到存在微生物的种类和接种比例的作用。
上述研究结果表明,葡糖醋杆菌与鲁氏酵母混合间歇振荡模式发酵96 h,发酵的柑橘浓缩汁中的糖、醇、酸及其风味物质达到一定水平,其总糖和还原糖浓度分别为130.56 mg/mL和37.85 mg/mL,乙醇和乙酸浓度分别为56.00 g/L和33.97 μg/mL,乙偶姻浓度为34.02 μg/mL。发酵饮料是否成功的一个关键因素是口感是否舒适。这取决于饮料中酸甜醇的比例是否恰当。综合上述研究结果可以看到,通过发酵调控技术实现酸甜醇协调柑橘饮料的制备需要在以下几个方面进行控制:1)不能有过量的酵母菌,否则过于消耗糖源,也不利于柑橘浓缩汁中风味物质的保留;2)提高醋酸菌浓度,加快醇酸转化速率;3)控制酵母菌生长速度,减缓糖耗速率;4)间歇性改善溶氧,有助于乙醇和乙酸的积累。发酵过程还需要结合口感评价和更详细的风味物质分析以进一步的深入研究。

