正交试验优化红参多糖超声提取工艺
(牡丹江医学院,黑龙江牡丹江157011)
红参(radix ginseng rubra,RGR)为五加科植物人参(Panax ginseng C.A.Mey.)的栽培品经蒸制后干燥根及根茎,性寒,味甘、微苦,具有大补元气、复脉固脱、益气摄血的功效[1]。其生理活性成分主要是人参皂苷、挥发油和多糖[2-3]。近年来,从各种植物中提取多糖的研究日益增多,植物多糖的生物活性也日渐得到人们的重视。药理研究表明多糖具有降血糖[4]、降血脂[5]、抗病毒[6]、抗炎[7]、抗氧化[8-9]、免疫调节[10]和抗肿瘤[11]等方面的生物活性,且毒副作用小。红参多糖作为红参中一种主要的成分,也具备多种生物活性。研究表明,红参中可溶性多糖含量明显高于人参、西洋参[12]。故本试验选取红参为试验材料,采用超声提取法[13]进行多糖提取,采用苯酚-硫酸法[14]进行多糖含量测定,通过单因素试验、正交试验,确定红参多糖的最佳超声提取工艺。
1 材料与方法
1.1 材料与仪器
红参:吉林省长白县;葡萄糖(批号110833,分析纯):中国药品生物制品检定所,;苯酚(分析纯):沈阳试剂一厂;硫酸(分析纯):天津市富宇精细化工有限公司;无水乙醇(分析纯):哈尔滨市新达化工厂。
HN-1000CT恒温超声波提取机:上海汗诺仪器有限公司;SYC-15B超级恒温水浴:南京桑力电子设备厂;GZX-9070MBE电子恒温鼓风干燥箱:上海博迅实业有限公司医疗设备厂;723型可见分光光度计:上海光谱仪器有限公司;RE-5299旋转蒸发器:上海予华仪器有限公司;TGL-16C离心机:上海天美科技有限公司;TA 2004电子天平:北京赛多利斯仪器系统有限公司。
1.2 试验方法
1.2.1 葡萄糖标准曲线的绘制
葡萄糖使用前,先于105℃烘箱中,烘干至恒重,精密称取10 mg葡萄糖,用蒸馏水溶解,定容至100 mL容量瓶,混匀备用。配制成0.1 mg/mL葡萄糖标准溶液。分别吸取0.1 mg/mL葡萄糖标准溶液0、0.2、0.4、0.6、0.8、1.0 mL,置于带塞试管中,用蒸馏水依次补至1.0 mL。加入1.0 mL 5%的苯酚溶液,震荡混匀后,与液面垂直逐滴加入5.0 mL浓硫酸,充分混合。置于沸水浴中反应20 min后,取出,室温下冷却30 min,以相同处理的蒸馏水为对照组,于490 nm波长处,测定其吸光度A。以标准葡萄糖含量为横坐标,吸光度A为纵坐标,制定标准曲线。
1.2.2 红参多糖的含量测定
对红参多糖的含量测定采用苯酚-硫酸法。按
1.2.1项下方法操作,根据标准曲线,计算红参多糖提取率。
多糖提取率/%=(供试品中糖含量/原料的质量)×100
1.2.3 超声波法辅助提取红参多糖的工艺流程
红参粉末+蒸馏水→充分溶解→超声→真空抽滤→滤液用sevage法除蛋白质→浓缩→醇沉→得红参多糖测吸光度
1.2.4 单因素试验
试验采用超声功率(80、90、100、110、120、140、160、180 W),超声温度(30、40、50、55、60、70、80 ℃),料液比[1 ∶10、1 ∶15、1 ∶20、1 ∶25、1 ∶30、1 ∶35(g/mL)]及超声时间(25、30、35、40、45、50、55、60 min)为对红参多糖提取率的影响进行研究。
1.2.5 正交试验
根据单因素试验的结果,选择合适的超声功率(A)、超声温度(B)、料液比(C)、超声时间(D)为参考因素,以红参多糖提取率为指标,进行L9(34)正交试验设计,对红参多糖的超声提取工艺进行优化,确定最佳提取工艺条件。

表1 正交试验因素水平表Table 1 Factors and lerels for orthogonal array design
2 结果与分析
2.1 葡萄糖标准曲线
葡萄糖标准曲线见图1。

图1 葡萄糖标准曲线Fig.1 Glucose standard curve
由图1可知,以吸光度值A为纵坐标,葡萄糖含量为横坐标(mg),得线性回归方程:y=7.765x+0.028,R2=0.999 2,试验表明标准葡萄糖在0.02 mg~0.1 mg之间呈良好的线性关系。
2.2 单因素试验
2.2.1 超声功率对红参多糖提取率的影响
称取5 g红参粉末,按照超声功率80、90、100、110、120、140、160、180 W,料液比 1 ∶30(g/mL)、超声温度50℃、超声时间30 min,按1.2.3项下方法提取测定,计算多糖提取率,结果如图2所示。
结果表明,随着超声功率的增大,多糖提取率先上升后下降,120 W后增大超声功率对多糖提取率的影响不大,在超声功率为100 W处取得最大值,即超声功率在100 W左右时,红参多糖的提取效果较好。
2.2.2 超声温度对红参多糖提取率的影响
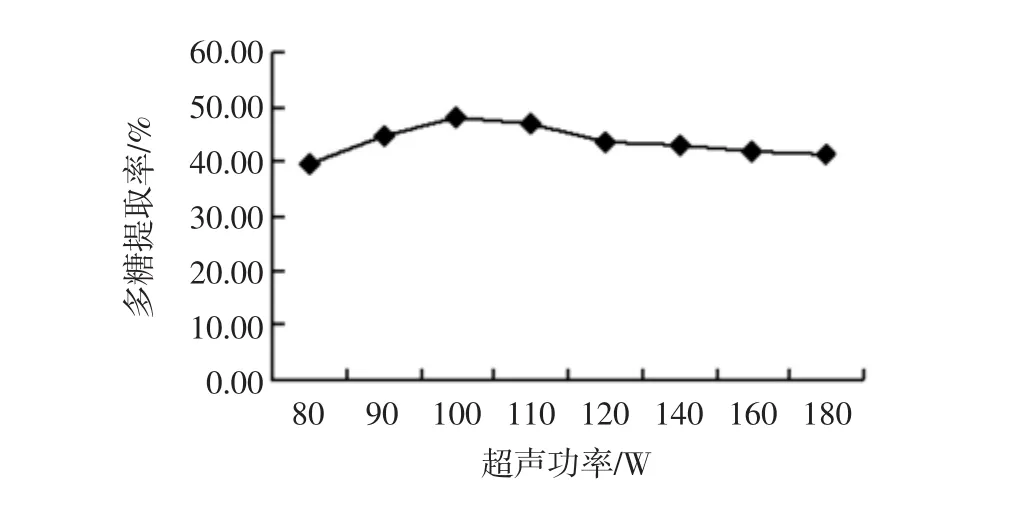
图2 超声功率对红参多糖提取率的影响Fig.2 The effect of ultrasonic power on extraction rate of red ginseng polysaccharides
称取5 g红参粉末,按照超声温度30、40、50、55、60、70、80℃,料液比 1∶30(g/mL)、超声功率 100 W、超声时间30 min,按1.2.3项下方法提取测定,计算多糖提取率,结果如图3所示。

图3 超声提取温度对红参多糖提取率的影响Fig.3 The effect of ultrasonic extraction temperature on the extraction rate of red ginseng polysaccharides
结果表明,超声温度对红参多糖提取率的影响不大,随着超声温度的增大,多糖提取率逐渐上升,在超声温度为60℃时取得最大值,70℃时多糖提取率开始下降,即超声温度在60℃左右时,红参多糖提取效果较好。
2.2.3 料液比对红参多糖提取率的影响
称取 5g红参粉末,按照料液比 1∶10、1∶15、1∶20、1 ∶25、1 ∶30、1 ∶35(g/mL)、超声温度 60 ℃,超声功率100 W、超声时间30 min,按1.2.3项下方法提取测定,计算多糖提取率,结果如图4所示。
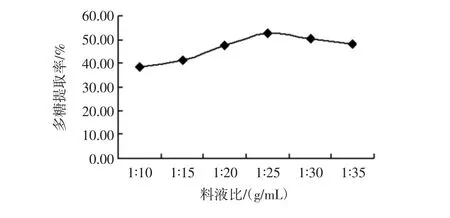
图4 料液比对红参多糖提取率的影响Fig.4 The effect of the solid-liquid ratio on the extraction rate of red ginseng polysaccharides
结果表明,随着料液比的增大,多糖提取率先上升后下降,在料液比为1∶25(g/mL)时取得最大值,红参多糖提取效果较好。
2.2.4 超声作用时间对红参多糖提取率的影响
称取5 g红参粉末,按照超声时间25、30、35、40、45、50、55、60 min,料液比 1 ∶25(g/mL)、超声温度 60 ℃,超声功率100 W,按1.2.3项下方法提取测定,计算多糖提取率,结果如图5所示。

图5 超声作用时间对红参多糖提取率的影响Fig.5 The effect of ultrasonic time on the extraction rate of red ginseng polysaccharides
结果表明,超声时间对红参多糖提取率的影响较为明显,随着超声作用时间的增大,多糖提取率逐渐上升,在超声时间为55 min时取得最大值,即超声作用时间为55 min左右时,红参多糖提取效果较好。
2.3 正交试验
2.3.1 正交试验结果与分析
根据单因素试验的结果,选择合适的超声功率(A)、超声温度(B)、料液比(C)、超声时间(D)为参考因素,以红参多糖提取率为指标,进行L9(34)正交试验设计,对红参多糖的超声提取工艺进行优化见表2,方差分析见表3。

表2 L9(34)正交试验结果Table 2L9(34)orthogonal experimental results
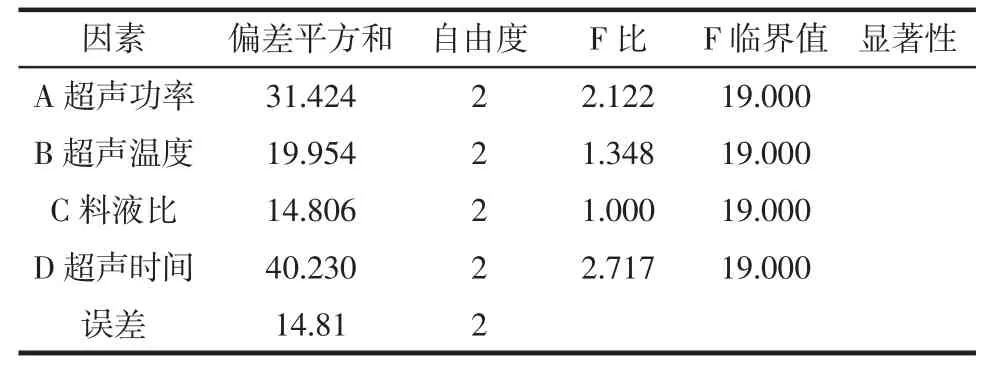
表3 正交试验方差分析结果Table 3 Results of the orthogonal experimental variance analysis
由表2正交试验结果中R值可知,各因素对红参多糖提取率的影响程度依次为:超声时间>超声功率>超声温度>料液比。确定正交试验优化出的最佳提取工艺为A2B1C2D1,即超声功率100 W,超声温度50℃,料液比1∶25(g/mL),超声时间50 min。由表3方差分析可知,FC<FB<FA<FD<F0.05,因此超声时间、超声功率、超声温度、料液比对超声提取红参多糖的提取率均无显著影响。
2.3.2 验证性试验
按照正交试验确定的最佳提取工艺条件A2B1C2D1,即超声功率100 W,超声温度50℃,料液比1 ∶25(g/mL),超声时间 50min 进行提取,平行 3 次,结果见表4,得出红参多糖提取率分别为53.77%、53.83%、54.30%,多糖平均提取率为53.98%,RSD值为0.52%(n=3)。计算结果表明,该提取工艺稳定可行。

表4 验证性试验Table 4 Verification test
3 结论
超声提取法是一种用超声波强化辅助提取植物多糖的方法。以物理破碎的方式促使植物的有效成分进入到溶剂中。同时,超声波在液体中形成一种高温、高压的环境,从而达到缩短提取时间的效果。故超声提取法可用于红参多糖的提取。
本文通过L9(34)正交优化试验结果表明,各因素对红参多糖提取率的影响程度依次为:超声时间>超声功率>超声温度>料液比。红参多糖超声提取的最佳工艺条件为A2B1C2D1,即超声功率100 W,超声温度50℃,料液比 1∶25(g/mL),超声时间 50min。在最佳超声提取工艺条件下,红参多糖平均提取率为53.98%,RSD值为0.52%(n=3),表明此方法提取率高且稳定性好。超声提取红参多糖工艺简单、方便、稳定、可行,可用于红参多糖的提取。

