3种作物初期生长对全氟辛烷磺酸盐和全氟辛酸的响应及富集特征
杨鸿波, 廖朝选, 赵亚洲, 谢 勋, 谭 红
(1.北京化工大学,北京 100029; 2.贵州省分析测试研究院,贵州贵阳 550002)
全氟化合物具有极高的化学稳定性和良好的疏水疏油性,在民用和工业产品生产中被广泛应用[1-2]。随着经济的快速发展,大量的全氟化合物被暴露于环境中,通过呼吸和摄食被生物体吸收,在生物体内蓄积,由于其持久性强,已成为当前环境中最难降解的污染物之一[3-4]。全氟辛烷磺酸盐(perfluorooctane sulphonate,简称PFOS)和全氟辛酸(perfluorooctanoic acid,简称PFOA)是被普遍检出的全氟化合物[5-6],具有高生物蓄积性,同时对生物体具有生殖毒性、免疫毒性、神经内分泌毒性、肝脏毒性、发育神经毒性等[7-8],且由其引起的神经毒性具有潜伏性,往往在个体成熟后才显现出来[9];其中PFOA还可影响胚胎发育、生物行为,并可造成DNA损伤[10]。PFOS和PFOA的大量生产与广泛利用,使得在动、植物体内被广泛检出,其对环境产生了严重危害[11];PFOS或PFOA通过人类摄食蔬菜、禽蛋、肉类等食物而间接进入人体,正威胁着人类的健康。了解PFOS和PFOA对植物的生长影响以及在体内的分布,可为植物中全氟化合物的污染阻控提供数据支持。
针对PFOS和PFOA对植物生长发育的影响,Stahl等在2009年率先系统研究春小麦、燕麦、马铃薯、玉米、多年生黑麦草等5种植物对土壤中PFOA和PFOS的生物利用性,结果发现,0.25~50.00 mg/kg范围内高浓度的PFOA和PFOS对植物的生长会产生影响,特别是对马铃薯而言,土壤中的PFOA和PFOS浓度就越高,植物中全氟化合物(perfluorinated compounds,简称PFCs)浓度就越高,且营养器官比储能器官更敏感[12]。吕振娥等通过研究小麦、大麦、白菜、白车轴草、绿豆等5种植物在短期内受PFOS的抑制作用发现,小麦根伸长的半效应浓度(median effect concentration,简称EC50)为352 mg/kg,最为敏感[13]。Qu等发现,低浓度的PFOS可以轻微刺激小麦幼苗的生长,诱导小麦幼苗中叶绿素和可溶性蛋白质的合成,而当PFOS浓度超过10 mg/L时可抑制根生长,影响根、叶生物量,并阻碍叶绿素的累积和可溶性蛋白质的合成[14]。由此可知,PFOA和PFOS可以被植物从土壤中吸收并对植物产生影响,但影响程度不同。
植物可以从土壤中吸收富集PFOS和PFOA,并由根部向茎叶部分迁移,且主要富集在植物的营养器官中[15]。通过研究小麦对PFCs的吸收动力学特性发现,小麦根部对PFOA的吸收速度远大于PFOS,在暴露100 h时,趋近于稳定,且根部的吸收大于茎的吸收,温度、盐度、pH值、受试物浓度对根部吸收2种全氟化合物均具有一定程度的影响[16-17],总体来看,PFOS主要被根部吸收。Krippner等通过水培法研究3种全氟羧酸(perfluorocarboxylic acids,简称PFCAs)和7种全氟烷基磺酸(perfluoroalkylsulfonic acids,简称PFSAs)全氟化合物的碳链以及pH值对玉米富集全氟化合物的影响,结果发现,玉米对PFSAs类化合物吸收速率最快的是长链PFOS,短链PFCAs容易在茎叶中富集,长链PFCAs和PFOS主要富集在根部[18]。在真实环境中,Zhang等通过分析辽宁省大连市阔叶和针叶植物中10种PFCAs和4种PFSAs的分布发现,针叶对PFCAs和PFSAs的吸收均大于阔叶,叶片中PFCAs含量大于PFSAs,短链PFSAs含量高于长链等[19]。
当前,众多专家学者使用小麦进行了大量的吸收动力学研究,并对比研究了植物对不同碳链及不同基团全氟化合物的吸收作用,而对于相同碳链不同基团的PFOA、PFOS在单独和联合作用的研究较少;不同作物对PFOA、PFOS的吸收利用情况不同,目前针对油类作物大豆、油菜以及粮食作物水稻对全氟化合物富集作用的研究较少。我国土壤中的PFOS、PFOA含量大多在5 ng/g以内,最高值为62.45 ng/g[20-22]。低浓度的PFOS会轻微刺激根的生长和酶活性的提高,而当浓度增至 200 mg/kg 时,会抑制根的生长和酶活性的提高,且会提高渗透性。研究PFOS和PFOA对水稻、大豆、油菜的生长发育影响及在3种作物体内的分布特征,以期为全面评价全氟化合物对人类的潜在危害提供理论数据支持。
1 材料与方法
1.1 试验材料
1.1.1 供试种子 禾本科单子叶植物水稻(Oryzasativa)种子由四川省绿丹种业有限责任公司生产(批次:201512);豆科双子叶植物大豆(Glycinemax)种子由江西省丰城市航城种业有限公司生产(批次:20160303);十字花科双子叶植物油菜(BrassicacampestrisL.)种子由贵州农业科学研究院研制(批次:201609)。
试验前将作物种子在10%次氯酸钠消毒液中浸泡 10 min,然后把种子转移到培养皿中并用去离子水漂洗后浸泡,大豆种子浸泡20 min,油菜种子浸泡30 min,水稻种子浸泡1 h。
1.1.2 试验土壤 试验土壤为黄壤土,采集于贵州省植物园天然林内,未使用化肥并远离化学污染源,风干后过2 mm筛备用。土壤的pH值为5.90,有机质含量为2.92%,阳离子交换量为18.1 cmol/kg。
1.1.3 仪器与设备 人工气候培养箱(北京科伟永兴仪器有限公司制造),箱内密布LED灯。
试验用花盆为一次性花盆,直径为18 cm,有效播种面积约为250 cm2,带储水盘。
液相色谱-质谱联用仪:Agilent LC-MS/MS,1290-6460 Agilent 1290 Infinity二元泵(G4220A),Agilent 1290 Infinity高效自动进样器(G4226A),Agilent 1290 Infinity系列柱温箱(G1316C),Agilent6460三重四级杆电喷雾离子源(electron spray ionization,简称ESI),MassHunter (B.08.00)工作站。N-EVAP-24氮吹仪(美国Organomation Associates,Inc.制造)。梅特勒-托利多电子天平,测量精度为0.000 1 g;Milli-Q超纯水仪(默克密理博公司制造)。
1.1.4 试剂与固相萃取柱 全氟辛烷磺酸钾盐(PFOS-K,CAS:2795-39-3,百灵威科技有限公司,纯度>98%);全氟辛酸(PFOA,CAS:335-67-1,百灵威科技有限公司,纯度>98%);甲醇(液相色谱-质谱联用级,Merck Drugs & Biotechnology);丙酮[分析纯,重庆川东化工(集团)有限公司];甲醇、氨水、甲酸、乙酸铵、异丙醇均为分析纯,均购自国药集团化学试剂有限公司。
CNWBOND WAX弱阴离子交换固相萃取柱(solid-phase extraction,简称SPE)(上海安普实验科技股份有限公司),500 mg×6 mL。
1.2 试验方法
1.2.1 浓度设置 分别设置1.0、5.0、25.0 mg/kg PFOS组和PFOA组,2.0、10.0、50.0 mg/kg联和试验组(CPFOS∶CPFOA=1 ∶1)。
1.2.2 暴露试验土壤制备 准确称取0.287 0 g PFOS、0.287 1 g PFOA,分别置于25 mL容量瓶中,用丙酮溶解并稀释得到浓度均为11.25 mg/mL的PFOS、PFOA储备液。(1)PFOS试验组:分别取0.4、2.0、10.0 mL PFOS储备液加入到3份质量均为100 g的试验土壤中,搅拌混匀并挥干溶剂备用。另称取4.4 kg试验土壤,将制备的100 g加药土壤加入其中,趁干搅拌混匀,然后加入800 mL去离子水继续搅拌混匀,得到1.0、5.0、25.0 mg/kg PFOS暴露试验土壤,然后将各浓度土壤平均分为3份置于花盆中备用。(2)PFOA试验组:取样量与操作方法同PFOS试验组,且同样将制备得到的1.0、5.0、25.0 mg/kg的PFOA暴露试验土壤平均分为3份置于花盆中备用。(3)联和试验组(CPFOS∶CPFOA=1 ∶1):分别依次取PFOS、PFOA储备液各0.4、2.0、10.0 mL 加入到3份质量均为100 g的试验土壤中,搅拌混匀并挥干溶剂备用。另称取4.4 kg试验土壤,将制备的100 g加药土壤加入其中,趁干搅拌混匀,然后加入800 mL去离子水继续搅拌混匀,得到2.0、10.0、50.0 mg/kg混合暴露试验土壤,然后将各浓度土壤平均分为3份置于花盆中备用。(4)对照组:取100 g试验土壤,加入20.0 mL丙酮,搅拌混匀并挥干溶剂备用。另称取4.4 kg试验土壤,将制备的100 g加丙酮的土壤加入其中,趁干搅拌混匀,然后加入800 mL去离子水继续搅拌混匀,得到对照组试验土壤,然后将该土壤平均分为3份置于花盆中备用。
1.2.3 暴露试验 参照GB/T 31270.19—2014《化学农药环境安全评价试验准则》“第19部分:非靶标植物影响试验”中300~1 000粒/m2的播种密度要求,结合种子大小与分析测试要求,每盆播种的种子数量为水稻20粒、大豆10粒、油菜25粒,种植密度分别约为800、400、1 000粒/m2。试验时将预处理后的水稻、大豆、油菜种子分别播种于各浓度系列及对照组的花盆中,然后置于培养箱中准备试验,并将储水盘蓄水以保证试验所需水分供应。培养箱的光—暗周期设置为16 h—8 h;光照时温度为(25±2) ℃,黑暗时温度为(22±2) ℃;在种子萌芽前,湿度保持在80%以上,种子萌芽后控制湿度在70%~85%之间。
试验开始后,记录种子的出苗情况,并在对照组种子半数萌芽后第14天,取出各盆试验植物,进行株高、生物量测定。
1.2.4 全氟化合物在植物体内的分布特征分析 将各植物根、茎、叶分离并分别剪碎制得的根、茎、叶样品。称取1.0 g样品,加20 mL甲醇振荡提取,经涡旋、离心处理使其上部澄清;然后取1 mL上清液,加入5 mL 2%甲酸水溶液,经涡旋处理后制备得试样初提取液。
取wax-SPE小柱,使用2 mL甲醇和1 mL去离子水分别活化,再使用2%甲酸水溶液平衡。然后将试样初提取液加入柱中,使用2 mL 2%甲酸水溶液淋洗,再用4 mL 3%氨化甲醇洗脱,经氮气吹干后,用甲醇和水(体积比为1 ∶1)混合液定容至1 mL,制备得试样提取液,然后用液相色谱-质谱联用仪测定。试验时分别使用茎、叶、根进行基质加标回收率试验,其回收率在88.9%~98.4%之间,样品的测定不进行回收率校正。
仪器及条件为色谱柱:Agilent ZORBAX Eclipse Plus C18,2.1 mm×50 mm,1.8 μm;柱温为40 ℃;进样体积为2 μL;进样针冲洗 ∶端口清洗(异丙醇 ∶水体积比为1 ∶1),2 s;流动相:A=5 mmol/L 乙酸铵水溶液,B=甲醇,流速为 0.20 mL/min。梯度洗脱程序:0~0.50 min,70.00% A+30.00% B;0.51 min,50.00% A+50.00% B;4.50 min,20.00% A+80.00% B;5.00 min,70.00% A+30.00% B,总运行时间6 min(平衡时间1 min)。质谱(mass spectrometry,简称MS)配置和条件:负离子模式;扫描模式:多反应监测(multiple reaction monitoring,简称MRM),毛细管电压为 -3 500 V,喷嘴电压为-500 V,雾化器压力为0.31 MPa,干燥器温度为300 ℃,干燥器流速为6 L/min,鞘气温度为300 ℃,鞘气流速为10 L/min,电子倍增器电压为400 V,质谱MRM参数见表1。
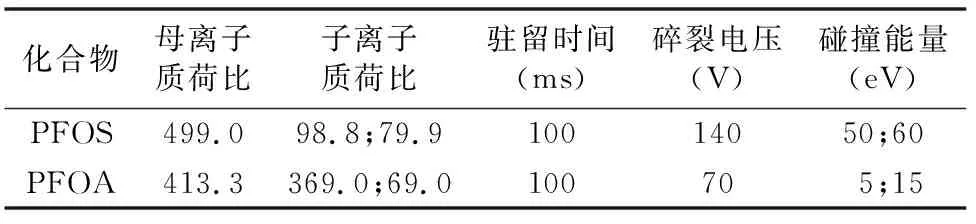
表1 质谱仪参数
1.2.5 数据分析 PFOS和PFOA对作物出苗率、株高、生物量的影响采用SPSS 11.5软件进行统计和分析,以P<0.05作为显著性差异水平。
采用茎、叶、根对PFOS和PFOA的富集因子(root concentration factor,简称RCF)、传输因子(transfer factor,简称TF)进行作物体内的富集体征分析,并评价其对植物的潜在影响。采用色谱工作站MussHunter对数据进行采集和定量分析,采用Origin Pro 8.0对数据进行统计和绘图。根富集因子[9]的计算公式为
(1)
式中:C根为作物根中PFOS或PFOA浓度,mg/kg干基;C土壤为有机质归一化后土壤中PFOS或PFOA浓度,mg/kgoc干基。
传输因子可指示供试植物自根向茎、叶传输化合物的能力,其计算公式为
(2)
式中:C茎叶为作物茎、叶中PFOS、PFOA浓度,mg/kg干基;C根为作物根中PFOS、PFOA浓度,mg/kg干基。
2 结果与分析
2.1 PFOS、PFOA对3种植物出苗率、株高、生物量的影响
在各浓度的PFOS、PFOA暴露试验土壤以及PFOS和PFOA混合暴露试验土壤中,所有种子全部发芽;水稻株高约30 cm,生物量约0.055 g/株;大豆株高约21 cm,生物量约 0.53 g/株;油菜株高约3.4 cm,生物量约0.007 g/株,对照组与各处理组出苗率、株高、生物量差异较小。
2.2 PFOS、PFOA在3种植物植株根内的富集情况
由图1可知,水稻、大豆、油菜根中PFOS、PFOA浓度与土壤中供试物浓度均呈极显著的线性相关关系,且随土壤中供试物浓度的增大而增加。与Stahl等的结论[12]相似,即随着土壤中PFOS、PFOA浓度的增加,PFOS、PFOA向植物中转移的量也增加。
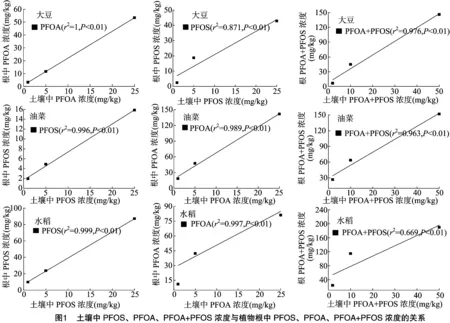
由表2、表3可知,PFOS在水稻、大豆、油菜根中的富集浓度分别为9.9~87.0、2.4~42.8、1.9~15.9 mg/kg,经有机质归一化后其富集因子分别为0.103~0.292、0.051~0.111、0.019~0.058,表明3种作物对PFOS的富集能力表现为水稻>大豆>油菜;水稻、大豆、油菜对PFOS的传输因子分别为 0.220~0.262、0.193~0.345、0.316~0.368,均小于1,表明3种植物均可自根向茎叶传输PFOS,根中浓度大于茎叶[11]。
PFOA在水稻、大豆、油菜根中的富集浓度分别为11.0~81.1,3.3~53.4,18.6~141.7 mg/kg,经有机质归一化后其富集因子分别为0.096~0.368、0.063~0.097、0.168~0.549,表明3种作物对PFOA的富集能力表现为油菜>水稻>大豆;水稻、大豆、油菜对PFOA的传输因子分别为 0.236~0.675、0.056~0.143、0.099~0.120,均小于1,表明3种植物均可自根向茎叶传输PFOA,根中浓度大于茎叶。
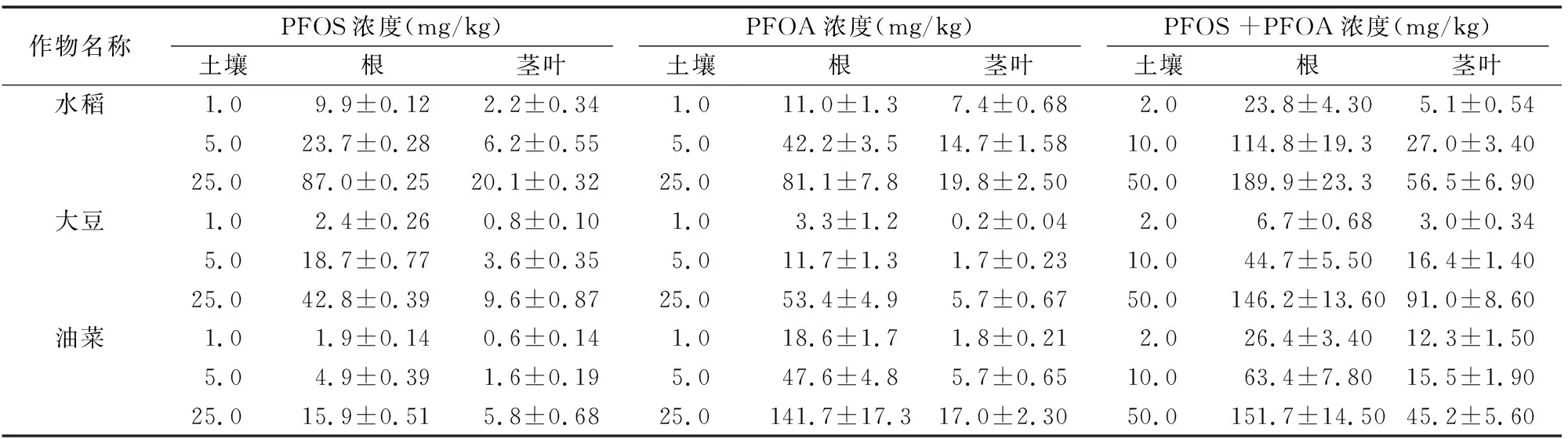
表2 3种植物对PFOS和PFOA的富集情况
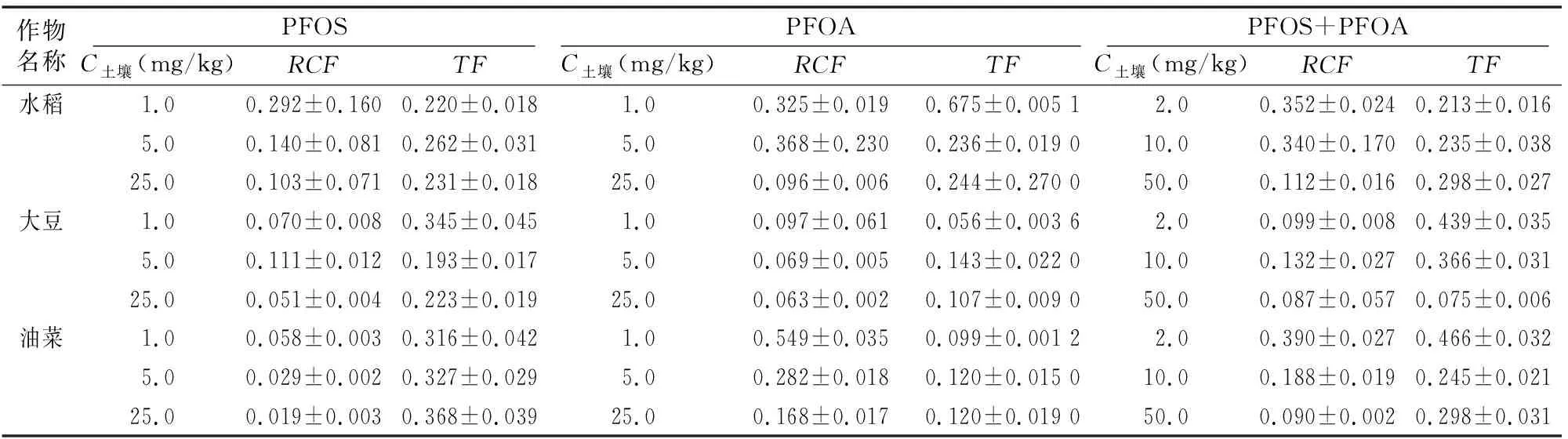
表3 3种植物对PFOA、PFOS的RCF和TF
由图2可以看出,在PFOS、PFOA联和试验中,3种作物对PFOS、PFOA的富集量随供试物浓度增大而增加,与单独试验一致;由表2可知,水稻、大豆、油菜根中的富集浓度分别为23.8~189.9、6.7~146.2、26.4~151.7 mg/kg,茎叶中的富集浓度分别为5.1~56.5、3.0~91.0、12.3~45.2 mg/kg,PFOS、PFOA联合试验与单独试验的总富集量无明显差异。
3 讨论
当土壤中PFOS、PFOA浓度为1.0~25.0 mg/kg时,PFOS、PFOA对水稻、大豆、油菜的出苗率、株高、生物量均无明显影响,这与赵淑艳研究中PFAs对小麦的生物量无明显影响[15]一致。水稻和小麦、大豆、油菜分别所属的禾本科、豆科、十字花科农作物在我国种植范围最广、生产量最多,表明在当前土壤背景下,PFOS和PFOA不足以影响作物的生产。但在Zhou等的研究中,当PFOS的浓度升高至200 mg/L时,超氧化物歧化酶(superoxide dismutase,简称SOD)和过氧化物酶(peroxidase,简称POD)活性明显降低[23],表明在高浓度PFOS条件下,小麦幼苗抗氧化防御系统可能会受到损害,PFOS和PFOA对作物的影响仍不可忽视。
植物中的PFOS、PFOA浓度与土壤中的PFOS、PFOA浓度呈线性相关关系,且随土壤中供试物浓度的增大而增加。在3种植物中,不管PFOS、PFOA是单独存在,还是等比例存在于土壤中时,在植物根部的富集量均高于在茎叶中的富集量。Wen等研究发现,较短链全氟磺酸(perfluorosulfonic acids,简称PFSAs)主要通过转移集中在茎叶中,而长链PFCAs如全氟辛酸(PFOA)、全氟壬酸(PFNA)、全氟癸酸(PFDA)、全氟辛烷磺酸己烷磺酸(PFHxS)、全氟辛烷磺酸(PFOS),主要通过吸收集中在根部[24],由于二者具有相同的碳链结构(C>4),说明在由土壤转移到根部时,由土壤转移到根部时,土壤孔隙中的化合物经被动扩散被植物根吸收,再经过木质部的水相或韧皮部汁液的蒸腾作用转移到植物体内,起主要作用的是亲脂性结构端;从韧皮部汁液到茎叶的传输过程中,水溶性更强的有机物能更多地从根部传输到茎叶,PFOS和PFOA的亲水端不同,所以二者的TF不同。同时也有研究发现,植物根系中PFOS、PFOA的累积量与根系蛋白质含量呈显著正相关关系(P<0.05),而与根系脂肪含量呈显著负相关关系(P<0.05),表明蛋白质对根吸收PFOS、PFOA具有促进作用,脂质具有抑制作用;传输因子与茎叶和根中蛋白质含量比例呈正相关关系[25],说明蛋白质和脂质对PFOS的积累和分布作用不同; 而在PFOA和PFOS联合作用时,未体现协同作用,只是浓度加和作用,即PFSAs在植物中的传输和富集作用机制会因为植物的不同而不同,同时受土壤中有机碳影响。进一步的机制还须要更深入的研究。


