放牧对川西北高寒草甸植被生物量及土壤氮素的影响
高丽楠
(成都大学旅游与经济管理学院,四川成都 610106)
世界第三极的青藏高原具有非常重要的地位,因其气候变化响应的敏感性以及生态系统的脆弱性,面积199.95万km2,平均海拔4 000 m以上,也是我国重要的畜牧业基地[1]。近年来随着人类活动对青藏高原高寒草甸生态系统影响的日益剧增,青藏高原面临的主要问题之一是过度放牧为主导因子的植被退化[2]。过度放牧不仅会影响高寒草甸生态系统地上植被的高度和盖度,还可干扰土壤的理化性质发生改变,破坏土壤微环境,减少土壤微生物的数量,导致作为生态屏障的高寒草甸生态系统出现严重退化[3]。一直以来放牧对青藏高原高寒草甸植被群落以及土壤理化性质的研究倍受科学家关注,目前大多数研究集中于不同放牧强度对生物多样性[4]、土壤养分变化[5]、生物量[6]等的影响,而针对不同季节的放牧措施对高寒草甸植被群落和土壤养分影响的研究相对较少。
土壤生产力的重要限制因子是土壤氮素,不平衡的氮循环不仅会影响生物地球化学循环,而且会影响全球环境变化。氮素也是陆地生态系统中植物生长的主要影响因子,因为氮素是植物蛋白质的重要组成部分,同时还是组成核酸结构的重要元素[7]。在养分贫乏的生态系统中较长的氮素驻留时间有利于植物生存、竞争和具有较高的生态适合度,而相对较短的氮素驻留时间对植物的生存等则不利[8]。因此,研究放牧干扰对高寒草甸植物、土壤氮素的影响,对我国青藏高原高寒草甸恢复及合理开展生态保育工作具有重要意义。
高寒草甸约占青藏高原总面积的35%,是青藏高原草地生态系统的一个重要组成部分[9]。川西北高寒草甸是我国主要的牧区之一,位于青藏高原东缘,也是青藏高原高寒草甸的重要组成部分。近30年来,在自然扰动与人为因素干扰下,川西北高寒草甸生态系统呈明显的退化趋势[10]。鉴于以上原因,我们在川西北高寒草甸开展了本试验,将高寒草甸放牧划分为浅丘山地灌丛(围封禁牧)、浅丘山地草甸(适度放牧)和丘前阶地草甸(重度放牧)3种,将植物贮量分为3个部分,分别为地上部活体生物量、凋落物和地下部生物量,旨在研究春(5月)、夏(7月)、秋(9月)不同季节下放牧对川西北高寒草甸的植物生物量以及植物和土壤氮元素贮量的影响,以期明确高寒草甸的合理利用和保护问题,为持续发展的高寒草甸畜牧业提供科学指导。
1 材料与方法
1.1 样地设置
本研究设置在四川省红原县(31°51′~33°19′N、101°51′~103°23′E),海拔3 600 m,地处青藏高原东缘,属典型的大陆性高原寒温带季风气候,年平均气温1.2 ℃,最冷月平均气温-10.6 ℃,最热月平均气温10.8 ℃,年均降水量650~750 mm,80%集中在5—10月[11]。
浅丘山地灌丛(Upland shrubland,缩写US),(32°54.560′N、102°35.603′E,海拔3 522 m),高山绣线菊(Spiraeaalpine)为建群种,样地内植被茂盛,于2012年10月设网围栏,本研究将其视为围封样地。灌丛分盖度为60%左右,高0.5~0.6 m,伴生灌木有西藏忍冬(Loniceratibetica)、藏沙棘(Hippophaethibetana)和窄叶鲜卑花(Sibiraeaangustata)等。US草本植物种类繁多,并且由灌木+草本植物构成的群落总盖度达到96%以上。
浅丘山地草甸(Upland meadow,缩写UM),(32°54.509′N、102°35.651′E,海拔3 508 m)偶尔有放牧干扰,将其视为适度放牧样地。群落优势种主要有:早熟禾(Poaannua)、丝颖针茅(Stipacapillacea)、四川嵩草(Kobresiasetchwanesis)、西藏嵩草(Kobresiatibetica)、矮生嵩草(Kobresiahumilis)、羽裂风毛菊(Saussureabodinieri)、鹅绒委陵菜(Potentillaanserine)等,UM群落的总盖度达到85%以上。
丘前阶地草甸(Terrace meadow,缩写TM),(32°54.557′N、102°35.908′E、海拔3 494 m),TM长期受牲畜践踏采食,因其位于牲畜觅食必经之路,植被退化较严重并且土壤裸露较多,与前二者相比较群落结构单一,故将其视为重度放牧样地。群落优势种主要是:皱叶酸模(Rumexcrispus)、水杨梅(Adinarubella)、高山紫菀(Asteralpinus)、华丽龙胆(Gentianasino-ornata)、甘肃马先蒿(Pediculariskansuensis)、大戟(Euphorbiapekinensis)、狼毒(Stellerachamaejasme)、稜子芹(Pleurospermumcamtschaticu)等,TM群落的总盖度达到60%左右。
3种样地的主要物种组成见表1。

表1 3种样地的主要物种组成
1.2 研究方法
1.2.1 样品采集 取样时间安排在2015年5月、7月、9月,即分别在植被的返青期、旺盛生长期、枯黄期进行。在地势平缓坡向一致地段,在US、UM和TM各样区分别设置3块 20 m×20 m样地。在每个样区内设置8个50 cm×50 cm样方,每次每区共计24个样方。地上植物活体齐地刈割之后收集凋落物;105 ℃下杀青30 min后,65 ℃烘干称质量[12],留样分析。在地上部生物量收获后的调查样方内,收集0~40 cm土层的根系样品,用0.5 mm筛网在实验室冲洗,根系洗净后105 ℃杀青30 min,在65 ℃下烘干后,称取植物地下部生物量,并留样分析。所有样品使用样品粉碎机磨成0.15 mm的粉末后用于测定植物样品中的全氮含量。
同步进行土壤样品采集,在测定地上部和地下部生物量的相对应样方内,分别按0~10 cm、>10~20 cm、>20~30 cm、>30~40 cm采集土壤样品,在实验室进行分析。在实验室过2 mm筛,去除植物根系,石块和凋落物等。土壤样品经自然风干后先过1 mm筛得到20目土壤样品,然后从所得到的20目土壤样品中取出一小部分全部过0.149 mm筛,用来测定土壤全氮含量。
1.2.2 样品分析 植物氮和土壤氮含量测定使用H2SO4-H2O2法进行消煮,消煮后的待测液供全氮测定;全氮用FOSS Kjeltec 2300全自动定氮仪测定。
1.3 数据处理
用软件SPSS 12、Originpro 7.5对所得数据进行统计、分析和图形处理。
2 结果与分析
2.1 放牧对生物量的影响
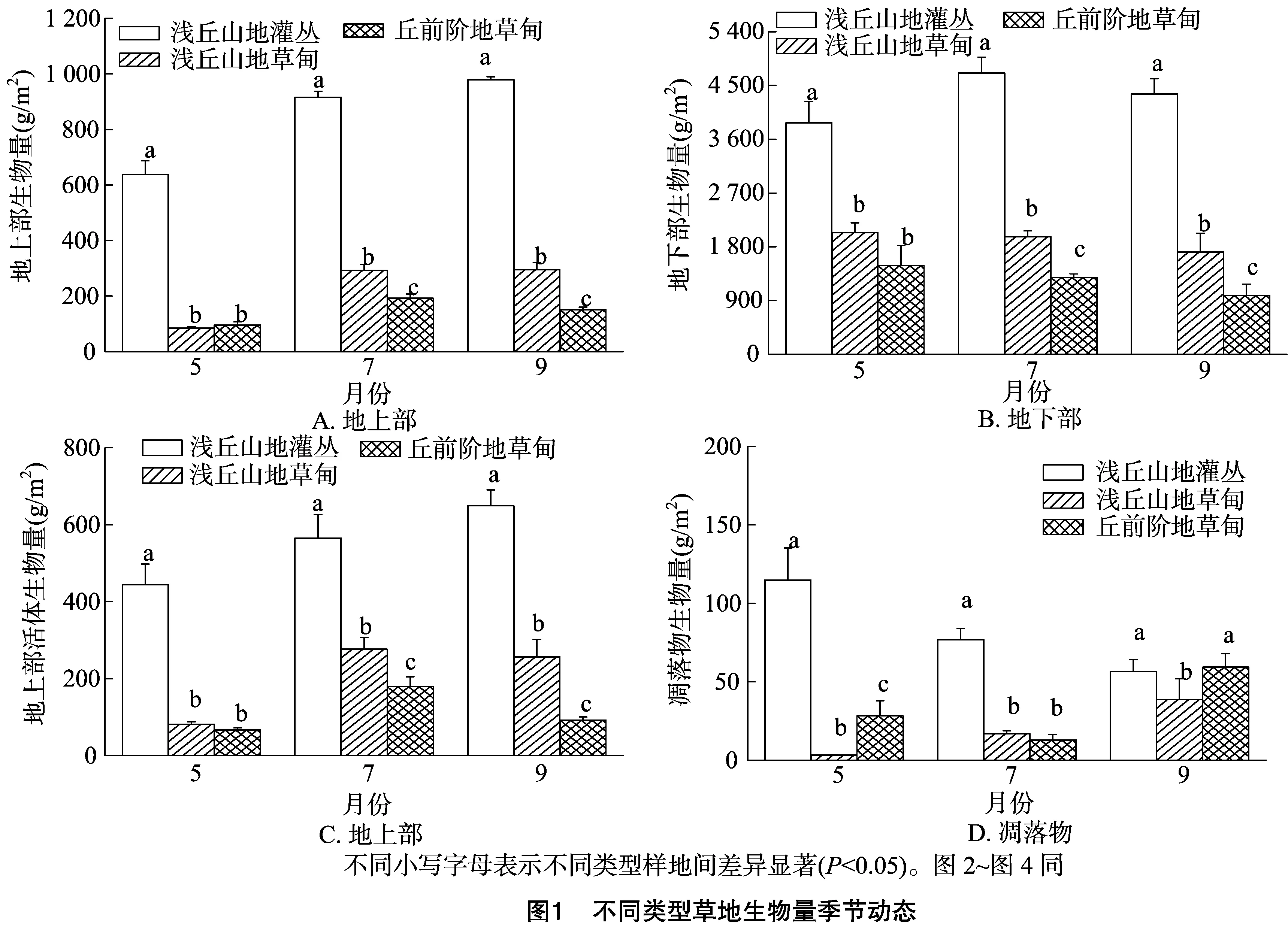
US和UM的地上部生物量的季节动态均呈现逐渐增加的变化模式,其变化范围分别为636.86~978.11 g/m2和 83.96~295.12 g/m2;但TM地上部生物量的季节动态呈增加→降低的趋势,变化范围分别为94.91~191.93 g/m2(图1-A)。US的地下部生物量的季节动态呈增加→降低的趋势,最大值出现于7月;而TM和UM的地下部生物量的季节动态均呈逐渐降低的趋势(图1-B)。5月US的地上部生物量和地下部生物量均显著高于UM和TM,UM和TM之间差异不显著;在7月和9月,地上部生物量和地下部生物量均为US>UM>TM。地上部和地下部生物量均随着放牧强度的增加而呈下降趋势,表现为US>UM>TM。
US的地上部活体生物量季节动态呈现逐渐增加的变化模式,变化范围为444.27~648.91 g/m2;但UM和TM地上部活体生物量的季节动态呈增加→降低的趋势,变化范围分别为80.72~276.16 g/m2和66.57~178.98 g/m2,最大值出现在7月。7月和9月,地上部活体生物量均为US>UM>TM(图1-C)。US的凋落物季节动态呈现逐渐降低的趋势,而UM则呈现逐渐增加的趋势,TM则呈现先降后升的“V”形变化(图1-D)。
2.2 放牧对植物氮贮量的影响
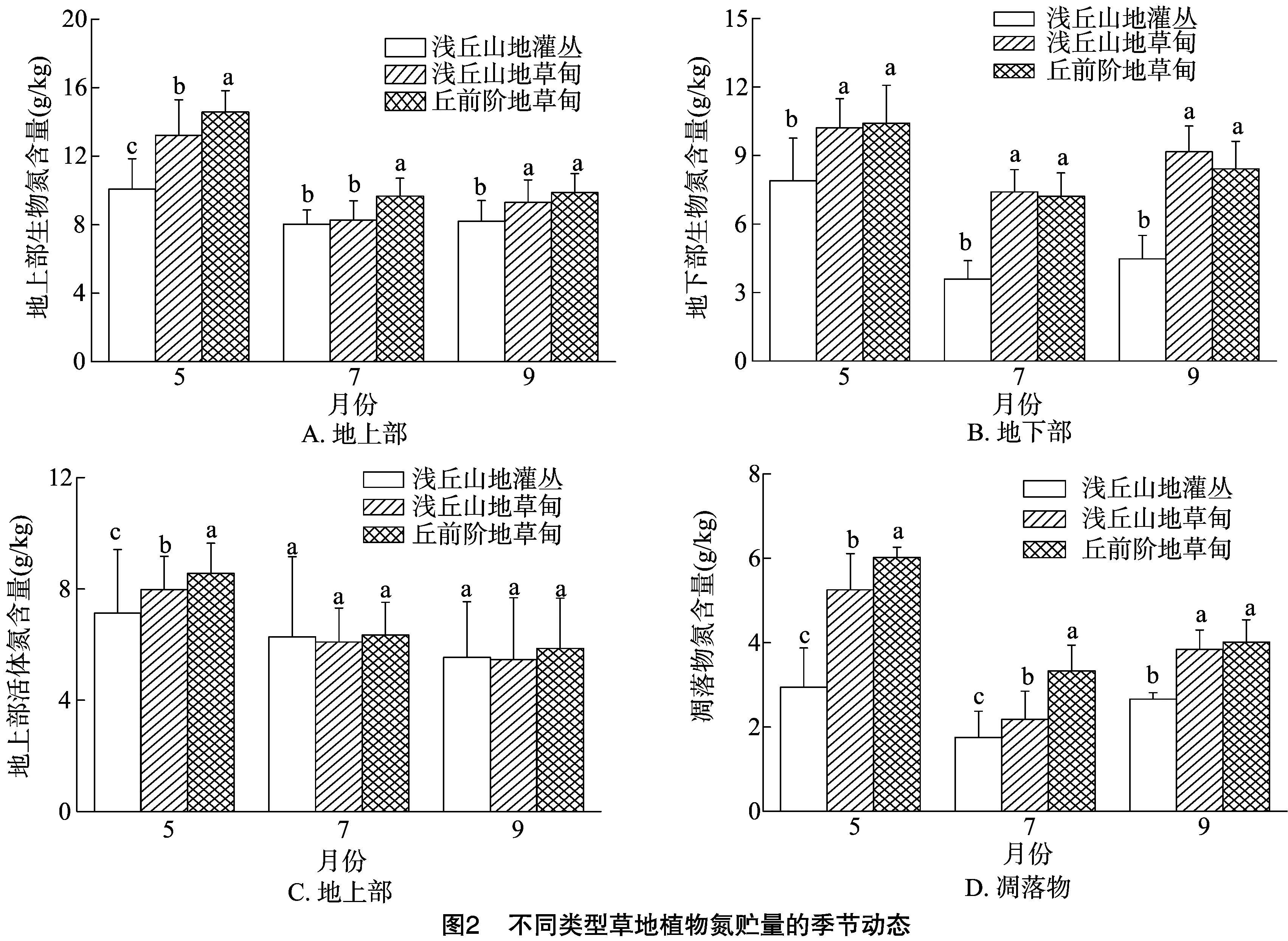
5—9月,三类草地的地上部生物氮含量、地下部生物氮含量和凋落物氮含量均随生长季的推移呈先降后升的“V”形变化(图2)。其中US的地上部生物氮含量、地下部生物氮含量和凋落物氮含量的变化范围分别为8.03~10.07 g/kg、3.59~7.89 g/kg、1.75~2.94 g/kg,而重牧的TM地上部生物氮含量、地下部生物氮含量和凋落物氮含量的变化范围分别为9.67~14.58 g/kg、7.22~10.41 g/kg、3.33~6.02 g/kg。5月的地上部生物氮含量均为TM>UM>US,不同草地间差异显著。7月地上部生物氮含量为TM显著高于UM和US,9月TM和UM地上部生物氮差异不显著(图2-A)。5—9月,TM和UM的地下部生物氮含量间差异不显著,TM和UM地下部生物氮含量均显著高于US(图2-B)。5—9月,US、UM和TM的地上部活体氮含量均随生长季的推移呈降低的趋势,5月的地上部活体氮含量为TM>UM>US,但在7月和9月,US、UM和TM之间的地上部活体氮含量差异不显著(图2-C)。高寒草甸TM、UM和US植物地上部分氮含量明显高于地下部氮含量。UM和TM的植物氮含量几乎显著高于US,TM的植物氮含量最大。5—9月,凋落物氮含量均为 TM>UM>US(图2-D)。
2.3 放牧对土壤全氮的影响
2.3.1 不同土层 TM、UM和US的不同土层的土壤全氮含量指标具有规律性变化(图3),由土壤上层到下层全氮含量呈逐渐降低趋势,呈“倒梯形”分布,各层之间差异显著,0~10 cm土层的全氮含量显著高于底层,呈表层富集现象。在5—7月,表现为0~10 cm土层全氮含量随放牧强度增强先减小后增加,其最低值出现在适度放牧的UM,最高值出现在重度放牧的TM。5月,0~10 cm、>20~30 cm和>30~40 cm 土层全氮含量,TM和US之间差异不显著,但TM和US均显著大于UM,UM土壤全氮含量最低,UM样地0~10 cm、>20~30 cm、>30~40 cm土层全氮含量依次为4.22、3.20、3.64 g/kg;US>10~20 cm土层全氮含量显著高于UM和TM(图3-A)。7月,>20~40 cm土层全氮含量,US>UM>TM,US土层全氮含量最高,为8.56 g/kg;0~10 cm的土层全氮含量,TM和US间无显著差异,并且TM和US均显著高于UM;US、UM和TM>10~20 cm的土层全氮含量差异不显著(图3-B)。9月US、UM和TM的0~10 cm土层全氮含量差异不显著;在>10~20、>20~30 cm土层全氮,US和UM间差异不显著,US和UM显著高于TM。
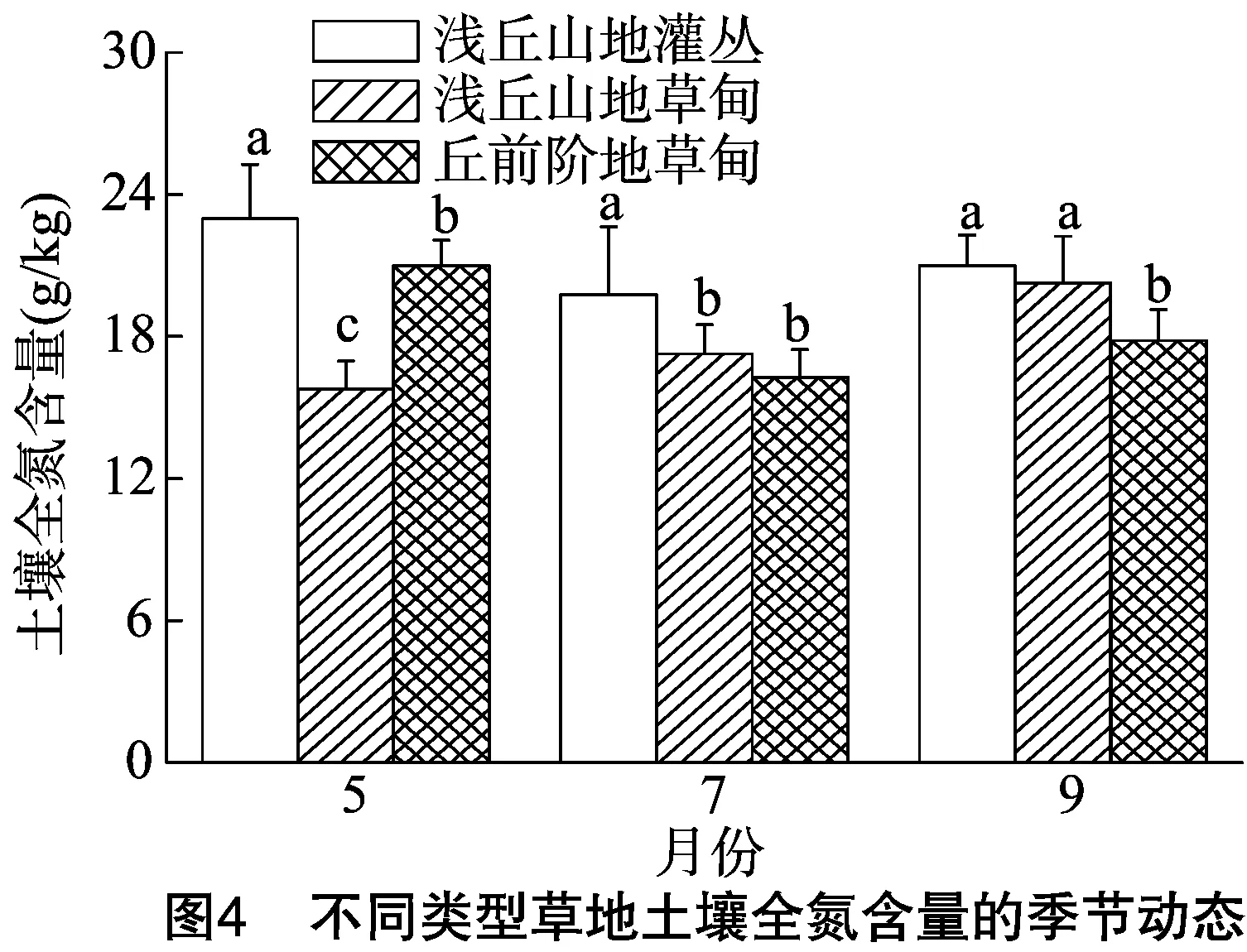
2.3.2 不同类型草地 一般认为,氮素丰富的土壤的全氮含量大于2 g/kg[13]。从图4可以看出,在0~40 cm土层,US、UM和TM 的土壤全氮含量在生长季节内均高于12.0 g/kg,说明川西北高寒草甸土壤氮素丰富,UM的土壤全氮随生长季节变化呈现逐渐增加的趋势,而US和TM土壤全氮则呈先减少后缓慢增加的趋势。5月,0~40 cm土层的全氮,表现为 US>TM>UM,不同草地间差异显著;7月,US土壤全氮显著高于UM和TM,UM和TM之间差异不显著;9月,US和UM的土壤全氮显著高于TM,而US和UM的土壤全氮之间差异不显著。

3 讨论与结论
青藏高原高寒草甸的主要干扰因素是放牧,牲畜通过践踏、采食和排泄物输入3种主要形式,直接或间接影响高寒草甸生态系统,并对生态系统物质生产和能量分配产生重要的影响,而且间接改变高寒草甸的物种多样性、群落结构和生物量等[14]。青藏高原高寒草甸、灌丛草甸植物地上部生物量随着放牧强度的增加呈显著降低趋势[15]。随着放牧强度的增加,宁夏荒漠草原植物的地上部和地下部生物量呈现下降态势[16];而高寒小嵩草草甸随着放牧压力的增大植物地上部生物量呈下降趋势,但地下部生物量呈现增大趋势[17]。本研究中川西北高寒草甸植物地上部和地下部生物量均随着放牧强度的增加而呈下降趋势,表现为US>UM>TM,这与青藏高原东部玛曲高寒嵩草草甸的研究结果[5]一致。围封禁牧的US植物地上部生物量、地下部生物量显著高于适度放牧的UM和重度放牧的TM,放牧显著降低了植物地上部生物量和地下部生物量。US通过排除家畜的践踏、采食的围封措施,明显恢复退化草地植被,促使草地群落生物量增加。
本研究中,5—7月川西北高寒草甸植物随生长季的进一步推移,降水增加、热量充足,从而促进植物光合同化物积累和生长[18],因牲畜的践踏采食,导致高寒草甸植物补偿性生长[19],从而使US、UM、TM的植物地上部生物量和地上部活体生物量表现为增加趋势。7—9月,US、UM、TM的植物逐渐进入生殖期,大部分光合产物被生殖生长消耗,余下来能运输到根系贮藏者无几。不仅如此,地下贮藏器官贮存的营养物质还需要被地上部利用,从而导致US、UM、TM的植物地下部生物量呈下降趋势。尽管7月充足的水热条件,生殖生长的地上部对贮藏物质的地下部仍具有较强的依赖性,所以出现了UM和TM的植物地上部旺盛生长,地下部生物量随着生长季节的推移几乎呈现降低的趋势,秋季9月地下部生物量达到最低值。同时因牲畜的践踏采食,导致重度放牧的TM地上部活体生物量显著低于围封的US,从而影响放牧的TM的凋落物量降低并显著低于围封的US。
本研究结果表明,放牧样地UM和TM的植物氮贮量显著高于US,这与呼伦贝尔草原的放牧草地植物氮贮量显著高于围封草地研究[20]相一致。本研究证实了放牧会显著增加UM和TM植物氮贮量,这主要因为放牧有利于消除UM和TM植物地上部分衰老的组织,通常含有较高的养分含量的幼嫩组织可以提高养分吸收效率,叶片中的叶绿素含量迅速增加,并促进植物的光合作用,补偿放牧减少的生物量。叶绿素的主要组成成分是氮元素,所以放牧干扰下UM和TM植物氮含量高,这也是草原植物超补偿生长的一种表现[21]。
本研究中,TM、UM和US土壤全氮含量随土层深度的增加呈直线下降趋势。植物根系及枯落物的分解是土壤养分的主要来源,因土壤表层主要集中的枯落物积累较多有机质,尽管高寒草甸植物根系能够延伸到土壤40~50 cm,但75%~90%植物根系也主要分布在土壤表层0~10 cm[9]。随着土层深度的增加,植物根系分布降低,有机质来源少,所以TM、UM和US土壤全氮含量随土层深度的增加而呈递减的趋势。放牧对高寒草甸土壤理化性质的影响并不是简单的线性关系,其影响较为复杂。本研究5月和7月川西北高寒草甸表层土壤0~10 cm的全氮随着放牧强度增加呈先下降后上升的非线性变化,这与江源等的研究结果[22]相同,五台山高山草甸随着放牧强度的增加,土壤TN含量呈先下降后上升的非线性变化。总之,土层0~10 cm全氮对不同放牧处理的响应较为明显,而土层30~40 cm则相对不明显,可能是深层土壤对放牧的响应具有滞后效应所致。因为枯落物和植物根系对土壤的影响主要限于土壤表层,所以土壤全氮对不同放牧处理方式的响应,土壤表层的影响更为直接和明显。在5月和7月,重牧干扰的TM土壤全氮的含量显著高于放牧干扰较轻的UM。究其原因主要是TM是牛马集中活动的场所,随着放牧强度的增加家畜啃食量加大,粪便数量多,增加了土壤表层速效养分,且土壤尚未被严重侵蚀,因此养分流失较轻;同时TM呈较严重的退化趋势,低植被覆盖度,较低的土壤养分的利用效率,导致有机质的分解速度降低,所以积累了有机质和氮素。
川西北高寒草甸土壤全氮含量要显著高于黄土高原典型草原-宁夏固原云雾山草原[23],原因就在于川西北高寒草甸土壤含水量较高,具有明显低温和高湿特征的土壤微环境[24],因此土壤微生物活性降低便于土壤养分的积累。土壤全氮含量的消长,不仅取决于氮的积累和消耗的相对强弱,尤其取决于有机质的积累和分解作用的强弱。随着5月生长初期气候转暖,开始融化冻结的土壤以及土壤微生物活性逐渐提高,有机氮矿化作用增强,同时因植物开始生长对速效态氮的吸收量增加,导致US和TM的全氮含量下降;UM因群落内氮累积高于豆科植物的固氮作用以及草本植物生长的氮消耗,从而土壤出现氮累积。因7月具有充足的雨热条件,有机质的矿化分解被提高,分解的凋落物促进养分的累积,UM土壤全氮出现累积;但此时植物需要吸收较多的氮素来满足其生长需要,而在US由于灌丛植被吸收导致的土壤速效氮损失量高于凋落物的分解输入,促使US土壤全氮出现降低;重度放牧的TM引起地上部生物量降低和根系生物量降低,使得归还到土壤中的有机质降低,TM土壤全氮则呈降低趋势。进入9月,因植物枯黄期,植物生长对氮素的吸收能力降低,随着凋落物归还量增加土壤氮含量增加,使得US、UM和TM土壤全氮呈增加趋势。另外,重度放牧的TM因牲畜的排泄物中含有大量氮素,导致土壤表层氮素增加,从而缓解了地上部生物量和地下部生物量归还减少带来的全氮降低,因此 0~10 cm表层土壤中的土壤全氮有增加趋势。但是,植物地上部分的凋落物以及地下的根系是土壤有机质的主要来源,因此高寒草甸的群落盖度越高以及物种越丰富,有机质含量相应也就越高,全氮含量与有机质含量有显著的相关性,TM重度放牧引起的地上部生物量和根系生物量在3个样地中最低,使得归还到土壤中的有机质降低;另一个原因是对放牧产生不同的响应的植物生理特性,植物随着家畜采食不断生长出新的叶片,而氮在新叶中含量的增加会降低根系中氮的分布,所以根系向土壤中输入氮的总量将减少。所以TM(0~40 cm)土壤全氮显著小于US和UM,是放牧区土壤全氮含量始终不如封育区全氮含量高,这与呼伦贝尔草甸草原随着放牧强度的增加土壤全氮含量逐渐降低的研究结论[25]基本一致。
本研究中川西北高寒草甸植物地上部生物量和地下部生物量均随着放牧强度的增加而呈下降趋势,表现为US>UM>TM,放牧使群落总体生产力下降。另外,放牧样地UM和TM的植物氮贮量显著高于US,但随着放牧强度的增加土壤全氮含量逐渐降低,重度放牧干扰最终会导致植物地上部和地下部生物量降低,从而引起土壤氮素流失。因此减轻放牧、封育禁牧或者利用农业措施进行人工促进恢复退化草地,草地植被可得到较快的恢复,恢复退化高寒草甸最经济的技术方法是围栏封育。

