UPLC-MS/MS法测定鸡肉中阿维菌素类药物残留检测方法的建立
冒玉娟, 邢晓玲, 沈小艮, 何晋瑶
(江苏农牧科技职业学院,江苏泰州 225300)
随着我国社会经济和生活水平的提高,食品安全问题引起了全社会的广泛重视,采取有效的检测手段对动物源食品中药物残留问题进行风险预警及监督控制是保障人们“舌尖上”安全的重要举措。阿维菌素类药物(avermectins,AVMs)是由链霉素产生的一组类似于大环内酯类药物的物质,由于有杀虫活性强[1-2]、杀虫谱广的特点,成为现代农牧业上用量最大的抗寄生虫药物[3]。目前,已商品化的主要品种有阿维菌素(avermectin,AVM)、伊维菌素(ivermectin,IVM)、多拉菌素(dommectin,DOR)、埃普菌素(eprinomectin,EPR)、莫西丁克(mox-idectin,MOX)和塞拉菌素(selamectin,SEM)[4]。虽然,阿维菌素类药物的作用剂量较小(ng/kg级),但是此类药物的脂溶性较高,而且具有神经毒性和发育毒素,在体内残留时间较长,因此按照世界卫生组织(WHO)5级分类标准,仍将其列为高毒化合物[5]。几乎每个国家都有食品中AVMs残留限量(MRL)的规定,欧盟(EU)、美国(US)、联合国食品法典委员会(CAC)和我国都制定了阿维菌素类药品在哺乳动物体内的农药最高残留限量(MRL),欧盟为15 μg/kg、美国为20 μg/kg、联合国食品法典委员会和许多国家对该类化合物的残留限量为 10 μg/kg[6-7]。
阿维菌素类药物相对分子量较大,气化困难,且尚无可行的气相色谱分析方法。目前,检测方法主要有免疫亲和色谱技术(IAC)、酶联免疫吸附法(ELISA)、液相色谱法(HPLC)等。免疫亲和色谱技术需要选择合适的抗体固定方式,在洗脱待测抗原时应保证固定的抗体不被解离下来,试验成本较昂贵;酶联免疫吸附法的最低检测限较低,可以满足阿维菌素类药物残留的检测,但是免疫分析检测具有一定的盲目性,以及抗体依赖于国外进口等因素的影响,使酶联免疫法的广泛应用受到限制;HPLC技术是阿维菌素类较为常用的药物分析技术,其中HPLC-DAD检测法灵敏度低,无法精确检测残留量;HPLC-FLD光检测法是国内目前使用最广泛的阿维菌素类药物残留的检测方法[7],但是样品前处理复杂,需要进行衍生化,花费较高。近年来,UPLC-MS/MS法在国内外屡见报道,此法将超高效液相色谱的高速、高分离度与质谱的高选择性、高灵敏度相结合,无需对样品进行衍生化处理,可同时测定多个目标物,具有高选择性、高灵敏度、高通量的优势。本试验样品采用蛋白沉淀法前处理,建立UPLC-MS/MS法同时测定鸡肉中伊维菌素、阿维菌素、多拉菌素、乙酰氨基阿维菌素多残留的检测方法,方法简单、操作性强,可满足国内外对动物源食品中阿维菌素类药物残留的定性、定量检测要求。
1 材料与方法
1.1 药物与试剂
伊维菌素对照品(批号:k0191406)、阿维菌素对照品(批号:k0361505)、多拉菌素对照品(批号:k0461411)、乙酰氨基阿维菌素对照品(批号:k0471411)均购自中国兽医药品监察所;伊维菌素原料药、乙酰氨基阿维菌素原料药,河北威远动物药业有限公司;阿维菌素粉(2%),江苏中牧倍康药业有限公司;多拉菌素原料药,江苏凌云药业有限公司;乙腈,色谱纯,Fisher Scientific公司;二甲基亚砜(DMSO),色谱纯,国药集团化学试剂有限公司;甲酸,色谱纯,Sigma-Aldrich公司。
1.2 仪器与设备
超高液相色谱仪(日本岛津超高液相LC-30AD系列);API 4000 Q-trap三重四级杆/离子阱质谱仪包含电喷雾电离源(ESI源)(美国Applied Biosystem公司);CTC PAL自动进样器(CTC Analytics,AG,瑞士);FA25型高速匀浆机(Fluko公司)。
1.3 试验动物及处理
雏鸡,购自江苏泰州某孵化场,选择无抗饲料饲养至30日龄。分为2组,一组给以伊维菌素、阿维菌素、多拉菌素、乙酰氨基阿维菌素粉,均按照说明书剂量拌料给药,连用3 d;另一组为对照组,不给以任何药物。分别在给药后3 d,剖杀,取各组肌肉,-20 ℃保存,备用。
1.4 方法
1.4.1 系列标准工作溶液的配制 精确称取伊维菌素、阿维菌素、多拉菌素、乙酰氨基阿维菌素对照品适量,分别置于 20 mL 的容量瓶中,用DMSO溶解并定容,超声促溶,并充分摇匀,配制成1 mg/mL标准储备液。用移液枪各取100 μL于600 μL乙腈中,配制成100 μg/mL的混合工作液。用乙腈梯度稀释至10.00、5.00、2.00、0.50、0.20、0.08、0.04 μg/mL的混合系列标准工作溶液。
1.4.2 空白肌肉匀浆液 称取一定量的鸡空白肌肉样品,剪碎,加入5倍体积的50%乙腈,样品置于冰浴上,用高速匀浆机进行匀浆处理,得均一的匀浆液。
1.4.3 标准工作曲线的前处理 取5 μL系列标准工作液(10.00、5.00、2.00、0.50、0.20、0.08、0.04 μg/mL)加入 50 μL 的空白肌肉匀浆液中,涡旋30 s,加入150 μL乙腈溶液,涡旋振荡3 min,使蛋白充分沉淀,于4 ℃的离心机中 14 000 r/min 离心10 min,取150 μL上清加入150 μL超纯水中,混合均匀后,待进样。
标准曲线的系列浓度为4、8、20、50、200、500、1 000 ng/mL;肌肉匀浆为5倍体积匀浆液,故在肌肉中的定量范围为20、40、100、250、1 000、2 500、5 000 ng/g。
1.4.4 给药鸡肌肉样品前处理 取给药肌肉匀浆液50 μL,加入5 μL乙腈,以与空白添加样品(即标准曲线)的基质保持一致,加入150 μL乙腈溶液,涡旋振荡3 min,于4 ℃的离心机中14 000 r/min离心10 min,取150 μL上清加入150 μL超纯水中,混合均匀后,待进样。
1.4.5 液相色谱串联质谱条件 UPLC色谱条件:色谱柱为waters XTerra C18(150 mm×2.1 mm,ID 5 μm);流动相A:0.1%甲酸的超纯水;流动相B:0.1%甲酸的乙腈;流速:0.5 mL/min;进样体积:10 μL;梯度洗脱条件见表1。
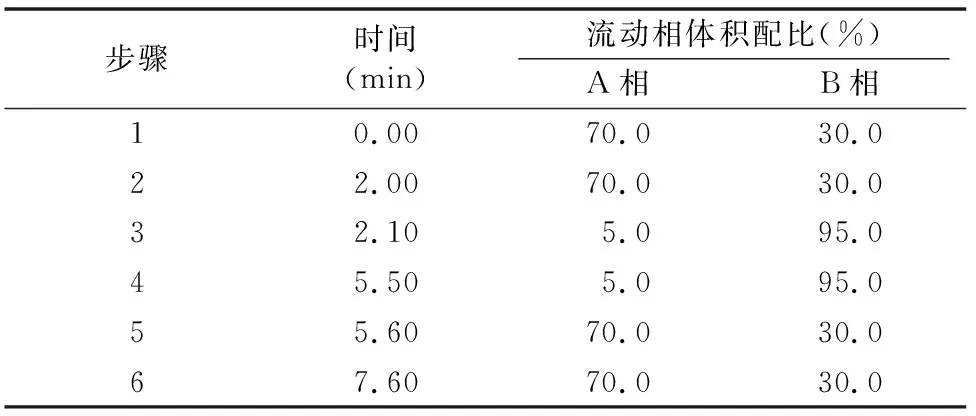
表1 梯度洗脱条件
质谱条件:电喷雾离子源(ESI),正离子模式,扫描方式:多反应监测(MRM)。质谱离子源参数:CUR:20.00,CAD:6、IS:5 500.00,TEM:500.00,GS1:50.00,GS2:60.00,ihe:ON。4种化合物质谱参数见表2。质谱采集与分析软件:Analyst 1.4.2。
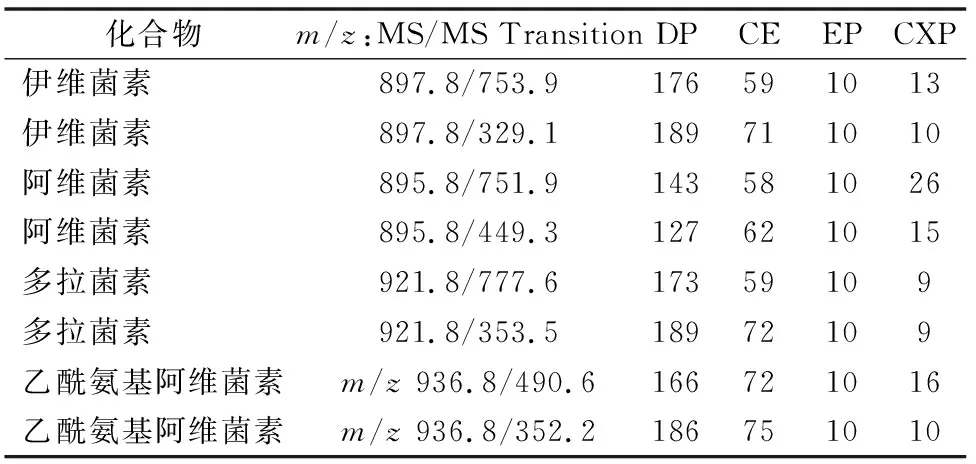
表2 4种化合物质谱参数
1.4.6 添加回收率 在空白鸡肉中,分别添加50、500、4 000 ng/g 3个质量分数水平的伊维菌素、阿维菌素、多拉菌素、乙酰氨基阿维菌素对照品,每个质量浓度水平做3个平行试验,计算4种物质的加标回收率和相对标准偏差(RSD)。
2 结果与分析
2.1 质谱条件的优化
伊维菌素中B1a含量高,其准确分子量为874.5;阿维菌素中B1a含量高其准确分子量为872.5;多拉菌素中B1b含量高,其准确分子量为898.5;乙酰氨基阿维菌素中的B1a的含量高,其准确分子量为913.5。
预先配制100、500、1 000 ng/mL的3个质量浓度的伊维菌素、阿维菌素、多拉菌素以及乙酰氨基阿维菌素的标准溶液以流动注射的方式在正离子模式下进行一级质谱母离子全扫描,分子离子m/z分别为897.8、895.8、921.8、936.8,均为[+Na+]的分子离子峰,其中500 ng/mL的分子离子响应在106计数/s附近,即为最佳优化浓度,故以500 ng/mL的浓度在正离子模式下进行自动优化确定最高以及次高响应的二级离子m/z以及相应DP、CE、CXP 3个参数,具体见表2。最终优化ESI源的碰撞电压、离子化温度、气帘气等参数。本研究中为保证4个化合物在同样的分析条件下,信号接近,在最终定量分析时伊维菌素、阿维菌素、多拉菌素、乙酰氨基阿维菌素选用的离子对分别为897.8/753.9、895.8/751.9、921.8/777.6、936.8/490.6。
2.2 色谱条件的优化
伊维菌素、阿维菌素、多拉菌素、乙酰氨基阿维菌素属于弱极性化合物,极易溶解于甲醇、乙腈,故此方法的建立选用反相色谱柱。本研究以含0.1%甲酸的超纯水作为水相,0.1% 甲酸能促进分子的电离,大大增强检测信号的强度;以乙腈作为有机相,随着有机相比例的提高,目标物保留时间缩短,但色谱峰比较宽,灵敏度会随之降低,若提高流速则保留时间太短分离效果比较差,故最终选择梯度洗脱,以相对高的流速低比例的有机相作为起始流动相,既能在合适的时间内将4个化合物很好地分离,同时又提高了分析效率以及检测的灵敏度。
2.3 样品的提取
在动物组织样品中,阿维菌素类药物提取的常用溶剂为乙腈、甲醇、丙酮、甲苯和乙酸乙酯等。本试验使用较为简单的乙腈蛋白沉淀法,过程提取回收率约95%,符合要求,且步骤简单,能大大提高样品前处理的效率。
2.4 方法的线性范围、定量限和检测限
按“1.4.3”方法处理标准工作曲线,进样10 μL,在本方法所确定的试验条件下,利用Analyst 1.4.2软件进行数据的采集与分析。以质量分数为横坐标x、峰面积为纵坐标y进行线性回归,权重因子为1/x2,测定20 ng/g加标空白样品4种药物定量离子信噪比,并用外推法计算最低检出限,结果表明4种阿维菌素类药物残留在20~5 000 ng/g的范围内呈较好的线性关系(图1至图4),得到4种药品的线性方程、相关系数、线性范围、检出限、定量限(表3)。定量下限的信噪比分别为15.5、26.0、18.5、19.0,参见图5至图8,符合信噪比(RS/N)>10作为定量下限的要求。
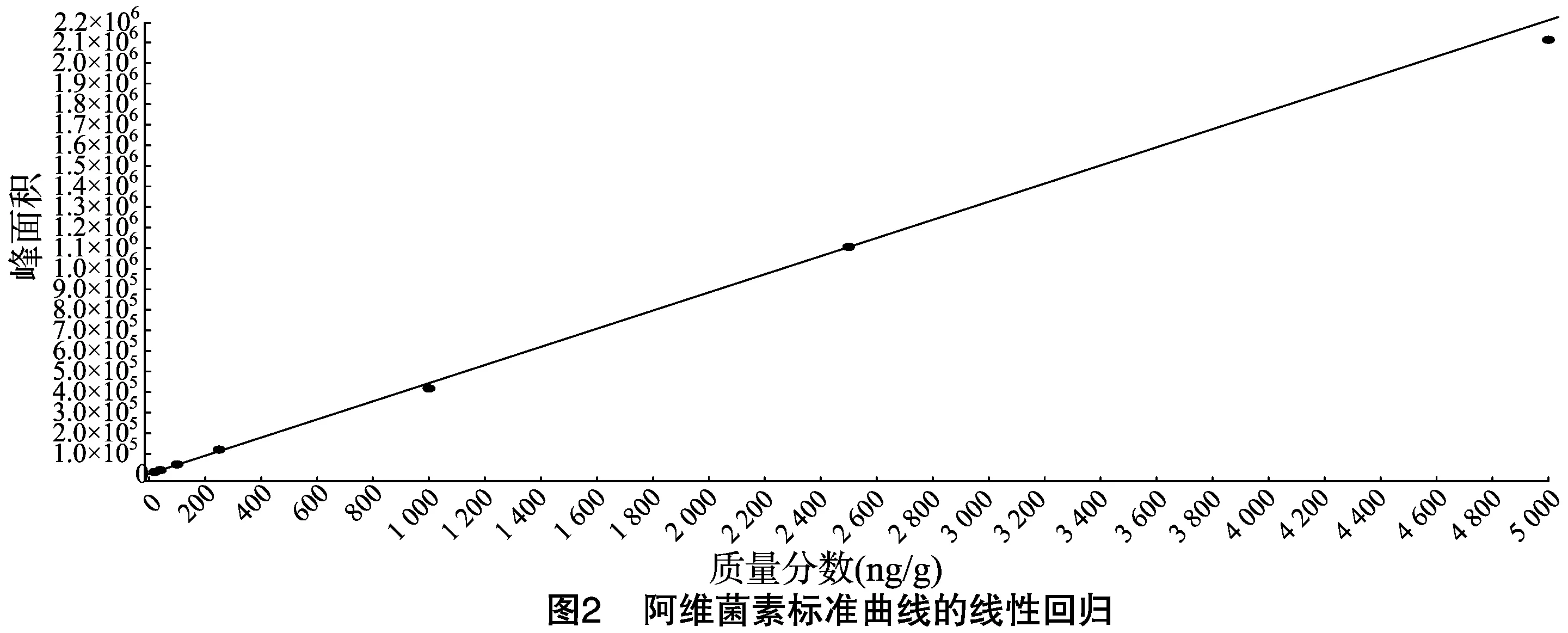
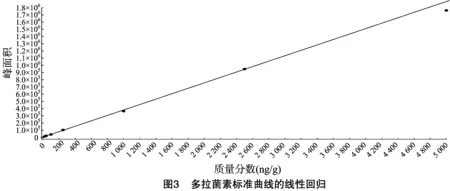
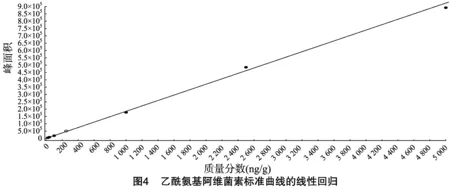
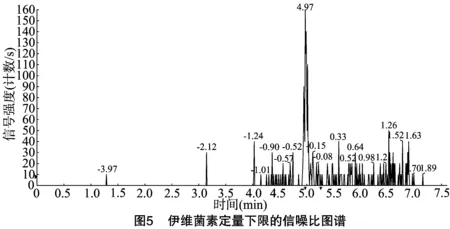
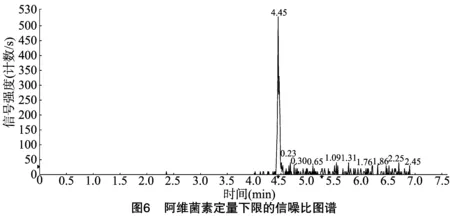
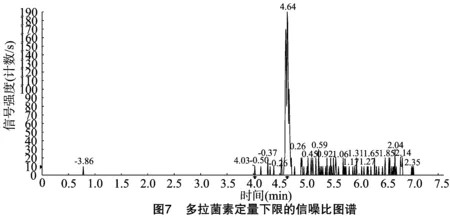
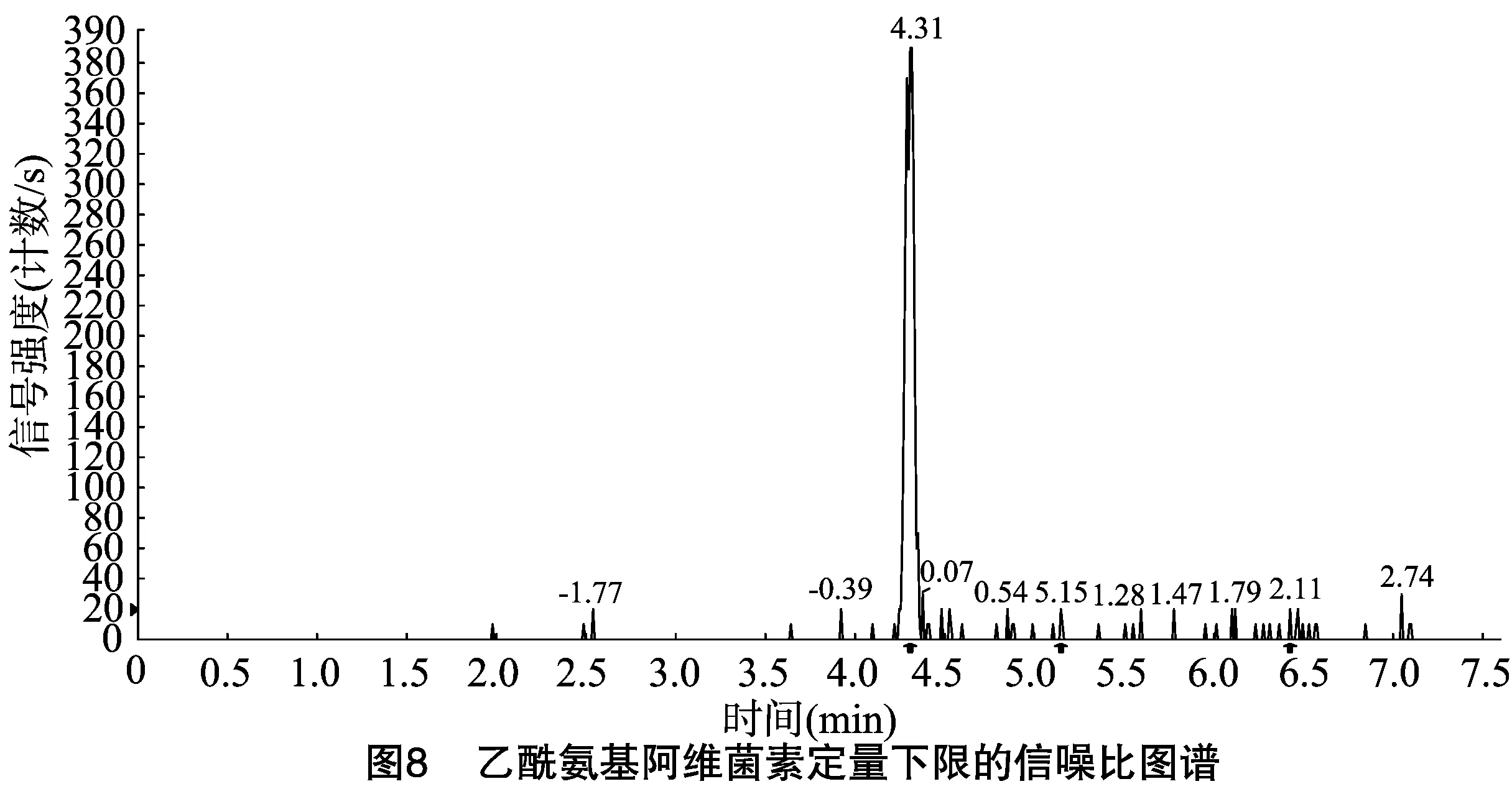
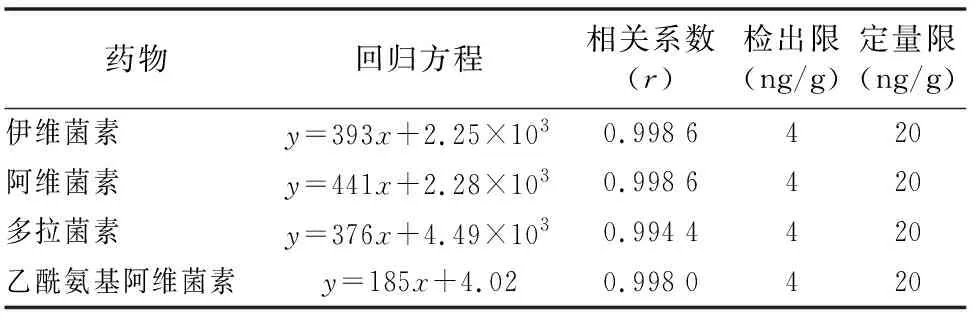
表3 4种阿维菌素类药物的标准曲线回归方程、相关系数、检出限及定量限
2.5 添加回收率
4种药物在50、500、4 000 μg/g添加水平下,平均回收率在92.89%~94.68%之间,RSD在1.26%~1.94%之间,说明本方法可以满足鸡肉中同时检测伊维菌素、阿维菌素、多拉菌素和乙酰氨基阿维菌素的要求,方法回收率和相对标准偏差见表4。
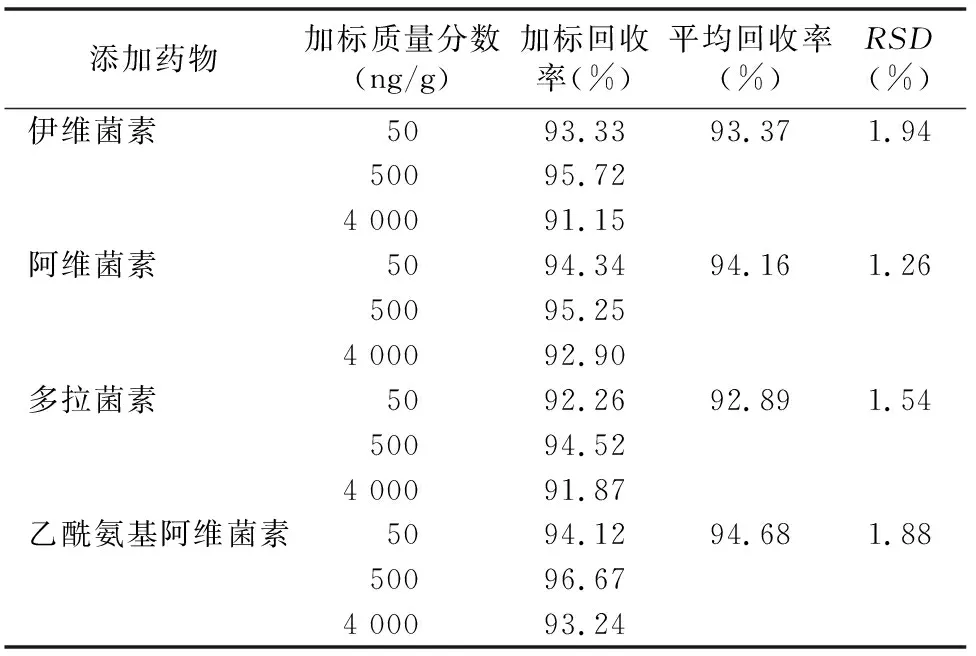
表4 伊维菌素、阿维菌素、多拉菌素、乙酰氨基阿维菌素的加标回收率
2.6 给药动物肌肉中药物浓度的测定
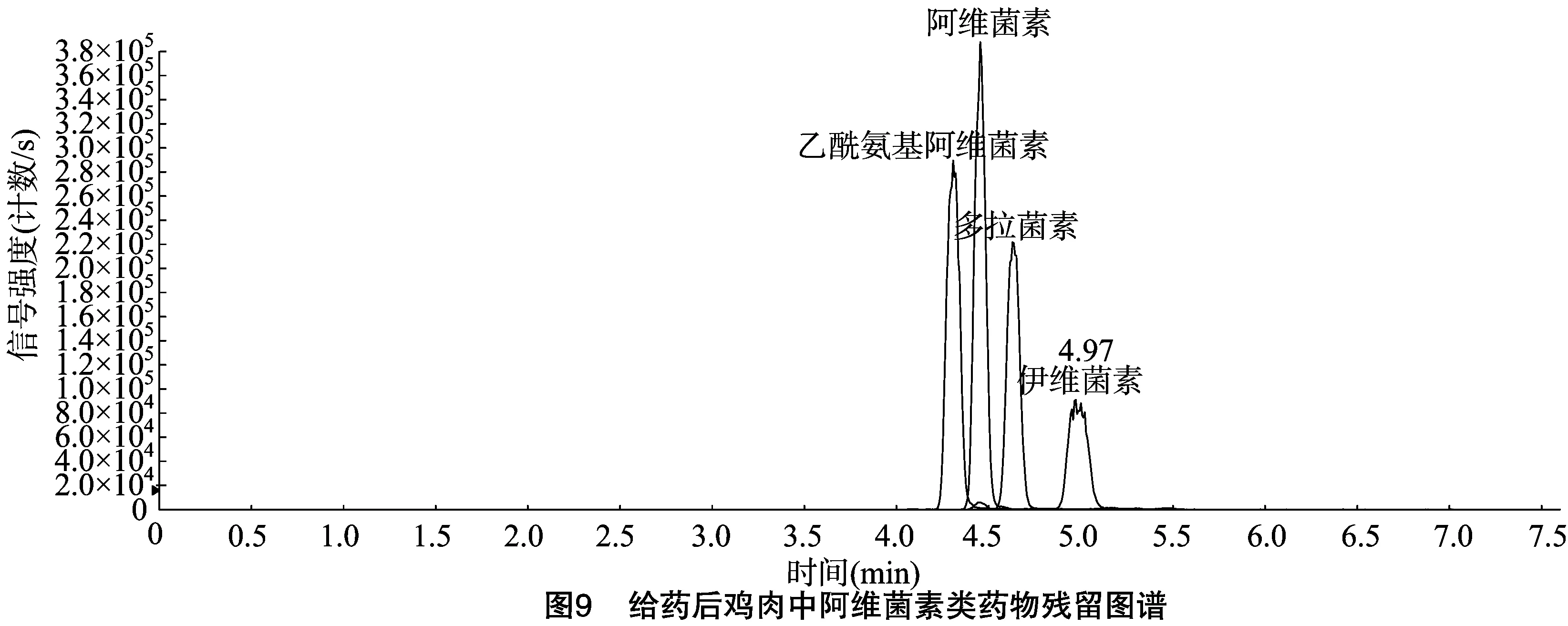
给药样品经处理后进样,利用Analyst 1.4.2软件计算得到鸡肉样品中伊维菌素、阿维菌素、多拉菌素、乙酰氨基阿维菌素的平均质量分数分别为126、105、134、141 ng/g(图9)。
3 结论
有关鸡肉中阿维菌素类药物残留检测报道很少, 但在其他有关动物组织中阿维菌素类药物残留检测方法报道很多,如李欣等采用UPLC-MS/MS建立牛肝中阿维菌素类药物的多残留检测方法,以乙腈提取、氮气吹干、疏水的甲基丙烯酸丁酯-乙二醇二甲基丙烯酸酯整体柱作为固相萃取介质,其平均回收率在77.4%~98.4%[8],而本法仅取0.2~0.5 g样品,经50%乙腈高速匀浆后,取50 μL匀浆样品,加入5 μL乙腈离心去蛋白,无需脱脂和固相萃取等操作,且无需氮吹浓缩。本方法操作简单,出峰时间在4~5 min,分析快速,且方法的最低检测限低于联合国食品法典委员会(CAC)和我国对该类化合物的残留限量10 ng/g。本研究建立的UPLC-MS/MS检测禽肉中伊维菌素、阿维菌素、多拉菌素、乙酰氨基阿维菌素残留检测方法回收率、准确率高,能完全满足禽肉中阿维菌素类药物的残留检测与确证的需要。

