甜瓜雄性不育系不同发育时期雄蕊转录组分析
戴冬洋 袁丽伟 盛云燕 郑群
(1. 石河子大学农学院,石河子 832003;2. 河北旅游职业技术学院,承德 067000;3. 黑龙江八一农垦大学农学院,大庆 163319)
甜瓜(Cucumis melo L.)是我国重要的经济作物之一,在我国有广泛的种植面积。甜瓜具有较强的杂种优势,在生产中需要人工去雄,但是容易造成花期损伤及产量下降。而雄性不育的出现,就避免了人工去雄的复杂工序,节省人力物力。因此研究甜瓜雄性不育的产生机制,对甜瓜生产具有重要的实践意义。许多研究者在大白菜[1]、甘蓝[2]、水稻[3]、大豆[4]等作物开展了广泛的雄性不育相关研究,取得一定的研究进展。Nonomoura等[5]在研究水稻雄性不育时发现,PAIR系列基因与同源染色体的配对有关;Nonomoura等[6]还发现MSP1和花粉母细胞的发育有关,当PAIR和MSP1发生突变会导致雄性不育的发生。花粉母细胞在减数分裂前形成细胞壁的主要成分是胼胝质[7];李彦龙等[8]在研究枸杞胼胝质酶基因在雄性不育中表达时发现,LG1的沉默与枸杞的败育有关;Jung等[9]研究表明水稻的Udt1缺失会使次级壁细胞不能正常分化成为成熟的绒毡层细胞,影响孢子母细胞减数分裂,从而导致雄性不育的发生;Shi等[10]指出水稻雄性不育突变体dpw的分离和特征,包括花药发育缺陷和伴有外壁异常的花粉粒退化,拟南芥中CER6/POP1与花粉外壁的发育及含油层结构有关[11];花药开裂是释放花药的重要过程,樊新萍等[12]在拟南芥中发现,MYB26/MALE STERILE35(MS35)雄性不育基因调控药室内壁次生加厚的发育,影响花药开裂。近年来,研究雄性不育的手段从形态学的观察到物质含量的积累,再到现在较为热门的基因分子方面,研究者从不同的角度深入研究雄性不育,这使得转录组测序变成了研究的主流。通过转录组测序,筛选和预测导致雄性不育的相关基因,很多学者从转录组测序研究植物雄性不育的分子机制,为研究植物雄性不育提供依据。王娇[13]通过转录组测序技术和代谢相关数据分析,推测出苯丙素、黄酮类物质合成受阻、代谢加快可能是导致104-7A棉花细胞质雄性不育形成的原因;Liu等[14]通过转录组测序技术,研究葱细胞质雄性不育与线粒体的氧化磷酸化有关;Guo等[15]通过转录组测序技术,研究卷心菜细胞核雄性不育则主要涉及ATP合成酶。早在1928年就有学者利用甜瓜进行性别分化的研究,但是近二十年未见相关报道。随着科技的发展,研究手段的不断更新,对甜瓜雄性不育的研究日趋深入。盛云燕等[16]通过甜瓜雄性不育系MS遗传规律的研究发现,雄性不育系MS为1对隐性基因控制的细胞核雄性不育。然而,目前对甜瓜雄性不育的研究大多停留在生理指标和田间表型性状的研究上,甜瓜雄性不育的分子机制,一直鲜有报道,与其他大田作物相比,甜瓜雄性不育相对滞后。本研究通过选择雄性不育系MS花蕾不同直径发育(2和5 mm)时期雄蕊作为试验材料,分析在不同雄蕊发育时期的差异表达基因,为探究甜瓜雄性不育发生机理提供依据。
1 材料与方法
1.1 材料
采用的雄性不育MS为厚皮甜瓜,其雄性不育类型为1对隐性基因控制的细胞核雄性不育[18]。根据王强等[17]认为甜瓜花期雄蕊分化的关键时期为雄蕊直径为2—5 mm,选择甜瓜雄性不育系MS 2和5 mm直径大小雄蕊,分别取10株,并分别混合放入液氮中保存备用。
1.2 方法
1.2.1 RNA的提取 选择甜瓜雄性不育系MS的2和5 mm花蕾直径大小雄蕊,采用天根生化科技(北京)有限公司生产的RNAprep Pure多糖多酚植物总RNA提取试剂盒提取样品总RNA。分别采用Nanodrop、Qubit 2.0和Aglient 2100方法检测RNA样品的纯度、浓度和完整性等,以保证使用合格的样品进行转录组测序。
1.2.2 转录组测序 采用Hiseq 4000进行高通量测序,测序读长为PE 150 bp,测序工作由北京百迈客生物科技有限公司完成。对雄性不育系不同时期雄蕊进行测序,每个样本3次重复。将下机数据进行过滤得到Clean Data,与指定的参考基因组进行序列 比 对:https://melonomics.net/files/Genome/Melon_genome_v3.5.1/,得到Mapped Data,通过blast数据库http://blast.ncbi.nlm.nih.gov/Blast.cg将获得的序列进行比对;分析比对所得基因注释、基因功能,所用数据库为蛋白数据库Nr(ftp://ftp.ncbi.nih.gov/blast/db/、http://www.uniprot.org/)、Pfam 数据库(http://pfam.xfam.org/)、KEGG 序列比对数据库(KyotoEncyclopedia of Genes and Genomes database)和 COG(http://www.geneontology.org)(e-value约 0.00 001)。
根据基因在不育系MS的2和5 mm直径大小雄蕊中表达量进行差异表达分析,以log值>3或者log值<-3为标准获得差异表达基因,并对差异表达基因功能注释和功能富集等表达水平分析。
1.2.3 差异表达基因的qRT-PCR验证 采用天根生化科技(北京)有限公司生产的RNAprep Pure RNA提取试剂盒,提取混合样本RNA。RNA浓度大于100 ng/μL,A260/A280比值大于1.8,使用TOYOBO公司反转录试剂盒获得cDNA。以12个差异表达基因序列为模板,Primer5软件设计引物,引物序列由上海生工生物公司合成qRT-PCR在黑龙江八一农垦大学生物技术中心完成。基因名称及qRT-PCR信息如表1所示。

表1 差异表达基因qRT-PCR验证引物信息
2 结果
2.1 测序结果分析
利用HiSeq4000测序技术对甜瓜雄性不育系2 mm和5 mm大小的雄蕊进行转录组测序,1/8的测序反应,雄性不育两用系2 mm大小雄蕊平均获得24 235 823 Clean reads,比对到参考基因组为35 888 838,占Clean reads 74%,比对到参考基因组唯一位置的Reads数目位35 713 443占所有reads的73.64%,雄性不育系2 mm大小的雄蕊测序数据观察平均含量为44.14%。雄性不育系5 mm大小的雄蕊平均获得28 694 291 Clean reads,比对到参考基因组为42 608 932,占Clean reads 73.89%,比对到参考基因组唯一位置的Reads数目位42 381 811占所有reads的73.49%,雄性不育系5 mm大小的雄蕊测序数据观察平均含量为44.09%(表2)。
2.2 GO功能分析
分析比较甜瓜雄性不育系2和5 mm雄蕊的差异表达基因,并进行GO功能分析。比较分析发现,以Log>3或者Log<-3为标准,共有224个基因差异表达,116个基因下调,108个基因上调;GO功能分类发现,80条Unigenes归入到生物学过程,75条Unigenes归入到细胞学过程,69条Unigenes归入到分子功能(图1)。
2.3 差异表达基因分析
将皮尔逊相关系数r作为生物学重复相关性的评估指标[19]。r2数值越大,说明2个重复样品相关性越强。不育系MS 2 mm样本(T1、T2和T3)与不育系MS 5 mm样本(T4、T5和T6)重复性(图2)。全部样本3次重复之间r2值均大于0.8,由此可见在雄性不育系MS 2 mm大小的雄蕊样本与雄性不育系MS 5 mm大小的雄蕊样本,相关性较高,其间的基因表达变异程度较低。
雄性不育系MS 2 mm大小的雄蕊(T1、T2和T3)与雄性不育系MS 5 mm大小的雄蕊(T4、T5和T6)样本对筛选出的差异表达基因按照具有相同或相似表达模式的进行聚类分析,共分为69类,其中第2类和第3类的差异表达基因极为显著,在第2类中有5个差异表达基因,第3类中有15个差异表达基因。在这些差异表达基因主要参与多种酶活性、脂质代谢过程、细胞信号传导等过程相关性显著(P>0.001),说明雄性不育的发生过程中与多种酶活性,脂质代谢过程,细胞信号传导等过程正调控2个过程存在相关性(图3),在多种酶活性,脂质代谢过程,细胞信号传导等过程雄性不育MS 5 mm大小雄蕊样本均低于雄性不育MS 2 mm大小雄蕊样本的表达量。(图3-b1、图3-c1),从图中亦可看出各样本3次重复间差异不显著。
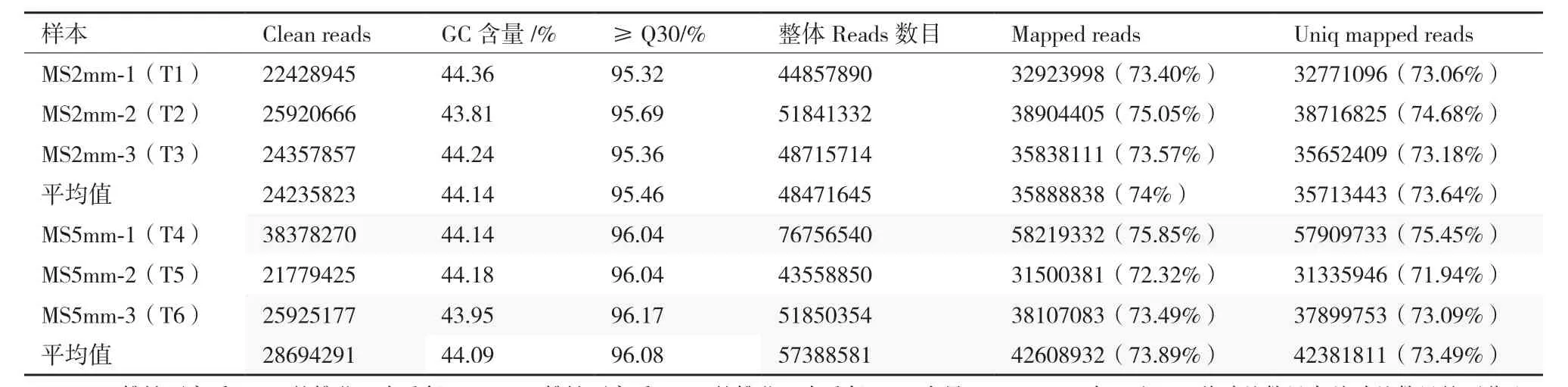
表2 甜瓜雄性不育两用系测序数据
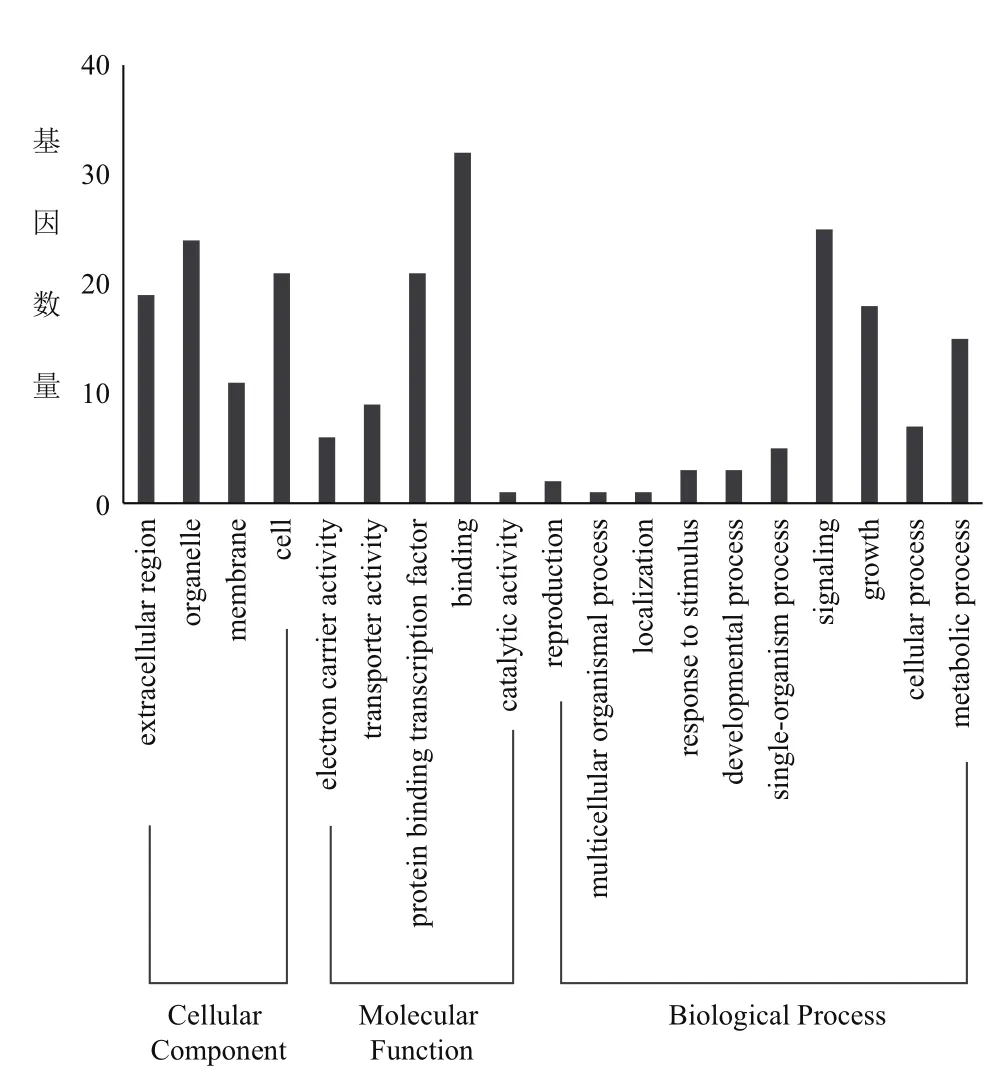
图1 甜瓜雄性不育系不同阶段雄蕊的差异表达基因GO功能分析
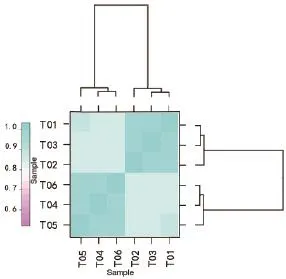
图2 测序样本3次重复之间相关性热图
2.4 甜瓜雄性不育差异表达基因的合成途径
差异表达基因主要参与了玉米素生物合成途径(ko00908)、戊糖和葡萄糖醛酸盐相互转化途径(ko00040)、淀粉和蔗糖代谢途径(ko00500)和半胱氨酸和蛋氨酸代谢途径(ko00270)。差异表达基因MELO3C012098参与玉米素生物合成途径,该基因在雄性不育MS 5 mm中表达下调;差异基因MELO3C015289参与戊糖和葡萄糖醛酸盐相互转化途径和淀粉和蔗糖代谢途径,该基因在雄性不育MS 5 mm中表达上调;差异基因MELO3C019735参与了半胱氨酸和蛋氨酸代谢途径(图4),该基因在雄性不育MS 5 mm中表达上调。
差异表达基因MELO3C012098参与玉米素生物合成途径,该基因在异戊烯基-ATP转化反式玉米素三磷酸山梨糖醇酯、异戊烯基-ADP转化反式玉米素山梨糖苷二磷酸酯、异戊烯基-AMP转化反式玉米素山梨糖醇单磷酸酯过程中表达为下调基因,对玉米素的合成有抑制作用。差异基因MELO3C019735在半胱氨酸和蛋氨酸代谢途径中1-氨基环丙烷-1-羧酸合成乙烯中的调节基因,该基因在合成乙烯过程中为上调基因,促进了乙烯的生物合成。
2.5 qRT-PCR验证
根据差异表达聚类图中差异显著性进行筛选,其中12个差异极显著的基因进行qRT-PCR验证,结果显示,与多种酶活性相关的基因有9个,其中MELO3C000409、MELO3C021686、MELO3C026842、MELO3C015289、MELO3C008100、MELO3C006719这6个基因均显示雄性不育株MS 2 mm大小雄蕊的表达量小于雄性不育系MS 5 mm大小雄蕊的表达量。表达量相差最小的基因是MELO3C026842,MS 5 mm大小雄蕊的表达量是MS 2 mm大小雄蕊的表达量的2倍;编号MELO3C006719基因的表达量,MS 5 mm大小雄蕊的表达量高于MS 2 mm大小雄蕊的表达量近20倍之多。而细胞信号传导相关的基因MELO3C007725(基因注释为细胞周期相关蛋白基因)则表现出相反趋势,MS 2 mm大小雄蕊的表达量高于MS 5 mm大小雄蕊的表达量约为7倍,由此可推测出在甜瓜雄性不育发生时,细胞周期蛋白相关基因的表达量减少,从而影响细胞间的信号传导,可能会是发生花粉败育(或雄性不育)因素之一。
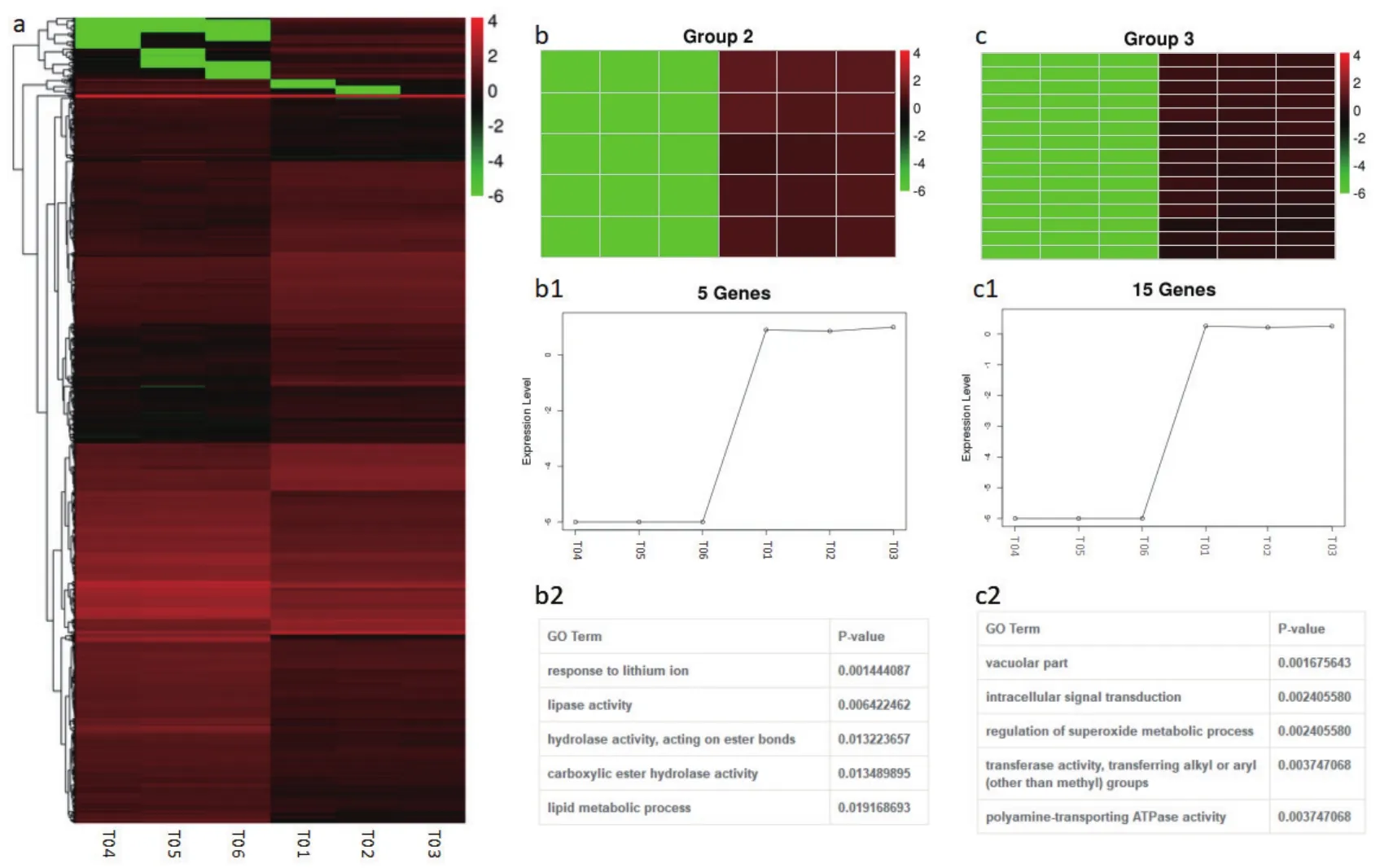
图3 甜瓜雄性不育系不同时期雄蕊的差异表达基因聚类图
3 讨论
3.1 转录组测序时期的选择
植物的性别发育,是由多种因素影响的,这分为内部因素和外部因素。而植物性别发育中的雄性性别的分化关键期处于小孢子发育阶段[17]。本研究根据王薇薇等[18]将小孢子发育的四分体时期确定到2 mm时期的研究结果,结合本课题组前期的研究,将雄性不育研究的转录组测序时期确定为2和5 mm,分别为花粉发育的四分体时期和花粉成熟期。前人通过大量研究,均证明小孢子发育受阻与其雄性不育存在一定的相关性[19-22],因此本研究通过前期对不同发育时期雄蕊的细胞学观察结果,选择雄蕊直径为2和5 mm阶段为本研究的重要时期,确保了转录组测序研究结果的准确性。
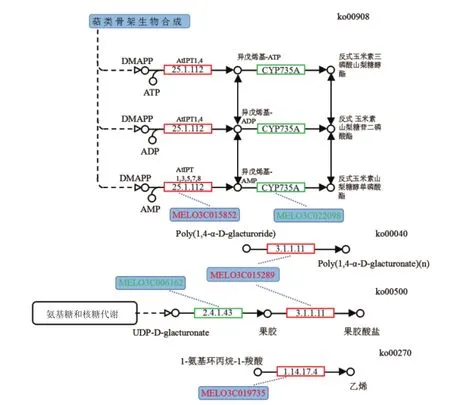
图4 甜瓜雄性不育基因参与植物激素类合成途径
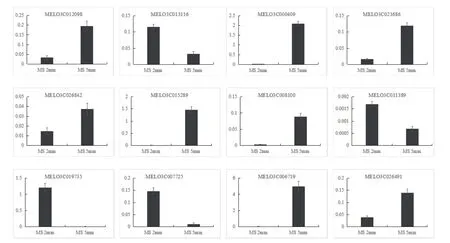
图5 差异表达基因的qRT-PCR验证
3.2 酶与雄性不育
本研究共发现224个差异表达基因,其中与各种酶类相关的差异基因为9个,包含长链醇O-脂肪酰基转移酶相关基因、碳水化合物酯酶相关基因、葡萄糖基转移酶相关基因、羧酸酯酶相关基因、GDSL酯酶/脂肪酶相关基因及木葡聚糖内转葡糖基酶相关基因等;其中与细胞信号传导相关的差异基因有1个,为细胞周期蛋白相关基因。这些基因除细胞周期蛋白相关基因和GDSL酯酶/脂肪酶相关基因在雄性不育株MS 5 mm中表达下调,其他酶类相关基因均在雄性不育株MS 2 mm中表达上调。这些基因主要参与了能量相关代谢途径,同时在物质合成与转运、碳水化合物代谢、物质转化等方面也具有一定功能,这些生物途径与植物发育息息相关[23]。
3.3 玉米素与雄性不育
本研究差异表达基因参与的另一个重要途径为玉米素生物合成途径,玉米素是植物体内天然存在的细胞分裂素类物质,而细胞分裂素类物质在高浓度条件下会抑制组织呼吸、离体线粒体的抗氰呼吸及总呼吸[2425]。呼吸作用的减弱,必然引起植物体内能量代谢紊乱,从而引发小孢子发育异常或雄性败育的发生[22]。在白薇等[26]对甜菜不育系及O型系的激素含量研究表明,在营养生长阶段玉米素含量为不育系高于保持系。本研究表明,玉米素生物合成相关基因,在雄性不育MS 2 mm中表达量低于在雄性不育MS 5 mm中的表达量。这表明在甜瓜花芽分化期雄蕊直径为2-5mm大小的关键时期[17]中MELO3C012098基因的表达量增高,影响呼吸作用,能量供应过少,导致不育[27]。
3.4 碳水化合物与雄性不育
淀粉和蔗糖均是植物性别分化时期必要的营养物质,在郭丽娟等[20]研究中认为茄子花药中可溶性糖和淀粉含量随着花药不同发育阶段而变化,在减数分裂阶段,不育系植株处于较低水平,而保持系则出现一个淀粉积累的高峰。本研究淀粉和蔗糖代谢途径中的相关基因在雄性不育MS 5 mm中的表达呈现下调趋势,营养物质的缺少,导致能量代谢缓慢或是紊乱,均可能导致雄性败育的发生。
4 结论
获得224个差异表达基因,且差异极显著表达基因中酶类相关的差异基因为9个,细胞信号传导相关的差异基因1个。雄性不育的发生与小孢子发育过程中能量代谢相关基因的表达量的上升和细胞信号传导相关表达基因表达量的减少存在相关性。

