鳜不同孵化时期miRNA转录组分析及生长相关miRNA鉴定
赵岩 曹晓颖 周昊天 宋凌元 涂翰卿 黄思颖 赵金良
(1. 上海海洋大学农业部淡水产种质资源重点实验室,上海 201306;2. 上海海洋大学水产动物遗传育种中心上海市协同创新中心,上海201306;3. 上海海洋大学水产科学国家级实验教示范中心,上海 201306)
鳜(Siniperca chuatsi)属硬骨鱼纲、鲈形目(Perciformes)、鮨科(Serranidae)、鳜属(Siniperca),俗称季花鱼、桂花鱼,其肉质细嫩、营养丰富、没有小刺,是我国传统淡水名贵经济鱼类。自20世纪80年代以来,鳜人工繁殖技术的突破推动了其养殖业的发展。目前鳜产业年产值超200亿元,但在养殖过程中也存在品种退化、病害频发等问题,鳜良种选育仍然是提高其产量和品质的首要途径。
成熟的microRNA(miRNA)是一类20-24 nt的非编码小分子RNA,其在进化和功能上均具有保守性[1]。通常,miRNA与靶基因mRNA的3′端非编码区(3′-untranslated region,3′-UTR)不完全互补配对结合,引起靶基因mRNA的降解,从而负调控靶基因的表达,即在转录后水平上影响表型[2]。miRNA的发现和技术的成熟,丰富了人们对蛋白质合成控制的认识,补充了在RNA水平对靶mRNA进行更有效调节的机制,展现了细胞内基因表达调控全方位、多层次的信号网络系统。
miRNA的研究对象遍及动物、植物和微生物,且miRNA几乎参与从生物胚胎发育到死亡的生命阶段所有的生物过程[3]。miRNA在水产动物(鱼、虾、蟹、贝)中也有研究报道,如miR-430在斑马鱼胚胎发育阶段的表达和功能[4]。有关鳜miRNA的研究起步较晚,数量也较少,可分为miRNA转录组和单个miRNA两类研究。迄今为止,通过高通量测序研究鳜miRNA转录组的报道有3篇:第一篇见于2013年,该研究以翘嘴鳜红肌(慢肌)与白肌(快肌)为研究对象,发现了186个保守和3个新miRNAs,在两种肌肉纤维中存在60个显著差异表达miRNA[5];以饲养6个月后的慢长和快长翘嘴鳜为研究对象,混合大脑、脑垂体、肝脏和肌肉样本,发现252个已知miRNAs和12个新miRNAs,其中36个miRNAs在组间表达差异显著[6];以孵化后第30天的慢长和快长翘嘴鳜肌肉为材料,鉴定出 433 个保守 miRNAs,组间 8 个差异 miRNAs[7]。就单个miRNA而言,miRNA-181a通过靶定小清蛋白(Parvalbumins,PVALBs)而影响鳜肌肉松弛率[8];miR-143可以通过调控靶基因肌分化因子(MyoD)而促进成肌细胞增殖和肌肉增生[9];对翘嘴鳜进行饥饿后再投喂,miR-10c、miR-107a、miR-133a-3p、miR-140-3p、miR-181a-5p、miR-206、miR-214[10]和 miR-222[11]的相对表达会显著上调,上述miRNAs可能与鳜鱼骨骼肌快速生长相关。此外,还发现温度升高会降低miR-146a在鳜胚胎发育各个时期的表达[12]。,
综上所述,目前关于鳜miRNA转录组的研究多以肌肉等不同组织为研究对象,鱼龄最低为孵化后30 d,研究的单个miRNA大部分与鳜鱼骨骼肌发育相关。为了深入理解鳜的发育机制,本研究以鳜孵化后第3天、第17天和第28天的全鱼为材料,通过高通量测序建立上述各阶段miRNA组,并选取miR-199-5p和miR-203b进一步分析其可能的mRNA靶基因及相关的调控通路。本研究首次了解鳜孵化后前30 d内miRNAs表达特征、可以为深入了解miRNA对鳜胚胎发育过程的调控作用奠定基础、丰富有关miRNAs和靶基因间作用的认知,也可为鳜分子标记辅助育种提供候选基因。

图1 孵化后D3、D17和D28鳜形态
1 材料与方法
1.1 材料
实验用鳜鱼苗取自上海市浦东新区孙农水产养殖场。亲鱼经激素催产、人工授精。受精卵在直径70 cm的孵化桶中孵化,水温为23-25℃。孵化当天记为第0 天(D0),分别在孵化后第3天(D3)、第17天(D17)、第28天(D28)、第60天(D60),第90天(D90)取样,每批随机取20-50尾(日龄越小取样越多)。取其中15尾D3,10尾D17、5尾D28全鱼分别混合后用于小RNA测序文库制备(图1)。其余样品用于荧光定量分析,荧光定量分析前需做如下处理:D17、D28 样本去除头、尾,D60、D90 样本采集白肌(去除鳞片后背鳍起点下背侧第一肌节区域)。另取3尾体重500 g左右的健康鳜,用MS-222 麻醉,于冰上解剖,取肝、脑、肠、白肌样本用于组织表达谱分析。所有样品分装于冻存管,迅速置于液氮中,并长期存放于-80℃冰箱备用。

表1 引物序列
1.2 方法
1.2.1 小RNA 文库的建立及测序 采用Trizol法提取样品的总RNA,使用紫外分光光度计(Eppendorf BioPhotometer)和琼脂糖/EB凝胶电泳法分别确定总RNA 的纯度和完整性。取质量较好的RNA 样品用于相关分析。采用TruSeqSmall RNA Sample Prep Kits(Illumina,San Diego,USA) 试 剂 盒 制 备 小RNA测序文库。流程如下:用T4 RNA连接酶2将腺苷化单链DNA 3′接头和5′接头连接到小RNA上,进行反转录反应,对反转录产生的cDNA序列进行PCR扩增,将140-160 bp长度范围的PCR 产物用6%polyacrylamide Tris-borate-EDTA 胶回收,完成文库的制备,对构建好的文库用Illumina Hiseq2000/2500 进行测序,测序读长为单端1X50 bp。
1.2.2 miRNA组数据分析 使用联川生物公司开发的软件处理数据。首先,清理由于样本制备、测序接头、非典型miRNA特征序列以及测序仪器光学数码处理而产生的非纯序列,保留碱基长度在18-26 nt序列。然后,将剩余序列比对RFam数据库和重复序列数据库(Repbase)以去除rRNA、tRNA、snRNA和snoRNA等。经清理、过滤后的数据称之为Valid数据并用于后续分许。鳜尚无基因组数据,故以斑马鱼基因组为参考。使用Bowtie软件与miRbase21.0斑马鱼及其他脊椎动物的己知的miRNA进行保守性分析比对,并鉴定出鳜3个不同发育时期的miRNAs。在比对分析中允许5′和3′末端长度变化以及序列内部存在一个错配的情况。用Expdiff方法两两比较并判断不同发育阶段样品中miRNA的表达量是否存在显著差异。利用维恩图(Venn diagrams)直观地显示出样品两两间共同检出的miRNA个数以及差异miRNA的个数。
1.2.3 引物设计及合成 根据鳜MyoD(Gene ID:JN561167.1)、斑马鱼 Wnt5b(Gene ID NM_130937)https://www.ncbi.nlm.nih.gov/nuccore/NM_130937。 用Primer Premier 6.0软件设计并由上海生工生物工程有限公司合成相关引物,序列见表1。
1.2.4 miR-199-5p / miR-203b组织表达谱及其在孵化后90 d内表达变化 利用定量RT-PCR检测miR-199-5p / miR-203b在肝、脑、肠、白肌及在D3、D17、D28、D60和 D90的相对表达量。
1.2.5 miR-199-5p和 miR-203b 的靶基因验证 设计并合成靶基因3′UTR 区域包含 miR -203b作用位点及突变的引物序列(表 1),上游引物插入 XhoⅠ酶切位点CTCGAG,下游引物插入 NotⅠ 酶切位点GCGGCCGC(表 1 序列中下画线部分)。PCR产物经过纯化后与 psiCHECKTM-2 载体相连后进行测序,测序正确的质粒命名为 psiCHECKTM2-MyoD-3′-UTR(wt) 和 psiCHECKTM2- MyoD-3′-UTR(mutant)。培养 293T 细胞系,将细胞接种到96 孔板中,待细胞密度达到 70%时,将miR-203b mimic 分别和 psiCHECKTM2-MyoD-3′-UTR(wt)和psiCHECKTM2- MyoD-3′-UTR(mutant)进行共转染,以 psiCHECKTM-2为对照,按 Promega 公司 Dual-Luciferase Reporter Assay System 说明书步骤检测细胞荧光素酶表达量,重复3 次。另构建miR-199-5p 靶基因质粒 psiCHECKTM2-Wnt-3′-UTR(wt)和psiCHECKTM2- Wnt-3′-UTR(mutant),实验操作同上。本实验所用 293T 细胞系、psiCHECK -2 空载体购自ATCC 生物公司(美国)。
1.2.6 Myod/Wnt在孵化后90 d内的表达变化 利用定量RT-PCR检测Myod / Wnt mRNA在D3、D17、D28、D60和 D90的相对表达量。
1.2.7 数据分析 应用荧光定量比较Ct值法(2-△△Ct法)分析各基因相对表达量。细胞试验重复处理3次,数据均以平均值±标准差表示。采用SPSS软件进行单因素方差分析(one-way ANOVA),Duncan法进行多组样本间差异显著性分析,以P<0.05作为统计意义上的显著水平。
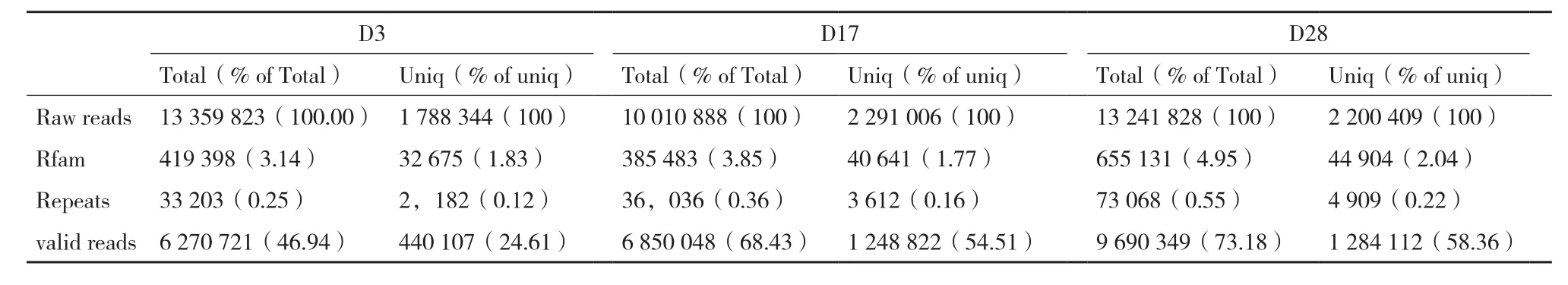
表2 小RNA文库的数据质量
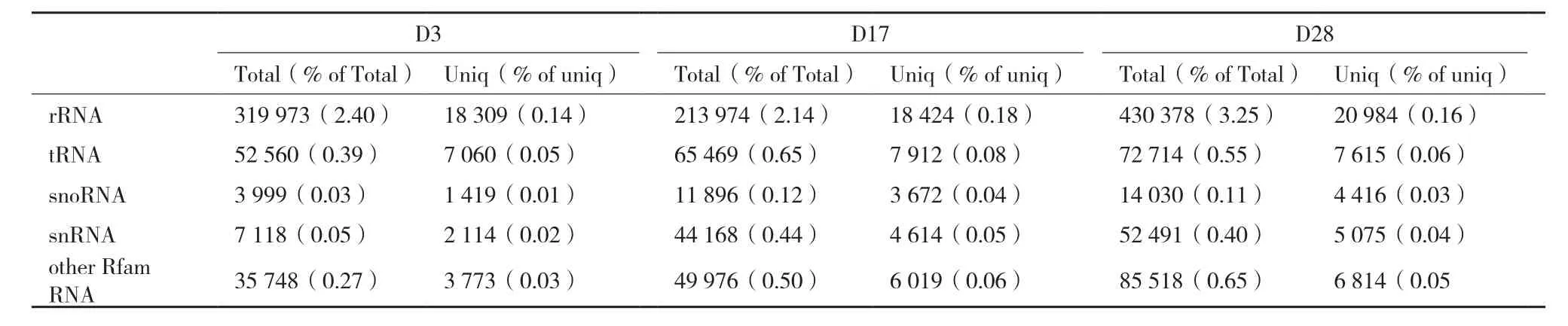
表3 与Rfam数据库比对后非miRNA的组成
2 结果
2.1 孵化后30 d内3个时期鳜miRNA转录组测序与分析
以孵化后不同发育时期(D3、D17和D28)的鳜全鱼为研究对象分别构建小RNA文库。利用高通量测序获得原始测序数据总数(Total)和原始测序种数(Unique),3个时期的测序总数分别为13 359 823、10 010 888和13 241 828,测序种数分别为1 788 344、2 291 006和2 200 409(表2)。经清理过滤得到的valid 数据总数和种数分别为6 270 721,46.94% ;6 850 048,68.43% ;9 690 349,73.18% 和440 107,24.61% ;1 248 822,54.51% ;1 284 112,58.36%(表2)。Valid数据大部分分布在20-24 nt,符合Dicer 酶切割的典型特征。和Rfam数据库比对发现的rRNA、scRNA、snoRNA、snRNA和tRNA等非miRNA序列组成,见表3。
共鉴定出1 084个miRNAs,其中已知的(known,reads既有miRbase支撑也有基因组位置支撑)miRNAs 432个,保守的(conservative,reads有miRbase支撑但pre-miRNA没有基因组位置支撑)miRNAs 624个,新的(novel,reads无 miRbase支撑但有基因组位置支撑)miRNA 28个。D17时期鉴定出的miRNA个数最多为926个,在D3和D28时期分别有763和862个。在3个发育时期都表达的有628个miRNAs,只在D3、D17和D30中表达的分别有71、104和70个miRNAs。
分别比较D17与D3,D28与D3,D28与D17两两之间的差异表达 miRNAs(P<0.1、P<0.05或P<0.01)。P<0.1时,两两之间差异 miRNAs个数分别为417,430,265(包含上调和下调);P<0.05时,差异miRNAs个数分别为391、414和243;P<0.01时,差异miRNAs个数分别为362、388和213。不同显著性p值的阈值下,D17和D3间差异miRNAs数均多于 D28和D17间差异miRNAs数。D17和D3相比,上调miRNAs明显多于下调;D28和D17相比,下调miRNAs明显多于上调(图2)。
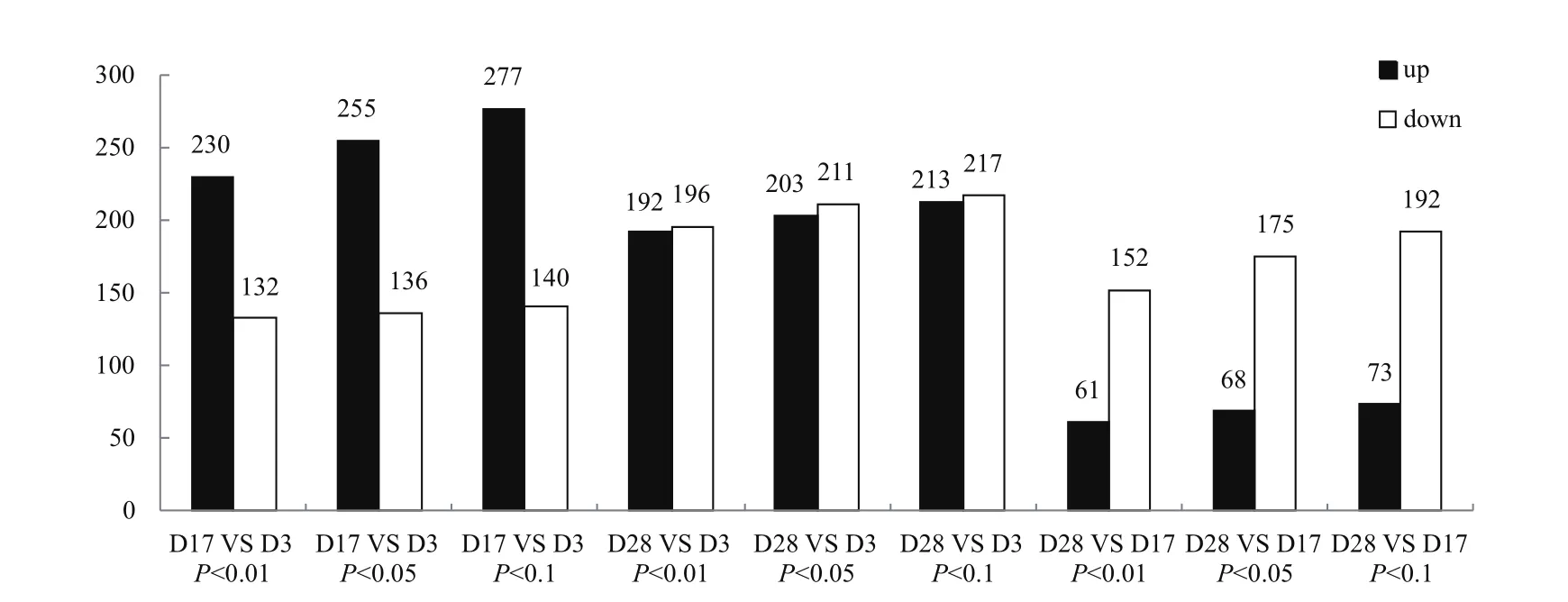
图2 不同时期两两之间的差异表达miRNAs
在众多差异表达的miRNAs中筛选统计学上差异最显著的(P value = 0)进一步分析发现,在D3到D28阶段持续下调的miRNAs有dre-miR-10d-5p,dre-miR-9-7-3p,dre-miR-10c-5p,dre-miR-222a-3p,dre-miR-26a-5p和dre-miR-199-5p。持续上调的miRNAs有 dre-miR-200c-3p,aca-miR-194-5p,dremiR-192,dre-let-7a,dre-let-7h,dre-let-7e,dre-miR-1388-5p,dre-miR-1,dre-miR-199-3-3p,dre-let-7g,dre-miR-122,dre-miR-203a和 dre-miR-203b。
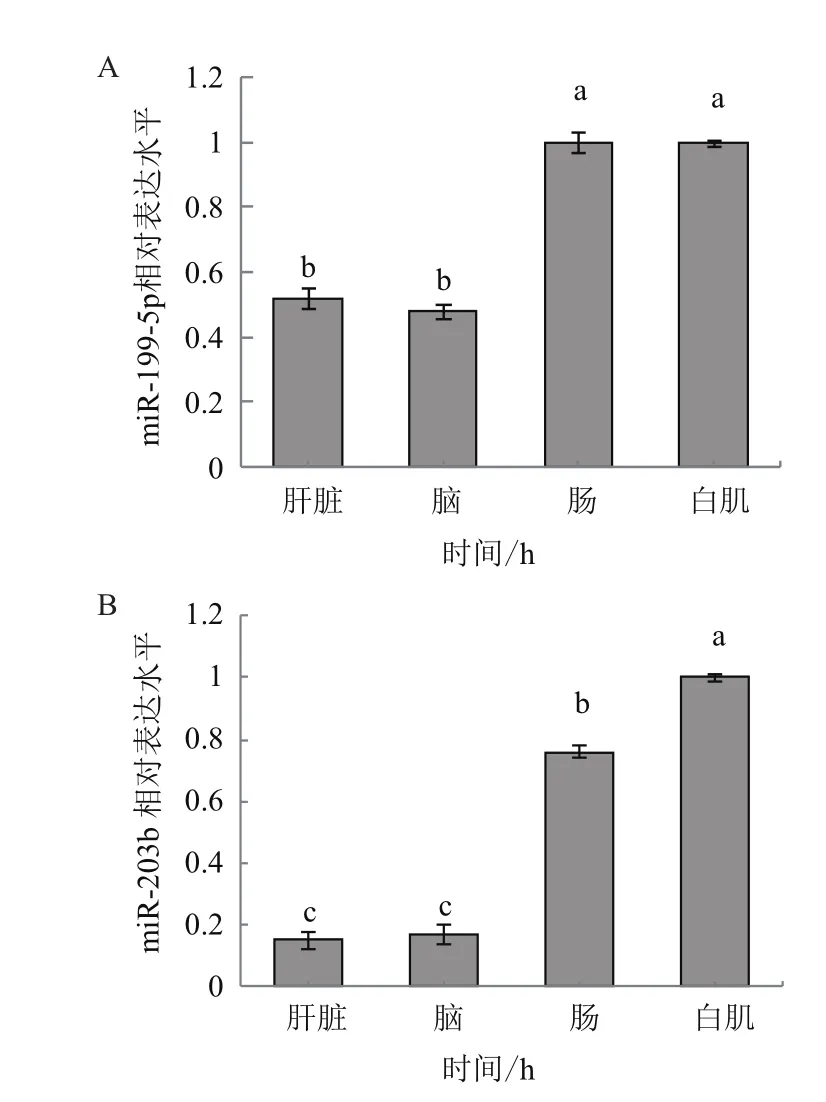
图3 miR-199-5p / miR-203b组织表达谱
2.2 miR-199-5p / miR-203b组织表达谱及其在孵化后90 d内表达量的变化
miR-199-5p / miR-203b在检测的组织中均有一定的表达,但表达丰度存在一定差异,miR-199-5p在白肌和肠道组织中的表达较高(图3-A),miR-203b在白肌中的表达最高(图3-B)。
进一步验证miR-199-5p / miR-203b与肌肉发育是否相关,利用实时荧光定量检测miR-199-5p /miR-203b在D3(全鱼),D17(躯干)、D28(躯干),D60(白肌)、D90(白肌)的相对表达情况。miR-199-5p随发育时期延续而表达逐渐减弱(图4-A)。miR-203b随发育时期延续而表达逐渐增强(图4-B)。
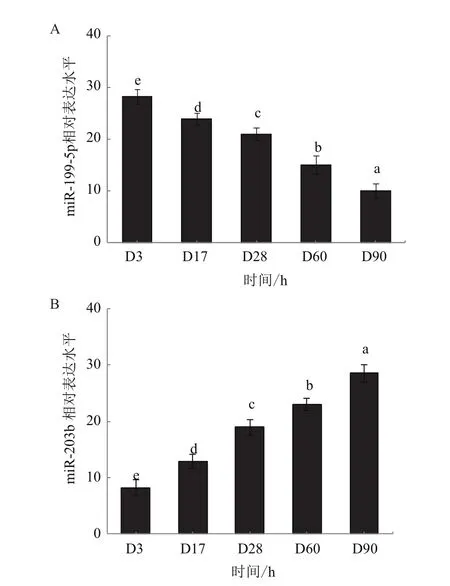
图4 miR-199-5p / miR-203b在孵化后90 d内表达变化量
2.3 miR-199-5p和miR-203b的靶基因验证
利用 TargetScan 预测miR-199-5p和 miR-203b的靶基因分别为Wnt和Myod。
与 转 染 psiCHECKTM-2 空 载 体 或psiCHECKTM2- Wnt-3′-UTR(mutant) 相 比,miR-199-5p mimic 和 psiCHECKTM2- Wnt -3′-UTR(wt)共转染时荧光素酶活性显著下降(P<0.05)(图5-A)与转染 psiCHECKTM-2 空载体或psiCHECKTM2-Myod-3′-UTR(mutant) 相 比,miR-203b mimic 和psiCHECKTM2-MyoD-3′-UTR(wt)共转染时荧光素酶活性显著下降(P<0.05)(图5-B)。
2.4 Wnt/ Myod在孵化后90 d内表达变化
Wnt mRNA 随发育时期延续而表达逐渐增强(图6-A),MyoD mRNA 在D17表达量较高,之后表达量逐渐减弱(图6-B)。
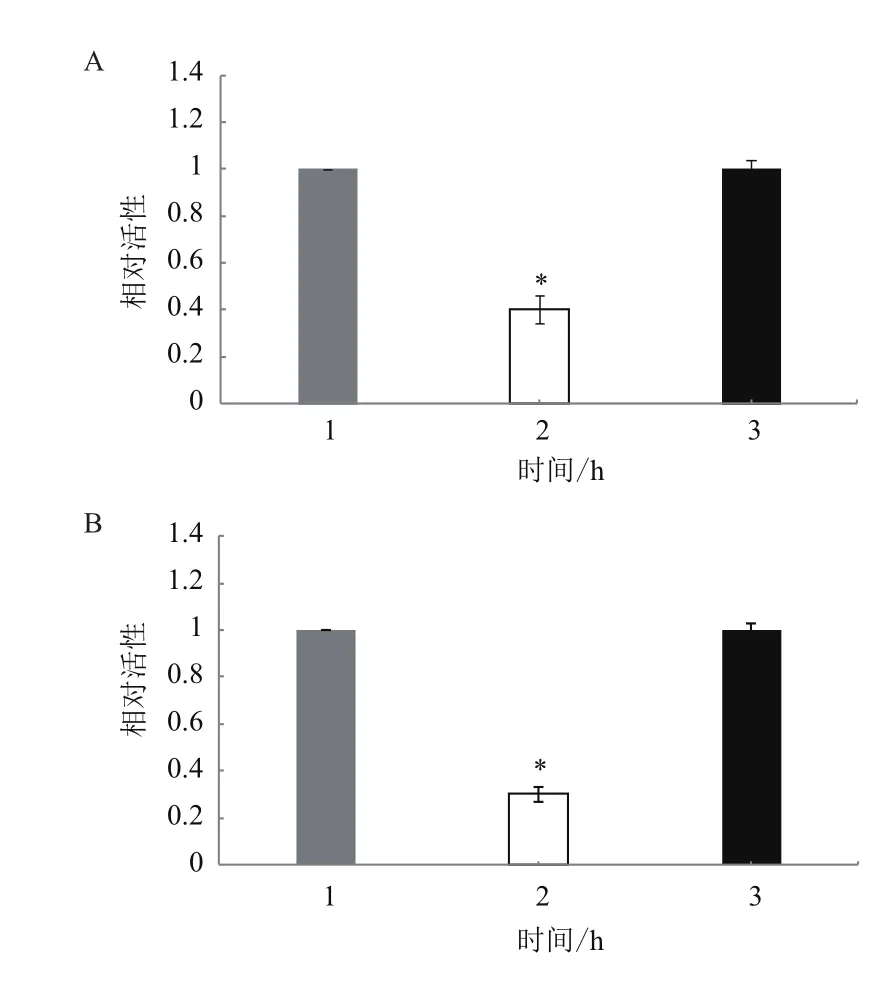
图5 miR-199-5p和miR-203b的靶基因验证

图6 Wnt/ Myod在孵化后90 d内表达变化
3 讨论
本研究利用高通量测序技术获得孵化后D3、D17和D28时期鳜全鱼miRNA转录组,经清理过滤后得到的valid 数据总数分别为6 270 721、6 850 048和9 690 349,样品间存在一定的差异,D28时期获得的数据最多,推测发育早期个体较小对文库的建立可能有一定影响。本研究中共鉴定出已知的miRNA known 432个,不同发育时期中鉴定出的miRNA个数存在明显的差异,有在3个发育时期都表达的也有只在某一时期表达的miRNAs,D17时期鉴定出的miRNA个数最多,且D17和D3间差异miRNAs数多于D28和D17间差异miRNAs数,这些充分说明生物体发育过程中miRNA对基因表达调控的时效性,也暗示了在D17时期miRNA更广泛的参与调控,相应得个体本身也可能经历着更多的发育变化。
对差异表达最显著(P value = 0)且在3个时期都表达的miRNAs进行归类,有在上述发育阶段持续下调的miRNAs(dre-miR-10d-5p,dre-miR-9-7-3p,dre-miR-10c-5p,dre-miR-222a-3p,dre-miR-26a-5p和dre-miR-199-5p),也有持续上调的miRNAs(dre-miR-200c-3p,aca-miR-194-5p,dre-miR-192,dre-let-7a,dre-let-7h,dre-let-7e,dre-let-7g,dremiR-1388-5p,dre-miR-1,dre-miR-199-3-3p,dremiR-122,dre-miR-203a-3p 和 dre-miR-203b-3p)。
已有的研究表明这些miRNAs与生物个体发育相关,如miR-10家族会和调控生物形体发育的Hox基因共表达,并对Hox的转录起到调控作用[13];miR-26调节血管平滑肌细胞的分化,并通过抑制 ctdsp2(Carboxy-terminal domain RNA polymerase II polypeptide A small phosphatase 2)而参与神经形成[14-15];miR-221可以通过靶定干细胞标志物CD117而阻止内皮细胞迁移和增生[16],此外也和血管形成相关[17];mir-200家族在上皮细胞-间充间质转化中起到重要作用,并可以维持细胞的上皮表型[18];MiR-194只在脊椎动物中被发现,其在小鼠中的靶基因是RhoB(Ras homolog gene family,member B),该基因可以调控微丝骨架重组,进而影响内耳螺旋神经元形成[19];miR-192是由p53诱导的miRNA,可以广泛的参与细胞周期调控[20],在羊骨骼肌发育过程中,miR-192可以调控羊肌肉卫星细胞sheep satellite cells(SCs)增殖和成肌分化,其靶基因是眼癌(Retinoblastoma 1,RB1)[21];miR-1388 可以抑制 GATA1(Erythroid transcription factor)和 ALAS2(Erythroid-specific delta-aminolaevulinate synthase)的表达,进而影响红细胞分化[22];miR-1属于肌肉特异性miRNA,参与调控心肌在内的多种肌肉组织的发育和生理[23];let-7 是被大家所熟知的可以控制干细胞分裂和分化时期的保守miRNA[24];miR-122在人体肝脏中随个体发育会不断增加直至成年,占到肝脏总miRNA的70%以上,是在各种组织表达最多的miRNA之一[25];MiR-199a-3p对成肌细胞分化起着非常重要的作用。抑制miR-199a-3p,肌细胞生成素(Myogenin,MyoG)、肌球蛋白重链(MyHC)表达均显著升高,肌萎缩标记基因MuRF1表达降低,同时肌管形成增加,融合指数和肌管直径升高[26]。本研究中,上述miRNAs在鳜早期发育过程中表现活跃(差异表达显著),且存在持续上调或下调的规律性表达,表明上述miRNAs参与了鳜早期发育,且在功能上可能是保守的。
在持续下调的基因中选择dre-miR-199-5p做深入分析。miR-199是一类家族,只在脊椎动物中被发现且参与调控多种发育机制,在肌肉发育调控方面,miR-199a 是重要的心肌细胞尺寸调控基因[27]。miR-199a-5p通过靶向SIRT1促进心肌纤维化相关基因表达[28];miR-199a-5p参与调控平滑肌肥大以及器官重构。抑制miR-199a-5p的表达,可以上调包括WNT2在内的诸多靶基因,进而促进膀胱平滑肌细胞增殖,同时减小细胞体积[29],Wnt 信号通路参与调控肌肉的形成与分化[30]。本实验中,鳜孵化后到D90,Wnt mRNA 表达随发育推移而持续增强。miR-199-5p在白肌和肠道组织中的表达较高,miR-199-5p随发育时期延续而表达逐渐减弱,miR-199-5p和 Wnt mRNA的表达表现为负相关,双荧光报告实验验证了Wnt 是miR-199-5p的靶基因。综上,说明miR-199-5p可能和鳜肌肉生长相关。
在持续上调的基因中选择dre-miR-203做深入分析。通常miR-203 在皮肤发育和生理过程中发挥重要调控作用。有研究表明该miRNA也和骨骼肌相关,如在鸡骨骼肌中,miR-203可以抑制细胞增殖、成肌细胞的增殖和分化,上述过程中miR-203靶基因为c-JUN和 MEF2C,c-JUN 在细胞增殖中起重要作用,而MEF2C 是肌肉发育的关键转录因子[31]。同时,miR-203可以通过调控和肌纤维肥大相关的靶基因EIF4进而影响鸡肌肉质量[32]。在罗非鱼骨骼肌中,稚鱼时期miR-203b表达低,成鱼时期高。静默miR-203b在罗非鱼体内的表达,可以导致MyoD上调,并激活下游基因。MyoD 与成肌细胞增殖和肌肉增生相关[33]。本实验中,MyoD mRNA 在D17表达量较高,之后表达量逐渐减弱,可能由于D17时期肌肉增生较快,而D28之后肌肉增生下降,转向肥大。miR-203b在鳜白肌中的表达最高,随发育时期延续miR-203b表达逐渐增强,D28之后,miR-203b和MyoD表达呈负相关,双荧光报告实验验证MyoD是miR-203b的靶基因,综上说明miR -203b可能和鳜肌肉生长相关,且在发育后期miR-203b对MyoD抑制作用更加明显。
本研究中发现的miRNAs涉及个体发育的各个方面,其中和肌肉发育相关的miRNAs较多。以往只以肌肉为材料研究鳜骨骼肌发育相关miRNA,本研究以鳜发育早期全鱼为材料建立转录组,筛选显著差异的miRNA,也能发现和鳜肌肉生长相关的候选miRNA,可能是因为在早期胚胎阶段肌肉本身所占的比例较大,取样时肌肉生长相关的候选miRNA会富集。
4 结论
本研究利用高通量测序技术获得鳜孵化后3个发育时期(D3、D17和D28)全鱼miRNA转录组,共鉴定出432个已知的miRNAs,28个新的miRNA。鳜早期发育过程中miRNA的调控作用具有时效性,表现为上述不同发育时期中miRNA个数存在明显差异,其中D17时期miRNA个数最多。一些和发育相关的miRNAs在上述时期的表达呈现持续上调或下调的特点。实时荧光定量表明miR-199-5p和miR-203b在鳜白肌中均有较高的表达,miR-199-5p /miR-203和 WnT / MyoD在一定发育时期分别表现负相关,双荧光素酶报告验证了WnT 和 MyoD分别是miR-199-5p和miR-203的靶基因。综上,miR-199-5p、miR-203可能与鳜骨骼肌肉发育相关。

