DLL4蛋白真核表达及多克隆抗体制备
金巧 甘志凯 周鹏 刘霞
(南昌理工学院,南昌 330000)
Notch信号通路最初由Morgan和Bridges于1919年通过遗传研究发现,其主要调控细胞的凋亡、增殖和分化等重要生命过程[1]。在哺乳动物中,Notch 信号通路有4个受体(Notch1、Notch2、Notch3和 Notch4) 和 5个 配 体(DLL1、DLL3、DLL4、Jagged1和Jagged2),其中2个配体Jagged1和DLL4在血管生成过程中起到重要作用,特别是DLL4,其主要在内皮细胞表达,从根本上调控肿瘤血管发生和生长[2-3]。
人源DLL4蛋白是I型单次跨膜蛋白,由658个氨基酸组成,其胞外区有与Notch 受体结合及活化的表皮生成因子(Epidermal growth factor,EGF)样的8个重复序列,1个高度保守的Delta/Serrate/LAG-2(DSL)区域和4个糖基化位点,分子量为57 kD,而胞内区在DLL4与Notch结合之后,会被剪切加工成活性位点,激活下游分子,调节基因的转录[4]。正常情况下,DLL4表达于脉管系统,如发育中的胚胎、成年组织血管新生过程中的动脉、小动脉及毛细血管的内皮细胞上,而静脉内皮细胞、血管平滑肌细胞和处于静止的血管不表达DLL4,病理情况下,可见实体瘤组织中DLL4表达量上调[5-7]。目前,在临床上,DLL4是一种新型肿瘤分子标记物,具有高敏性,可用于肿瘤预后诊断。此外,由于旧靶点抗体疗法耐药性的出现,通过阻断DLL4和Notch受体的结合抑制肿瘤血管的生成,从而达到抗肿瘤治疗效果,已成为一种新的癌症治疗策略。
本研究旨在通过HEK 293F细胞对人源DLL4胞外区蛋白进行瞬时表达,利用Dot blotting、Western blotting和Fortebio大分子互作仪检测DLL4的活性,同时制备兔子多克隆抗体,为下一步研究DLL4蛋白功能、开发临床肿瘤筛查试剂盒以及免疫治疗奠定基础。

图1 Notch信号通路配体和受体[2]
1 材料与方法
1.1 材料
人源DLL4 cDNA购自于北京义翘神州有限公司,tPA cDNA为本实验室保存,感受态DH5α购自于北京全式金生物技术有限公司。DL15 000 DNA Marker、T4 DNA ligase、生物素化试剂购自于Thermo公司;切胶回收试剂盒购自于Axygen公司;无霉毒素质粒提取试剂盒购自于Omega公司;opti-MEM、LipofectamineTM2000购自于Invitrogen 公司;兔抗人DLL4 抗体购自于Abcam 公司;PVDF 膜购自于Pall公司;ECL发光试剂购自于Millpore公司;SDS-PAGE上样缓冲液、鼠抗His标签一抗、HRP标记的羊抗兔IgG、HRP标记的羊抗鼠IgG购自于康为世纪生物技术有限公司;Bradford蛋白检测试剂盒购自碧云天公司;新生牛血清购自于四季青公司;Histrap层析填料、Equilibration Buffer、Elution Buffer购自于GE公司;链霉亲和素传感器购自于Fortebio公司;基因合成和测序由上海生工公司完成。
1.2 方法
1.2.1 细胞培养 HEK293F细胞培养于10 %新生牛血清的opti-MEM培养基中,培养温度为37℃、5%CO2,每3 d传1次代。
1.2.2 质粒构建 以人源DLL4 cDNA为模板,PCR扩增DLL4-6His基因,上游引物P1:GTG GAG CAG TCT TCG TTT CGA ACA GCT CCG GCG TCT TCC AGC TGC AGC TG,下游引物P2:GAT CGG ATC CCC TAT CAA TGA TGG TGG TGA TGG TGC GGC AAG CCC ACG GGG AAC TC。以tPA cDNA为模板,扩增tPA信号肽序列,上游引物P3:CCG AGG AAT TCG CCA CCA TGG ATG CAA TGA AGA GAG GGC TC,下游引物P4:CTG CAG CTG CAG CTG GAA GAC GCC GGA GCT GTT CGA AAC GAA GAC TGC TC。以前两步得到的DLL4-6His和tPA为模板,进行搭桥PCR,构建tPA-DLL4-6His基因片段,引物为P2和P3。PCR 反应条件 :95℃ 5 min;98℃ 10 s,55℃ 15 s、68℃ 21 s,30 个循环 ;68℃ 5 min。
用高保真EcoR I和BamH I分别对tPA-DLL4-6His基因和表达载体pGZX进行双酶切,切胶回收后,T4 DNA ligase,16℃过夜连接。然后,连接产物转化到DH5α感受态中,涂布到含有氨苄青霉素的平板上,培养过夜,次日挑取阳性克隆子并扩大培养,进行酶切鉴定和测序验证。
1.2.3 蛋白表达与纯化 转染前1 d,将HEK293F以2×105个/mL的密度铺于6孔板内,使转染时细胞融合率约为80 %,按照lipofectamine 2000转染试剂说明书进行瞬时转染,以无转染的和转染空载体的作为空白对照,转染48 h后进行SDS-PAGE检测。
在层析柱中添加Ni-NTA填料,确保填料无分层无气泡产生,然后用5倍体积的Equilibration Buffer平衡柱子,取1倍体积的蛋白粗样(经10 000×g高速离心预处理)低速上柱,30 min后,加入3倍体积Equilibration Buffer清洗柱子,除去未结合或结合不牢的蛋白,然后用Elution Buffer进行洗脱,收集洗脱液,SDS-PAGE分析。采用Bradford法进行蛋白定量。
1.2.4 Dot blotting和Western blotting 取适量蛋白粗样,直接滴加在PVDF膜上,待自然干后,用含5%脱脂奶粉的TBST进行2 h封闭,加入鼠抗His标签一抗,4℃封闭过夜,用TBST洗涤3次,每次10 min,再加入羊抗鼠带HRP的二抗,室温孵育1 h,TBST洗涤3次后,进行ECL发光检测。
取适量蛋白粗样,加入SDS-PAGE上样缓冲液,沸水浴煮沸5 min后,经SDS-PAGE和电转到PVDF膜上,用5%的脱脂奶粉的TBST进行2 h封闭,加入兔抗人DLL4一抗,4℃封闭过夜,用TBST洗涤3次,每次10 min,再加入羊抗兔带HRP的二抗,室温孵育1 h,TBST洗涤3次后,进行ECL发光检测。1.2.5 亲和力检测 将纯化后的DLL4-6His进行生物素化标记,生物素和DLL4-6His的摩尔比为3∶1,室温孵育30 min后,进行过夜透析。
亲和力测定采用链霉亲和素传感器(SA Sensor),生物素化的DLL4-6His起始浓度为25 nmol/L,2倍稀释,5个浓度梯度。结合时间600 s,解离时间900 s,通过对照传感器扣除本底信号后,采用1∶1结合模型去拟合结合和解离曲线,得到亲和力常数。
1.2.6 多克隆抗体制备 选择月龄3个月体重1.5 kg的大耳白兔,饲养于标准动物房内,连续观察3 d,确定情况正常后进行免疫。0.5 mg/只免疫DLL4蛋白,免疫采用弗氏完全佐剂,免疫第1次后,每隔一周进行加强免疫,一共免疫4次,取血,将血清于4℃冰箱过夜析出,离心后取上清,-80℃冰箱保存备用。
1.2.7 抗体效价及特异性检测 采用ELISA法检测抗血清效价,步骤如下 :将 50 μL 0.05 μg/μL DLL4蛋白,加入到96孔板中,37℃孵育1 h,TBST洗涤后,加入200 μL 5%的脱脂奶粉的TBST,封闭2 h,然后每孔加入100 μL一抗,37℃孵育1 h,TBST洗涤后,加入二抗,37℃孵育45 min,洗涤后,加入显影液100 μL,37℃避光孵育10 min,加入终止液,最后读取OD450。
为了进行抗体特异性检测,将DLL4瞬时表达的发酵上清进行纯化,收集样品后,进行SDSPAGE电泳,并转到PVDF膜上,加入不同稀释度的抗血清,以阴性抗血清作为对照,洗涤后,加入二抗进行孵育,最后ECL发光检测。
2 结果
2.1 DLL4基因的PCR扩增
PCR产物经1%琼脂糖凝胶电泳后,在1.6 kb附近处有1条特异性DNA条带,其长度与tpADLL4-6His基因片段长度吻合(图2)。
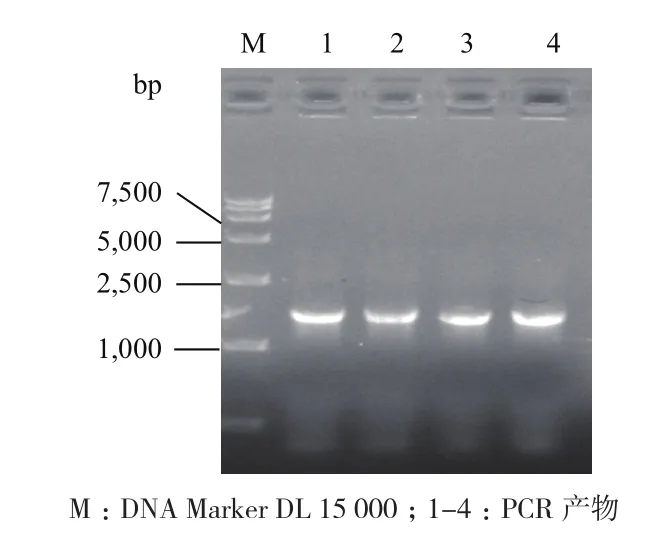
图2 DLL4基因的核酸电泳图
2.2 表达质粒pGZX-DLL4-6His鉴定
pGZX-DLL4-6His经高保真(减少星号活性)EcoR I和BamH I双酶切后进行1.0%琼脂糖凝胶电泳,电泳图显示出两条DNA条带,大小分别为4.6 kb和1.6 kb(图3),符合pGZX载体和DLL4基因片段的长度。将测序结果进行Blast比对,与NCBI中的DLL4序列(NM_019074.3)相同,无碱基突变。
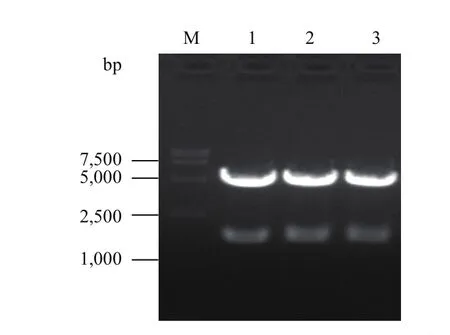
图3 pGZX-DLL4-6His双酶切验证
2.3 DLL4蛋白表达与纯化
LipofectamineTM2000介导pGZX-DLL4-6His转染48 h后,离心后收集上清,SDS-PAGE检测,结果表明,被检测的样品在50-70 kD之间有一条较深的条带。随后进行镍柱亲和纯化,收集流穿、清洗和洗脱组分,并进行SDS-PAGE检测,结果如图4所示,在57 kD处得到一条粗条带,大小符合DLL4-6His的分子量,且纯度达到95%。
2.4 Dot blotting和Western blotting检测
Dot blotting检测结果(图5-A)显示,发酵上清液中含有带6His标签的蛋白,随后进行Western blotting检测,进一步确定是否为DLL4-6His蛋白。结果如图5-B所示,在57 kD处出现一条特异性的条带,以上结果说明通过瞬转,可以在293F细胞发酵上清液中获得具有免疫原性的DLL4蛋白。
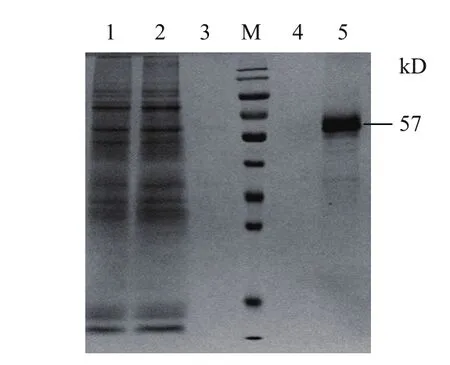
图4 DLL4-6His蛋白的纯化

图5 DLL4-6His蛋白Dot blotting和Western blotting检测
2.5 亲和力检测
采用Fortebio公司出产的Octet Red96分子互作仪来检测DLL4是否可以用于抗体的亲和力检测。结果如图6所示,拟合曲线和实际曲线吻合较好,曲线之间分布均匀,KD值为1.848E-10,R2= 0.999,符合商业化抗体亲和力大小,结果可信。
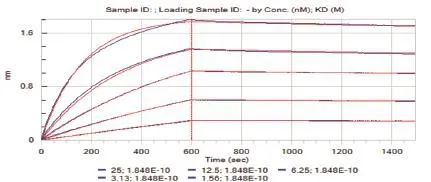
图6 DLL4蛋白亲和力检测
2.6 DLL4抗血清效价及特异性检测
兔子经过3次免疫后,获得DLL4蛋白抗血清,经ELISA法检测(图7-A),其效价可达到1∶12 800。Western blotting结果(图7-B)显示不同稀释度的DLL4抗血清出现明显条带,而阴性对照无对应的条带。
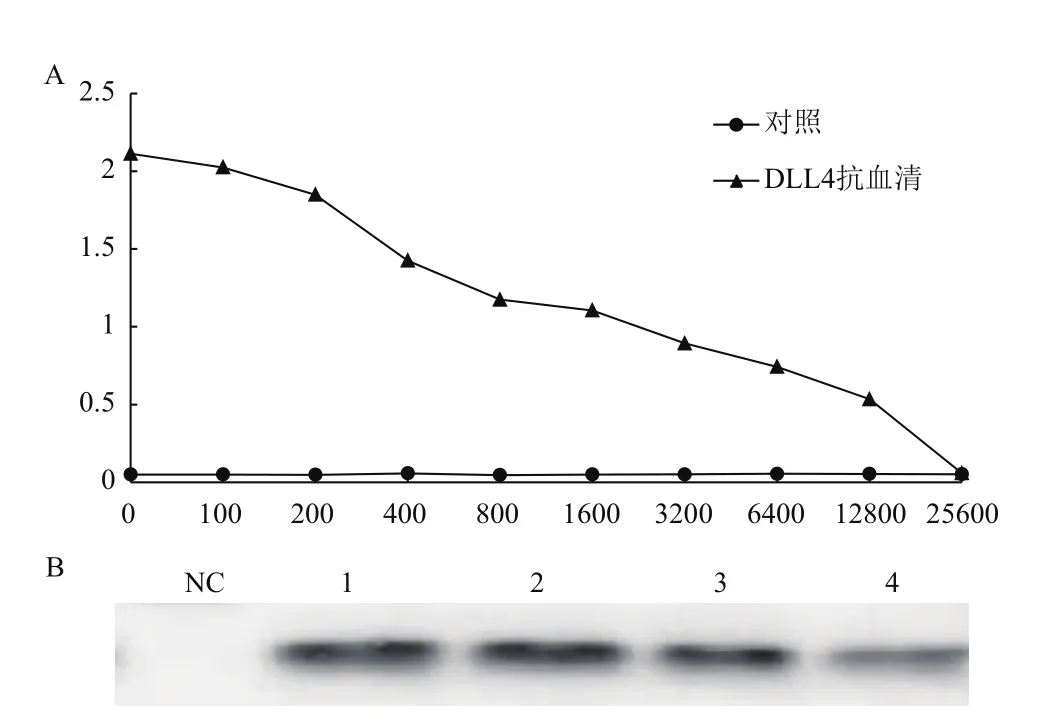
图7 DLL4多克隆抗体效价及特异性检测
3 讨论
临床数据表明,DLL4蛋白与多种实体瘤的发生、发展和转移具有相关性。在乳腺癌上,DLL4在青年型乳腺癌组织中阳性表达率为73.33%,显著高于中老年型乳腺癌组织的阳性表达率(P< 0.05),且DLL4高表达使青年型乳腺癌相对于中老年型乳腺癌更具有侵袭性[9-11]。在肺鳞癌上,DLL4与肿瘤大小呈正相关(r=0.475,P< 0.05),且在肺鳞癌间质中高表达,提示DLL4可能促进肿瘤的浸润和转移[12],在非小细胞肺癌上,DLL4表达与非小细胞肺癌组织的分化程度和TNM分期存在统计学差异(P< 0.05)[13]。在大肠癌上,DLL4在大肠癌组织中阳性检测率为75%,与癌旁组织的检测率(23.81%)存在显著差异(P< 0.001),且与大肠癌的浸润程度、远端转移及TNM分期有关[14-15]。此外,DLL4还与膀胱尿路上皮癌、胰腺癌、骨肉瘤等恶性肿瘤相关。因此,DLL4作为分子标记物,可用于多种实体瘤的诊断及预后诊断。
近年来,DLL4在临床肿瘤筛查及靶向治疗方面的应用价值逐渐被重视,尤其是在抗血管生成疗法如抗VEGF-A和抗VEGF-2R受体治疗耐药出现后,DLL4逐渐成为了肿瘤靶向治疗的新靶点[16]。目前,国外要比国内较早注意到DLL4的价值,市场上,DLL4相关进口试剂盒占据主要市场,且有研究表明,DLL4双特异性单克隆抗体和纳米抗体都已制备出[17-18]。另外,DLL4在研药物有OncoMed公司的Demcizumab,一种双特异性单克隆抗体,现已通过安全评估阶段;Regeneron公司的Enoticumab,一种人源化的单克隆抗体,作为免疫调节剂,现已进入临床I期。而国内,无论是在科研界还是在工业界都进展相对缓慢,抗DLL4靶向治疗仍处于临床前研究,浙江海正药业、百济神州正在加紧研究,旨在加速将这一早期研究成果转化为临床应用,为我国癌症患者提供一种新的治疗希望和途径。
本研究将目的基因DLL4胞外区克隆到真核表达载体pGZX中,并转染到HEK 293F细胞中进行真核表达。tpA信号肽具备分泌信号肽的典型特征,同时含有一个KOZARK增强子,可有效促进异种蛋白分泌,是目前应用最广泛的外源性信号肽之一[19]。前期实验中,对比过lgK信号肽和tpA信号肽,结果表明,tpA信号肽更加有助于DLL4蛋白的分泌表达。HEK 293F细胞是人源化细胞,可以对目的蛋白进行糖基化、磷酸化等翻译后修饰,有助于获得天然构象的蛋白,保持蛋白的生物活性。而带有6His标签,有利于快速的亲和纯化,简化了纯化流程。Dot blotting、Western blotting和大分子互作仪检测结果表明,真核表达出的DLL4-6His蛋白具有免疫原性,且6His标签并不影响DLL4的蛋白活性。叶建斌等[20]通过pCMV-Tag4构建了DLL4真核表达载体,转染到293T细胞中成功地表达出DLL4。与其不同的是,本研究采用HEK 293F细胞为悬浮培养细胞,便于后期进行中大规模的生产,同时带有6His标签,经一步纯化,可以得到纯度为95%的DLL4蛋白,另外,首次利用大分子互作仪进行DLL4生物活性检测,得出具体的数值,使得结论更加可信。通过免疫兔子,成功制备出DLL4多克隆抗体,通过ELISA检测,发现其效价可达到1∶12 800倍,Western blotting表明,其具有良好的特异性。
4 结论
克隆得到人源DLL4胞外区,构建真核表达载体,获得重组质粒pGZX-DLL4-6His,并成功在HEK 293F细胞中分泌表达,基于亲和纯化得到的DLL4蛋白免疫兔子,制备了多克隆抗体,Western blotting显示该抗体具有较好的特异性。

