CRISPR/Cas9基因编辑系统应用于非人灵长类细胞及胚胎Rb1基因编辑的研究
怀思远,褚 楚,曹 静,赵志飞,吴 璇,冀天楠,李建雄解放军总医院 放射治疗科,北京 00853;云南中科灵长类生物医学重点实验室,云南昆明 650500
视网膜母细胞瘤是婴儿和幼儿最常见的眼内恶性肿瘤。我国每年新发小儿视网膜母细胞瘤1 100 ~ 1 500例,预后较差[1]。临床上根据视母细胞瘤发生发展的顺序将其分为4个阶段:眼内生长期、青光眼期、眼外期和全身转移[2]。视网膜母细胞瘤通常在后两个阶段才会被发现,这也就意味着错过早期治疗时机而只能姑息治疗。视网膜母细胞瘤发生发展与肿瘤抑制基因Rb1基因密切相关,通常是由于Rb1基因纯合突变和失活引起。目前,利用转基因技术和基因编辑技术构建了啮齿类动物、两栖动物和人类胚胎干细胞的Rb模型[3-6]。尽管这些模型具有视网膜母细胞瘤的表型,但其与人类视网膜母细胞瘤之间存在显著差异。非人类灵长类动物(如食蟹猴)的疾病模型可以更准确地模拟人类疾病,目前也已经成功建立非人灵长类动物模型,如肌营养不良症和Rett综合征猴模型[7-9]。因此,我们选择食蟹猴作为实验对象,以更好地模拟人视网膜母细胞瘤。近年来,基因编辑技术主要由ZFN、TALEN和CRISPR/Cas9(聚簇规则间隔短回文重复序列/CRISPR相关核酸酶9)系统组成[10-13]。在这3种系统中,CRISPR/Cas9最有效、最简单且细胞毒性最少,成为基因编辑建立动物疾病模型的最佳方式。CRISPR/Cas9基因编辑系统是一种基于古细菌对外源性核酸侵袭的免疫应答的新型基因编辑技术[14-15]。该技术由3种原核CRISPR免疫系统组成[16-17]。由于其高效率和简单性,衍生自化脓链球菌Ⅱ型CRISPR系统的哺乳动物CRISPR系统被广泛使用。本研究中,我们通过CRISPR/Cas9基因编辑系统作为研究手段,探求食蟹猴细胞和胚胎中Rb1肿瘤抑制基因突变的影响。这也是第一次以非人灵长类作为研究对象进行Rb1基因的编辑。
材料和方法
1 动物 选择健康成年食蟹猴(Macaca fascicularis)用于本研究。所有动物都养殖于云南中科灵长类生物医学重点实验室。实验所需动物都经过国际实验动物评估和认可委员会(AAALAC)的评估和认证并批准可用于本实验。
2 食蟹猴卵细胞采集 选择5只年龄为5 ~ 8岁且月经周期正常的健康雌性食蟹猴作为超排的卵母细胞供体,通过肌内注射rhFSH(重组人类促卵泡激素α,GONAL-F,Merck Serono)8 d,第9天rhCG(重组人绒毛膜促性腺激素α,OVIDREL,Merck Serono)施用后32 ~ 35 h通过腹腔镜滤泡抽吸收集卵母细胞。MⅡ(第一极体存在)卵母细胞用于进行胞质内精子注射(ICSI),受精由两个原核的存在证实,共获得26个单细胞胚胎。
3 食蟹猴成纤维细胞建系及培养 选择健康成年食蟹猴,取其耳部组织建立成纤维细胞系,10 mm直径培养皿培养至第5代,在含有10% FBS的DMEM中培养。细胞融合度达80% ~ 90%时传代。
4 PCR扩增成纤维细胞基因组 提取食蟹猴成纤维细胞系基因组,以此为模版,设计扩增Rb1基因8号外显子CDS区引物,进行该区域基因片段扩增并测序。每项实验重复3次。
5 靶片段sgRNA的设计与合成 利用GeneArtTMPrecision gRNA Synthesis Kit试剂盒,设计合成gRNA版oligo DNA引物F:TAATACGACTCACTATAGAT GGTTCACCTCGAACACCC,R:TTCTAGCTCTAAA ACGGGTGTTCGAGGTGAACCAT。体外转录并纯化gRNA产物。
6 CRISPRMAXTM转染成纤维细胞 选择生长状态良好的食蟹猴成纤维细胞铺皿于6孔板,铺皿密度为30% ~ 40%,待细胞数量约为2×105/孔,选用试剂盒LipofectmineTMCRISPRMAXTMTransfection Reagent(Cat.no.31985)作为转染细胞工具,Cas9-nuclease和sgRNA9(1 200 ng/μl)的混合溶液加入到靶细胞的培养基中,培养48 ~ 72 h,收集细胞,做下一步检测。每项实验重复3次。
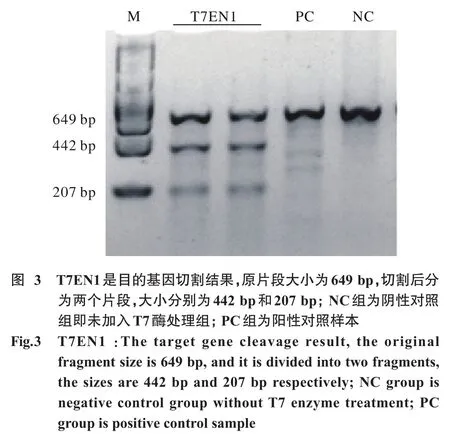
7 T7酶切实验检测细胞基因组编辑结果 提取基因编辑细胞DNA,溶于0.1×TE中。设计引物包含sgRNA作用靶点,上游引物为Rb1-exon8-F:5'-TTGGGAGCAGAGTAGACGAG-3',下游引物为Rb1-exon8-R:5'-CCAGCCTTGGTAGGGTATTT-3'。PCR反应体系50μl(PCR反应相关试剂购自宝生物工程有限公司,中国)。反应条件:98℃ 5 min;(98℃ 30 s,56℃ 30 s,72℃ 30 s)×30 ;72℃ 10 min ;保存4℃。后用PCR纯化试剂盒(Takara公司)纯化PCR产物。取200 ng纯化后的PCR产物在NEB Buffer 2中变性、复性后,用T7核酸内切酶(NEB,M0302L)37℃孵育75 min,然后用1.5%琼脂糖凝胶电泳分离。显影分析。每项实验重复3次。
8 基因编辑后食蟹猴成纤维细胞及胚胎基因组T克隆载体链接测序 连接反应的准备:提取Rb1基因编辑成功的细胞及胚胎基因组并扩增,产物纯化。取纯化后的PCR产物1μl;1 kb control 0.5 ~8μl;pTOPO-Blunt Vector 1μl;10×Enhancer 1μl;nuclease-free H2O Xμl;总体积10μl,室温瞬时低速离心后置于冰上备用。取50 ~ 100μl感受态细胞置于室温解冻,加入5μl连接液并加300 ~500μl LB培养基(不含抗生素),37℃180 r/min振荡培养10 min。取200μl混合液涂板(含氨苄青霉素50 ~ 100μg/ml),置于37℃温箱内培养过夜12 h后,从板内挑取菌落25个分别装于收纳管中振荡培养后测序, 用通用M13F/M13R 引物测序来确定是否含有目的克隆。
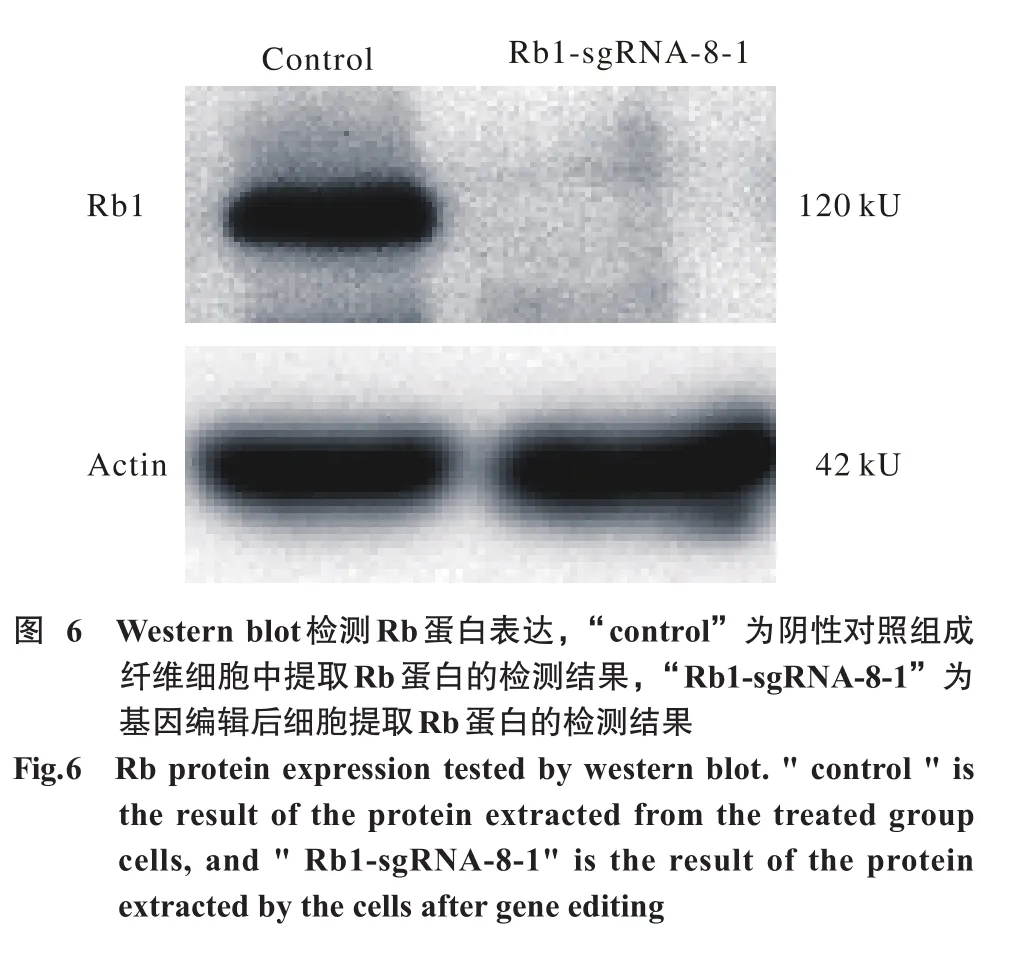
9 Western blot检测Rb蛋白表达 将生长状态良好的细胞在pH 7.9,含有0.15 mol/L NaCl、1 000μmol/L PMSF、0.02 mol/L NaF、1 000μmol/L DTT、0.1%NP40和蛋白酶抑制剂混合物(Thermo)的0.025 mol/L HEPES的缓冲液中裂解并提取蛋白。加样于上层胶(5% SDS-PAGE),在1×电泳缓冲液,80 V电压下浓缩。后于下层胶分离[12% SDS-PAGE(Bio-Rad),220 mA,120 V]。5%脱脂牛奶室温封闭,加一抗[Rb1 1∶500(554136,BD)]4℃条件下温育过夜。第二抗体是1∶3 000的HRP连接的山羊抗小鼠和HRP连接的山羊抗兔。增强的化学发光(ECL,Sigma)用于检测。在暗室使用Alpha View Software(ABI,USA)对带进行量化分析。每项实验重复3次。
10 胚胎培养 将获取的15个胚胎在含有400μl PZM-3的4孔培养皿中培养,培养箱条件为37℃、5% CO2。待胚胎发育至囊胚阶段,收集并冻存于液氮中。
11 单细胞胚胎的Cas9蛋白和sgRNA复合物显微注射 11个单细胞胚胎注射Cas9蛋白(1 000 ng/μl)和sgRNA(500ng/μl)的复合物。在标准条件下进行显微注射入单细胞胚胎细胞质中。然后将其培养在含有10%胎牛血清(HyClone Laboratories,SH30088.02)和90%无蛋白仓鼠胚胎培养基-10(HECM-10)中,置于37℃、5% CO2培养箱中培养。待胚胎发育至4-细胞阶段,终止其发育收集胚胎单个卵裂球。
12 胚胎单卵裂球基因测序 提取单卵裂球基因组PCR扩增产物,纯化后交由硕擎生物公司行第三代测序法测序,并依结果制作基因测序峰图。
结 果
1 基因编辑序列的确立和验证 NCBI上查阅基因组序列,食蟹猴Rb1基因组位于其17号染色体上,全长176 042 bp,共有27个外显子,本实验我们选择了8号外显子CDS区作为基因编辑的目的片段,该片段长度为143 bp,此外显子区序列突变与视网膜母细胞瘤发生关系密切,我们对比了该段片段食蟹猴和人类基因序列组成,结果发现完全匹配,排除SNP存在,并以此作为靶片段序列。见图1。
2 sgRNA序列设计与合成 设计并合成了编辑上述目的片段的sgRNA,其序列为ATGGTTCACCTC GAACACCC,其PAM位点为AGG。合成的sgRNA检测浓度为5 500 ng/μl。见图2。

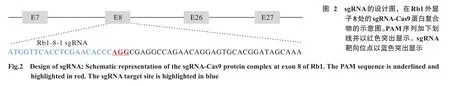
3 酶切实验检验RNP转染后成纤维细胞基因组编辑结果 提取转染RNP细胞基因组并设计包含目的片段引物,PCR扩增后得到目的片段大小为660 bp,sgRNA位置在第210 bp,进行酶切实验检测是否发生基因突变,发现目的片段被切割成两部分,大小约为207 bp和442 bp,与sgRNA作用靶点位置相符,说明该sgRNA成功切开目的片段。见图3。
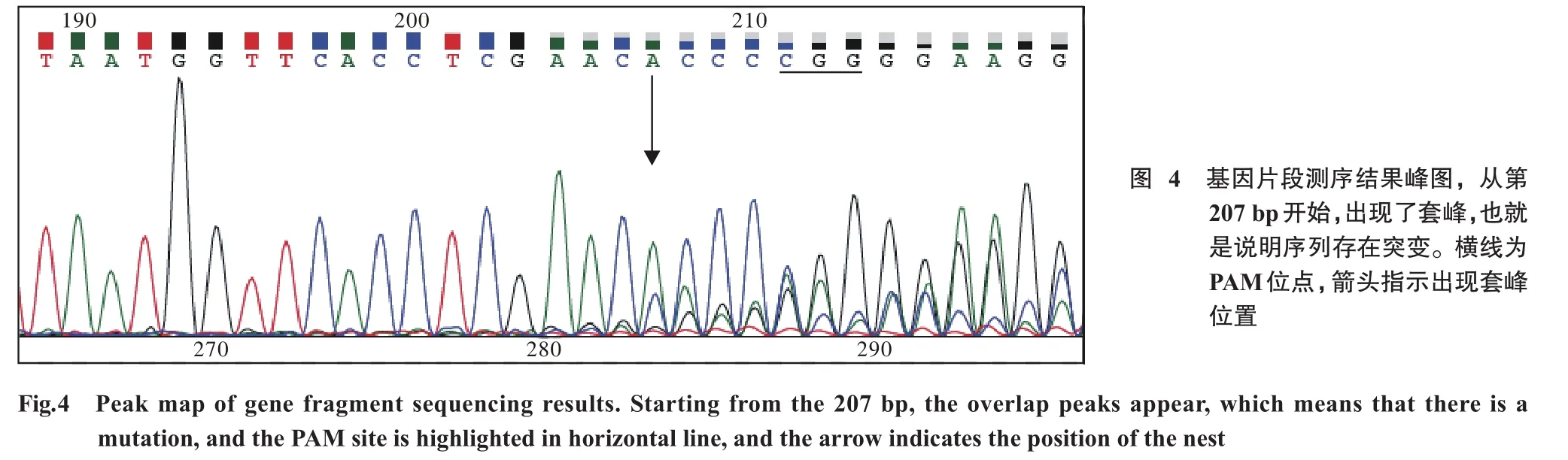
4 RNP转染细胞基因组发生突变 测定编辑后胚胎基因组序列并制作基因测序峰图,在gRNA序列PAM位点(上图211、212、213位点)前第4个碱基(红色箭头位置)开始出现了突变,说明了该突变是由CRISPR/Cas9基因编辑系统作用引起。见图4。
5 单克隆基因测序计算敲除效率 为了检测转染RNP细胞的突变效率,利用T克隆载体结合单一基因组进行单克隆基因测序,单克隆基因组测序结果为20个有效,其中发现出现基因突变的序列共15个,敲除效率为75%(15/20)。见图5。
6 Western blot检测Rb蛋白表达 转染RNP后被编辑的食蟹猴成纤维细胞Rb蛋白含量明显下降甚至不表达。而未转染组Rb蛋白表达正常。说明Rb1基因敲除会影响基因转录及翻译功能。见图6。

7 sgRNA-Cas9复合体在猴胚胎中诱导基因组突变 为了测试猴胚胎中sgRNA-Cas9复合物的敲除效率,利用显微操作技术将RNP注射入11只食蟹猴的单细胞受精卵中(图7A)。通过对比分析发现基因编辑的胚胎囊胚率也处于正常范围(60%)(图7B)。结果显示4个(36.4%)胚胎发生基因组突变,其中2个(18.2%)胚胎为纯合突变,该胚胎具有4个相同突变类型的单卵裂球,这意味着胚胎基因组在1-细胞阶段被编辑;另2个胚胎(18.2%)为嵌合突变,说明基因编辑发生在1-细胞阶段后(图7C)。将受精卵放置于37℃、5% CO2的培养箱中至胚胎发育至4-细胞阶段,观察胚胎发育状态良好并记录(图7D)。
8 脱靶检测未见脱靶效应 应用ucsc基因查询网站,明确预测的脱靶位点位置,共计12个相近sgRNA序列,提取Rb1 sgRNA编辑后细胞基因组,针对这12个DNA片段设计引物,完成PCR扩增及纯化,并测定DNA片段序列,未见脱靶效应。见表1。
讨 论
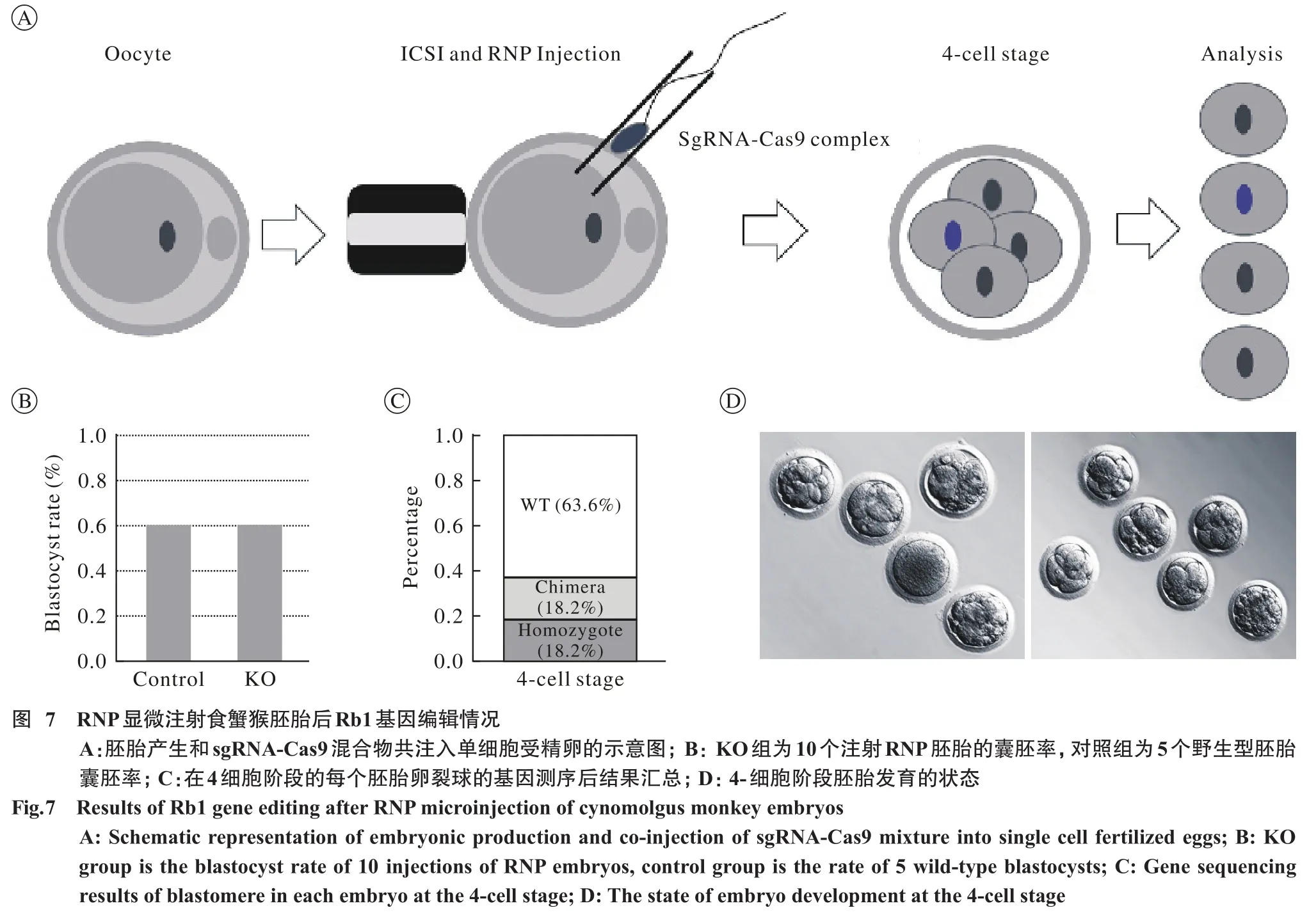

表1 12个脱靶位点序列及基因名称Tab.1 Sequences of 12 off-target sites and gene names
视网膜母细胞瘤基因Rb1是一个重要的抑癌基因。Rb1的双等位基因失活可引发人类视网膜母细胞瘤。为研究视网膜母细胞瘤以及Rb1基因失活如何介导肿瘤发展,有研究者使用不同的实验对象建立了啮齿动物、两栖动物和人类胚胎干细胞多种肿瘤模型,发现当Rb1基因在大鼠和非洲热带爪蟾中双等位基因失活时可致死,Rb1、Rb11(p107)和Rb12(p130)嵌合突变体可诱导视网膜母细胞瘤。RB1-/- hESCs引发了三侧视网膜母细胞瘤,并伴有颅内神经肿瘤[5]。目前还没有与人类疾病过程相似的视网膜母细胞瘤模型,因此我们选用食蟹猴作为基因编辑对象。
CRISPR/Cas9基因编辑系统是一种基于古细菌对外源核酸侵入物免疫反应的新技术。利用CRISPR系统可创建许多动物模型,已经用于小鼠的CRISPR/Cas9基因组编辑。Cas9可由转染质粒、转染mRNA或直接转染RNP来进行目的细胞或胚胎的基因编辑。一些研究人员通过转染编码Cas9和sgRNA的质粒构建基因编辑模型。但其作用机制是质粒转录和翻译为细胞内的蛋白质以产生切割作用来敲除目的基因。另有研究人员将Cas9 mRNA和sgRNA混合物用于基因编辑,Cas9 mRNA被翻译为蛋白质,然后执行其切割功能。这两种方法都不能很好控制Cas9作用时间,易引发嵌合突变[18-19]。本研究利用了RNP转染方法,其优势在于易于操作,该复合物一旦转染到细胞中或注射到胚胎中会立即发挥切割目的序列的作用,受细胞周期等其他不可控因素影响小。我们选择单个gRNA注射条件也降低了发生嵌合突变的风险,可以根据细胞周期和胚胎发育阶段选择注射时机,得到理想的编辑细胞和胚胎。
本研究得到基因突变的食蟹猴胚胎概率以及胚胎囊胚率,说明了单个sgRNA且以RNP形式显微注射进入胚胎后的CRISPR基因编辑系统的编辑效率,表明Rb1-sgRNA-8-1在猴胚胎中具有较高的敲除效率,这是构建Rb猴模型的第一步,以此为参考计算移植胚胎的数量获得模型动物,进而利用猴子肿瘤模型来探索肿瘤发生机制,并以此确定视网膜母细胞瘤的早期标记物,通过上述结果寻求视网膜细胞瘤治疗的药物靶点。本实验仍有待改进,非人灵长类胚胎获取难度大且比较昂贵,实验中胚胎数量较少,为了有效地获得Rb1猴子模型,有必要提高胚胎的敲除效率,下一步我们将继续优化基因编辑条件并移植基因编辑胚胎。
总之,本实验是第一次以非人灵长类为实验对象,在胚胎水平上进行Rb1基因编辑,采用CRISPR/Cas9技术,并利用显微技术注射含单个sgRNA的RNP方法获取编辑效率。我们的研究开拓了非人灵长类胚胎基因编辑的思路,优化了基因编辑条件,明确了抑癌基因编辑后在细胞及胚胎水平上的作用效果。也为今后建立灵长类肿瘤模型提供了很好的理论基础和参考。

