大黄及牛黄解毒片大鼠给药后血浆中大黄活性成分的药代动力学比较研究
刘玥昕,吴 骁,关 蓉,杭太俊,宋 敏
(中国药科大学药物分析系,南京 210009)
牛黄解毒片作为清热解毒的传统复方,历经800多年的发展,形成目前《中华人民共和国药典》收载的由人工牛黄、雄黄、石膏、大黄、黄芩、桔梗、冰片、甘草等八味中药以一定工艺炮制而成的中药复方制剂[1-3]。临床上主要用于治疗火热内盛、咽喉肿痛、牙龈肿痛、口舌生疮及目赤肿痛[1]。大黄作为其处方的主要成分之一,具有显著的泻下作用。近年来,随着研究的不断深入,其保肝利胆[4]、抗凝抗炎[4-5]的作用也逐渐得到证实。大黄的主要活性成分包括大黄酸、大黄素、大黄酚、芦荟大黄素及大黄素甲醚5种蒽醌类成分[6-7]。
目前,对于大黄活性成分的体内过程研究主要针对单味药材大黄[8-9],但对牛黄解毒片中大黄的药代动力学未见报道。本研究采用LC-MS/MS测定牛黄解毒片中大黄主要成分在大鼠血浆中的经时过程,分析药代动力学特征,并与给药单味大黄进行比较,从药代动力学角度揭示方剂配伍的特性。
1 材 料
1.1 仪 器
TSQ Quantum UltraAM型MS/MS联用仪(美国Thermo Finnigan公司);XW-80C型旋涡混合器(上海青浦沪西仪器厂);Explorer超纯水机(上海沉黄科学仪器有限公司);BS110S型万分之一天平(德国Sartorius公司);TGL-16台式高速冷冻离心机(湖南湘仪仪器有限公司);高速多功能粉碎机(永康市天祺盛世工贸有限公司)。
1.2 药品与试剂
牛黄解毒片(北京同仁堂科技发展股份有限公司制药厂);大黄(安徽井泉中药股份有限公司);大黄酸对照品、大黄素对照品(含量98.8%)、大黄酚对照品(含量99.7%)、芦荟大黄素对照品(含量98.3%)、大黄素甲醚对照品(含量99.8%)、1,8-二羟蒽醌对照品(含量99.4%)(成都德斯特生物技术有限公司);L-抗坏血酸(国药集团化学试剂有限公司,含量99.7%);甲醇(美国Tedia公司,色谱纯);其余试剂均为市售分析纯。超纯水(自制,18.25 MΩ·cm)。
1.3 动 物
SPF级SD大鼠,雌雄各半,体重(200±20)g,上海杰思捷实验动物有限公司提供,实验动物生产许可证号:SCXK(沪)2013-0006。动物饲养于中国药科大学药学实验动物中心,饲养温度为(23±3)℃,湿度为40%~70%,12 h照明。实验前禁食过夜12 h,自由饮水。所有动物实验符合实验室动物饲料和使用指导原则,并通过中国药科大学伦理委员会的同意。
2 方 法
2.1 牛黄解毒片与大黄灌胃溶液的制备
取生药大黄及牛黄解毒片适量,粉碎成细粉,精密称定,用0.5% CMC-Na分别配制成质量浓度为20 mg/mL(含总蒽醌19.03 g/kg,相当于大黄酸2.88 g/kg、大黄素3.15 g/kg、大黄酚8.48 g/kg、芦荟大黄素2.41 g/kg及大黄素甲醚2.11 g/kg)及54 mg/mL(含总蒽醌7.27 g/kg,相当于大黄酸1.31 g/kg、大黄素1.50 g/kg、大黄酚2.82 g/kg、芦荟大黄素0.96 g/kg及大黄素甲醚0.68 g/kg)的混悬液,于给药前充分混匀。
2.2 对照品溶液及内标溶液的配制
精密称定大黄酸、大黄素、大黄酚、芦荟大黄素及大黄素甲醚对照品适量,加入适量二甲亚砜溶解后,用甲醇稀释并配制成大黄酸2~600 ng/mL,大黄素0.5~20 ng/mL,大黄酚10~400 ng/mL,芦荟大黄素10~400 ng/mL及大黄素甲醚10~400 ng/mL范围的系列标准溶液。
精密称定1,8-二羟蒽醌适量,加入适量二甲亚砜溶解后,用甲醇稀释并配制成1 μg/mL的内标工作液。
2.3 色谱及质谱条件
采用Inertsil ODS-3 C8(4.6 mm×150 mm,5 μm)色谱柱,以0.1%甲酸铵水溶液(A)-0.1%甲酸铵甲醇溶液(B)为流动相,线性梯度洗脱[0 min,A-B(50∶50)→1.0 min,A-B(50∶50)→1.5 min,A-B(10∶90)→9 min,A-B(10∶90)→9.1 min,A-B(50∶50)→10 min,A-B(50∶50)],流速1.0 mL/min,柱温35 ℃,进样器温度15 ℃,进样量30 μL。
电喷雾负离子化,喷雾电压-3 000 V,毛细管温度350 ℃,鞘气(N2)压力40 kPa,辅助气(N2)压力10 kPa,碰撞气(Ar)1.20 Pa,多反应监测:大黄酸m/z283.0→m/z239.0,碰撞能-17 eV;大黄素m/z269.0→m/z225.0,碰撞能-25 eV;大黄酚m/z253.1→m/z225.0,碰撞能-27 eV;芦荟大黄素m/z269.2→m/z240.0,碰撞能-22 eV;大黄素甲醚m/z283.2→m/z240.0,碰撞能-26 eV;内标1,8-二羟蒽醌m/z239.0→m/z211.0,碰撞能-26 eV。
2.4 血浆样品前处理
精密量取血浆样品0.2 mL于2 mL聚塑离心管中,精密加入20% L-抗坏血酸溶液40 μL,甲醇(标准曲线和质控样品中加入对应浓度的标准溶液)50 μL及内标溶液50 μL,涡旋混匀30 s,加入甲醇0.6 mL,涡旋混匀3 min后,12 000 r/min离心10 min,取上清液37 ℃下氮气吹干,残渣加入初始比例流动相120 μL,涡旋混匀3 min后,12 000 r/min离心10 min,取上清液30 μL进行LC-MS/MS分析。
2.5 动物实验
SPF级SD大鼠40只,随机分为4组,每组10只,大鼠分别灌胃给予大黄96 mg/kg(含总蒽醌1.83 mg/kg,相当于大黄酸0.28 mg/kg、大黄素0.30 mg/kg、大黄酚0.81 mg/kg、芦荟大黄素0.23 mg/kg及大黄素甲醚0.20 mg/kg)或牛黄解毒片250 mg/kg(按人用临床等效日剂量换算,含总蒽醌与大黄生药材等量,相当于大黄酸0.33 mg/kg、大黄素0.38 mg/kg、大黄酚0.71 mg/kg、芦荟大黄素0.24 mg/kg及大黄素甲醚0.17 mg/kg),第1组及第2组灌胃大黄,另两组灌胃牛黄解毒片,于给药前0 h及给药后3,5,10,20,30,40,50 min,1,2,3,4,8,12 h采集血浆样本。由于大鼠血容量有限,第1组及第3组于0,5,20,40 min,1,3,8 h;第2组及第4组于3,10,30,50 min,2,4,12 h大鼠眼内眦静脉丛取血0.4 mL至肝素化离心管中,4 000 r/min离心,分取血浆置-20 ℃冰箱中保存待测。
3 结 果
3.1 专属性
大鼠空白血浆、空白血浆添加一定浓度的大黄酸、大黄素、大黄酚、芦荟大黄素、大黄素甲醚及内标1,8-二羟蒽醌溶液及大鼠给药1 h后血浆样品的典型色谱图如图1所示。大黄酸、大黄酚异构体、芦荟大黄素、大黄素、大黄酚、大黄素甲醚及内标1,8-二羟蒽醌的保留时间分别约为3.9,4.0,4.3,5.1,5.8,6.6及5.2 min,血浆内源性物质对测定无干扰。
3.2 标准曲线及定量下限
精密量取空白血浆0.2 mL,加入20% L-抗坏血酸溶液40 μL,分别精密加入系列大黄混合对照品溶液50 μL,配制成大黄酸2~600 ng/mL,大黄素0.5~20 ng/mL,大黄酚10~400 ng/mL,芦荟大黄素10~400 ng/mL及大黄素甲醚10~400 ng/mL的系列标准血浆样本,自“精密加入内标溶液50 μL”起,照“2.4”项下同法操作,记录色谱图。以大黄各成分峰面积(As)和内标峰面积(Ar)的比值Y对质量浓度c(ng/mL)进行权重回归(1/c2)。得大黄酸、大黄素、大黄酚、芦荟大黄素及大黄素甲醚的回归方程分别为Y=-0.017 0+0.047 2c、Y=0.018 2+0.464c、Y=-0.000 836+0.000 095 1c、Y=0.028 1+0.002 58c及Y=0.000 285+0.000 061 6c,各成分线性良好,相关系数r≥0.99。该方法大黄酸、大黄素、大黄酚、芦荟大黄素及大黄素甲醚的定量下限分别为2、0.5、10、10及10 ng/mL,准确度在98.09%~114.20%,精密度(RSD)小于15.61%,满足定量下限分析测定的要求。
3.3 准确度及精密度
分别配制低、中、高不同质量浓度大黄酸(5,100,480 ng/mL)、大黄素(1,4,16 ng/mL)、大黄酚(20,80,320 ng/mL)、芦荟大黄素(20,80,320 ng/mL)及大黄素甲醚(20,80,320 ng/mL)血浆样本各6份,照“2.4”项下同法操作,一个分析批内测定6次,计算批内变异。不同分析批测定3次,计算批间变异。结果如表1所示,各成分准确度在89.51%~109.36%,精密度(RSD)小于20.19%。

Figure1 Chromatograms of blank plasma (A),blank plasma spiked with standard solution (B) and plasma sample obtained 1 h after oral administration ofNiuhuangJieduTablets (C)
1:1,8-Dihydroxyanthraquinone (tR5.2 min);2:Chrysophanol (tR5.8 min) and chrysophanol isomer (tR4.0 min);3:Emodin (tR5.1 min);4:Aloe-emodin (tR4.3 min);5:Rhein (tR3.9 min);6:Physcion (tR6.6 min)


Analytec/(ng/mL)Inter-batchMeasured concentration/(ng/mL)Accuracy/%RSD/%Intra-batchMeasured concentration/(ng/mL)Accuracy/%RSD/%Rhein55.13±0.34102.536.735.47±0.74109.3613.49100108.04±9.93108.049.19106.01±4.33106.014.08480494.04±32.01102.926.48468.42±64.1997.5913.70Emodin10.99±0.0699.405.621.02±0.10101.599.8343.94±0.1798.384.244.10±0.59102.5614.391614.47±0.8790.476.0415.22±2.1395.1513.99Chrysophanol2019.03±1.4295.177.4518.63±1.6693.138.898079.19±2.9998.993.7879.09±3.8798.874.89320329.81±28.28103.078.58326.98±14.00102.184.28Aloe-emodin2020.29±2.49101.4312.3019.00±2.2495.0211.788083.51±6.08104.387.2883.53±6.46104.417.74320330.86±17.21103.395.20334.04±9.63104.392.88Physcion2021.61±3.22108.0714.9120.23±4.08101.1620.198073.21±3.9691.515.4071.61±5.5689.517.77320307.59±33.7296.1210.96321.06±28.62100.338.91
3.4 基质效应和提取回收率
取低、中、高混合对照品溶液50 μL,加入20% L-抗坏血酸溶液40 μL,照“2.4”项下同法操作,作为基质效应对照组,记录样品峰面积和内标峰面积的比值为A。取空白血浆,甲醇沉淀后分取上清液,加入对应浓度的混合对照品溶液,照“2.4”项下同法操作,作为基质效应样品组。记录样品峰面积和内标峰面积的比值为B。按基质效应因子(MF)=B/A×100%计算MF。
照“3.3”项下分别配制低、中、高质量浓度的QC样品,作为提取回收率样品组,根据与基质效应样品组的峰面积比值计算提取回收率。基质效应和提取回收率结果见表2,在低、中、高不同质量浓度下,QC样品的基质效应和提取回收率稳定,符合生物样本定量分析的要求。


Analytec/(ng/mL)Matrix effect/%RSD/%Recovery/%RSD/%Rhein5158.61±14.299.0171.13±1.482.08100157.90±4.903.1164.29±3.866.01480179.55±17.079.5166.21±3.935.94Emodin118.29±1.719.3380.44±4.095.09415.18±0.845.5585.46±2.843.321618.55±1.065.7390.78±2.612.87Chrysophanol20110.72±14.6113.2072.28±14.4019.9280100.12±12.4212.4077.30±10.6613.79320110.69±7.036.3588.71±5.996.76Aloe-emodin2061.29±14.3123.3486.08±11.6613.548053.23±3.676.8972.89±4.836.6232080.65±8.2210.1979.41±2.763.47Physcion2092.82±18.1119.5158.68±8.0313.698096.52±7.417.6887.77±17.0119.3832083.57±6.818.1490.34±10.5411.67
3.5 稳定性
考察了血浆样品于室温(25 ℃)放置8 h,3次冻融,处理后的血浆样品进样盘(15 ℃)放置24 h的稳定性,结果见表3。大黄酸、大黄素、大黄酚、芦荟大黄素及大黄素甲醚浓度均无明显变化,稳定性良好。


Analytec/(ng/mL)Autosampler (15 °C)Measured concentration/(ng/mL)RSD/%Freeze-thaw cyclesMeasured concentration/(ng/mL)RSD/%Room-temperature (25 °C)Measured concentration/(ng/mL)RSD/%Rhein55.51±0.468.296.11±0.8413.805.04±0.367.24480499.33±60.0712.03506.28±23.984.74433.70±26.966.22Emodin10.99±0.109.611.10±0.1211.110.85±0.1518.021613.29±2.0315.3114.91±0.946.3215.96±1.549.63Chry-sophanol2016.15±2.0512.7116.35±2.3414.3418.22±3.0016.43320283.49±31.2311.02318.30±21.616.79349.31±29.028.31Aloe-emodin2023.18±5.8225.1123.08±4.8020.7720.00±2.6113.03320281.03±17.8317.83337.83±37.7511.17329.26±24.397.41Physcion2017.87±3.0016.7916.40±2.9417.9519.05±1.316.90320351.71±37.7110.72315.14±23.367.41302.53±33.1510.96
3.6 药代动力学研究
大鼠灌胃大黄及牛黄解毒片后不同时间点大黄3种活性成分的平均血药浓度-时间曲线见图2,所得数据经WinNonlin7.0软件计算药代动力学参数,结果见表4。


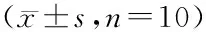


ParameterRheinRhei Radix et RhizomaNHJDTChrysophanol isomerRhei Radix et RhizomaNHJDTcmax/(μg/L)121±103*474±251*8 757±5 22613 467±8 153tmax/h0.14±0.080.11±0.080.47±0.22*0.25±0.16*t1/2/h5.2±1.9*6.9±3.5*3.4±0.864.0±2.0AUC0-t/(μg·h /L)275±176*406±194*30 879±9 98433 342±15 105AUC0-∞/(μg·h /L)329±198*590±353*32 937±10 24837 727±16 442Vd/(L/kg)3 406±2 6075 204±3 34015.4±5.7*43.3±24.6*CL/(L·kg/h)427±260566±2923.1±0.72*7.8±3.0*
*P<0.05
4 讨 论
对大鼠血浆样本前处理方法及色谱条件进行了优化。比较了甲醇沉淀、6 mol/L HCl酸化后甲醇沉淀、乙酸乙酯提取、6 mol/L HCl酸化后乙酸乙酯提取4种前处理方法,结果显示血浆样本经甲醇沉淀提取效率高,重复性好。处理过程中加入20%L-抗坏血酸溶液,防止蒽醌类成分在前处理操作中被氧化。另外,对色谱条件进行了优化,考察了使用甲醇或乙腈作为有机相、流动相中加入甲酸或甲酸铵及色谱柱种类对大黄5种成分保留时间、峰形及响应的影响,以达到增强分离效果、缩短分析时间及提高灵敏度的目的。最终确定了以0.1%甲酸铵水溶液-0.1%甲酸铵甲醇溶液为流动相,Inertsil ODS-3 C8色谱柱(4.6 mm×150 mm,5 μm )为最佳色谱条件。
大鼠给药后血浆中检测到保留时间约为4.1 min 的色谱峰,其[M-H]-峰及二级质谱均与保留时间约为5.8 min的大黄酚完全一致,推测为大黄酚异构体,这与大鼠给药大黄附子汤后血浆中检测到大黄酚异构体的文献[10]相似。大黄酚异构体保留时间较短,因此其与大黄酚相比极性更大,推测其可能结构如图3所示。研究中因大黄酚异构体对照品无法获得,故以大黄酚对照品替代计算相对浓度。

Figure3 Chemical structure of chrysophanol isomer
大鼠给药后,血浆大黄素暴露量整体较低(图2-C),这可能在很大程度上归因于大黄素在体内代谢成葡萄糖醛酸苷[11],但其在血药浓度-时间时曲线中仍呈现双峰现象,说明中药同系物成分多样,在体内的代谢与转化,还会相互影响特征成分的药代动力学行为。文献报道[12],大鼠给予大黄附子汤后,芦荟大黄素的血药浓度-时间曲线呈现双峰现象,与本研究中大黄素的双峰现象,均由大黄酸在体内与大黄素及芦荟大黄素发生相互转化所致[13]。
研究结果表明,大鼠灌胃单味大黄后,血浆中仅检测出大黄酸及大黄酚异构体2种成分;而牛黄解毒片全方给药后,血浆中检测出大黄酚异构体、大黄酸和较低浓度水平的大黄素3种成分。SPSS独立样本t检验表明,牛黄解毒片给药后大鼠血浆中大黄酸的cmax、AUC及t1/2,大黄酚异构体的Vd及CL与单味大黄相比,显著增加,大黄酚异构体的tmax显著下降。所以,复方配伍促进了大黄有效成分的吸收利用[14-15],改变了大黄有效成分的药代动力学行为。

