酸性条件下低酯果胶对酪蛋白酸钠流变特性及微观结构的影响
彭媛媛,王昱圭,汤雪纤,张甫生,郑炯*
1(西南大学 食品科学学院,重庆 400715) 2(食品科学与工程国家级实验教学示范中心(西南大学),重庆,400715)
酪蛋白酸钠(sodium caseinate,NaCN)也称酪朊酸钠、干酪素钠,是由水难溶性的酪蛋白经过碱处理后得到的一种可溶性蛋白质[1]。酪蛋白酸钠因其良好的热稳定性[2]、乳化性、起泡性、持水性等功能特性,使其成为改善食品质地与感官的重要原料,常作为乳化剂、增稠剂和稳定剂被广泛应用于食品行业[3-5]。但环境因素往往影响着酪蛋白酸钠的功能性质,与大多数蛋白质一样,在等电点附近酪蛋白酸钠通常会发生絮凝聚集产生沉淀[6],从而使得酪蛋白酸钠及其加工制品的结构和流变特性发生显著变化,影响其食用品质,因此通常需要对酪蛋白酸钠进行改性修饰来提高功能性质,扩大应用范围。
多糖与蛋白质之间的相互作用,在一定程度上能修饰蛋白质的结构和功能性质[7-8]。研究表明,阴离子多糖的添加,会与带正电荷的蛋白质形成稳定的可溶性复合物,可以有效改善蛋白质在等电点以下发生的失稳现象[9]。 KLEMMER等[10]发现多糖海藻酸钠与豌豆分离蛋白等量复配体系在pH值为5.0时形成了可溶性复合物。而在酸性介质中,MESSAOUD等[11]也发现海藻酸盐与酪蛋白酸钠之间的静电作用会增强海藻酸盐/酪蛋白酸钠复合物的力学强度及稳定性。盖武军[12]研究了水解桃胶与酪蛋白酸钠之间的相互作用,结果表明两者之间形成了高弹性、高紧密度的凝胶网络结构。陈青等[13-14]分别研究了低酰基结冷胶/酪蛋白酸钠和高酰基结冷胶/酪蛋白酸钠2种复合凝胶的结构和性质,发现结冷胶含量越高,复合凝胶的硬度、弹性、保水性越好。HYUNNHO等[15]研究发现了在酸性条件下,羧甲基纤维素/酪蛋白酸钠复合物与酪蛋白酸钠单体相比更加稳定,复合物可用作亲脂性生物活性物质(姜黄素)的载体材料。因此,在酸性条件下可利用加入多糖类物质来改善酪蛋白酸钠的相关性质,使酪蛋白酸钠具有更广泛的应用前景。
果胶是主要由D-半乳糖醛酸单元聚合而成的酸性大分子多糖,是植物细胞壁和细胞内层的主要成分[16]。作为一种可溶性膳食纤维,果胶具有降低胆固醇,维持肠道健康,预防糖尿病等功效[17]。果胶属于阴离子多糖,以其良好的凝胶特性,被广泛应用于食品工业之中[21]。根据酯化度的不同,可将果胶分为高酯果胶(high methoxyl pectin,HMP)和低酯果胶(low methoxyl pectin,LMP)[18]。高酯果胶只能在低pH值(pH 1.0~3.5)和高可溶性固形物(SS>50%)的条件下胶凝;而低酯果胶在较广的pH值范围(pH 2.0~6.0)内以及二价阳离子(如Ca2+)的存在下便具有良好的凝胶性能,对可溶性固形物含量的要求不高,故低酯果胶多应用于低糖类食品的生产[19-20]。研究表明,在酸性条件下,低酯果胶带有较多的负电荷,可以吸附在蛋白质表面,并可以通过空间位阻作用和静电作用稳定体系[21-22]。因此向酪蛋白酸钠溶液中加入适量的低酯果胶,能提高低于等电点的酸性体系的稳定性。但目前,低酯果胶对酪蛋白酸钠结构及功能特性影响的研究鲜有报道。因此,本实验以酪蛋白酸钠为原料,在pH=4.0的酸性条件下考察了低酯果胶对酪蛋白酸钠流变学性质、粒径、Zeta电位及微观结构的影响,以期为低酯果胶作为稳定剂在酸性乳制品中的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
低酯果胶(食品级,酯化度:20%),河南恒锐食品生物科技有限公司;酪蛋白酸钠(食品级,蛋白质含量98%),上海极威生物科技有限公司;一水合柠檬酸、CaCl2、蔗糖(分析纯),成都市科龙化工试剂厂。
1.2 仪器与设备
FA2004A型电子分析天平,上海精天电子仪器有限公司;pHS-3C型酸度计,成都世纪方舟科技有限公司;AR-G2型旋转流变仪,美国TA公司; Nano-ZS & MPT-2型Zeta电位及纳米粒度仪,英国 Malvern公司;JSM-6510LV型钨灯丝扫描电子显微镜,日本电子株式会社(JEOL)。
1.3 方法
1.3.1 样品的制备
参考刘丽娅[23]的方法稍有改动,在前期预实验的基础上,选定pH 4.0,将质量浓度为4 g/100mL的酪蛋白酸钠溶解在纯水中,90 ℃加热60 min,使其完全溶解后静置。前期预实验发现,当低酯果胶的添加量高于1.5 g/100mL后,体系将由液态转变为固态,故选定低酯果胶加入量为0、0.3、0.6、0.9、1.2、1.5 g/100mL,并继续于80 ℃条件下加热,加热过程不断搅拌,20 min后取出混合液,待混合液稍冷后加入1.5 g/100mL CaCl2,并用柠檬酸调节pH值,冷却,并在4 ℃条件下的冰箱静置24 h后进行测定。
1.3.2 流变特性的测定
参考刘丽娅[23]的方法稍做改动:采用平板-平板测量系统,设置间隙1.0 mm,测定中所用平行板直径40 mm,用称量匙挖取适量样品于平行板,下压后,用刮板除去多余样品,并用低粘度的硅油密封表面以防止水分蒸发。每个样品测试前保留时间为180 s,且所有样品的测量温度均控制在25 ℃。
静态流变测定:设置剪切速率从0~300 s-1递增后,再从300 s-1~0递减,测定过程中剪切应力和黏度的变化情况。采用Power-law模型对所得数据点进行回归拟合,拟合系数R2表示方程拟合精度。Power-law方程表示如下:
σ=Kγn
(1)
式中:σ代表剪切应力,Pa;K指稠度系数,Pa·sn;γ指剪切速率,s-1;n表示流体指数。
动态黏弹性测定:控制扫描应变值为1%,确保测定过程在样品的线性黏弹区内进行,振荡频率设定为从0.1~10 Hz,观察不同样品的储能模量G′、损耗模量G″以及损耗正切角tanδ随频率的变化情况。
动态时间扫描测定:固定扫描应变值为1%,控制振荡频率为1 rad/s,观察不同样品的储能模量G′、损耗模量G″及损耗正切角tanδ在3 600 s内随时间的变化。
1.3.3 Zeta电位的测定
吸取50 μL样品溶液于10 mL离心管中,加入去离子水定容,再取出1 mL定容后的溶液加去离子水定容至5 mL。将样品稀释1 000倍后采用纳米粒度仪测定LMP/NaCN复合体系的Zeta电位。测定条件如下:比色池规格是1 cm聚苯乙烯池,包含一对0.45 cm2铂电极,距为0.4 cm。测定开始前平衡时间为2 min,测定温度控制在25 ℃。每组包含10~100次测量,依据数据重现性而定,计算3次重复得到的平均值为测定值。
1.3.4 粒径大小的测定
将待测样品用蒸馏水稀释1 000倍后,采用纳米粒度仪测定添加低酯果胶后酪蛋白酸钠溶液的粒径大小。在25 ℃下恒温测定,所用光源为最大输出功率10 W的He-Ne激光,检测角为90°,检测波长为633 nm。避免多重光散射,每次循环扫描10~120次,每个样品重复测量3次。
1.3.5 微观结构的观察
将刚制备好的混合样品迅速倒入90 mm的培养皿中,使样品均匀平铺在培养皿内,静置冷却至室温后放入冰箱冻藏24 h,使样品完全结冰,再放入冷冻干燥箱中,于-50℃条件下进行抽真空冷冻干燥72 h,使得样品完全干燥。将干燥好后的样品固定在双面导电的样品台上,使用离子溅射仪使样品具有导电性。使用扫描电子显微镜在500放大倍率下,对样品的微观结构进行观察,并选择具有代表性的视野进行记录拍照。
1.4 数据处理
所得数据使用Origin 8.0和Microsoft Excel绘制相关图表。粒径、Zeta电位数据使用SPSS 20.0对其进行方差分析(ANOVA),使用Duncun法(p<0.05)比较平均值之间的差异性。每次测试前需更换样品,且每组实验均重复3次。
2 结果与分析
2.1 低酯果胶对酪蛋白酸钠流变特性的影响
2.1.1 静态剪切流变特性
图1-A表示复合体系剪切应力随剪切速率的变化关系,而图1-B表示的是复合体系黏度随剪切速率的关系。由图1-A可知复合体系的剪切应力随剪切速率的增大而增大,且随低酯果胶浓度的升高,剪切应力增大,当低酯果胶质量浓度达到1.5 g/100mL时剪切应力达到最高。由图1-B可以看出,复合体系的黏度在低剪切速率时随着添加的低酯果胶浓度的上升而增加,而当剪切速率提升后其黏度迅速降低最后趋于稳定,呈现出典型的剪切稀化的流体特性。这是由于在剪切速率低的情况下,复合体系单位体积内的大分子产生碰撞和缠绕的几率大于外力所致的缠结断裂,故表现出较高的黏度[24],但当剪切速率逐渐升高后,分子间的交联结构在剪切速率高的情况下遭到破坏,复杂的分子链重新解离释放,引起了体系黏度下降并保持一定数值[25]。同时体系在升速和降速过程中形成的曲线较为重合,表明其具有较好的触变性能[26]。
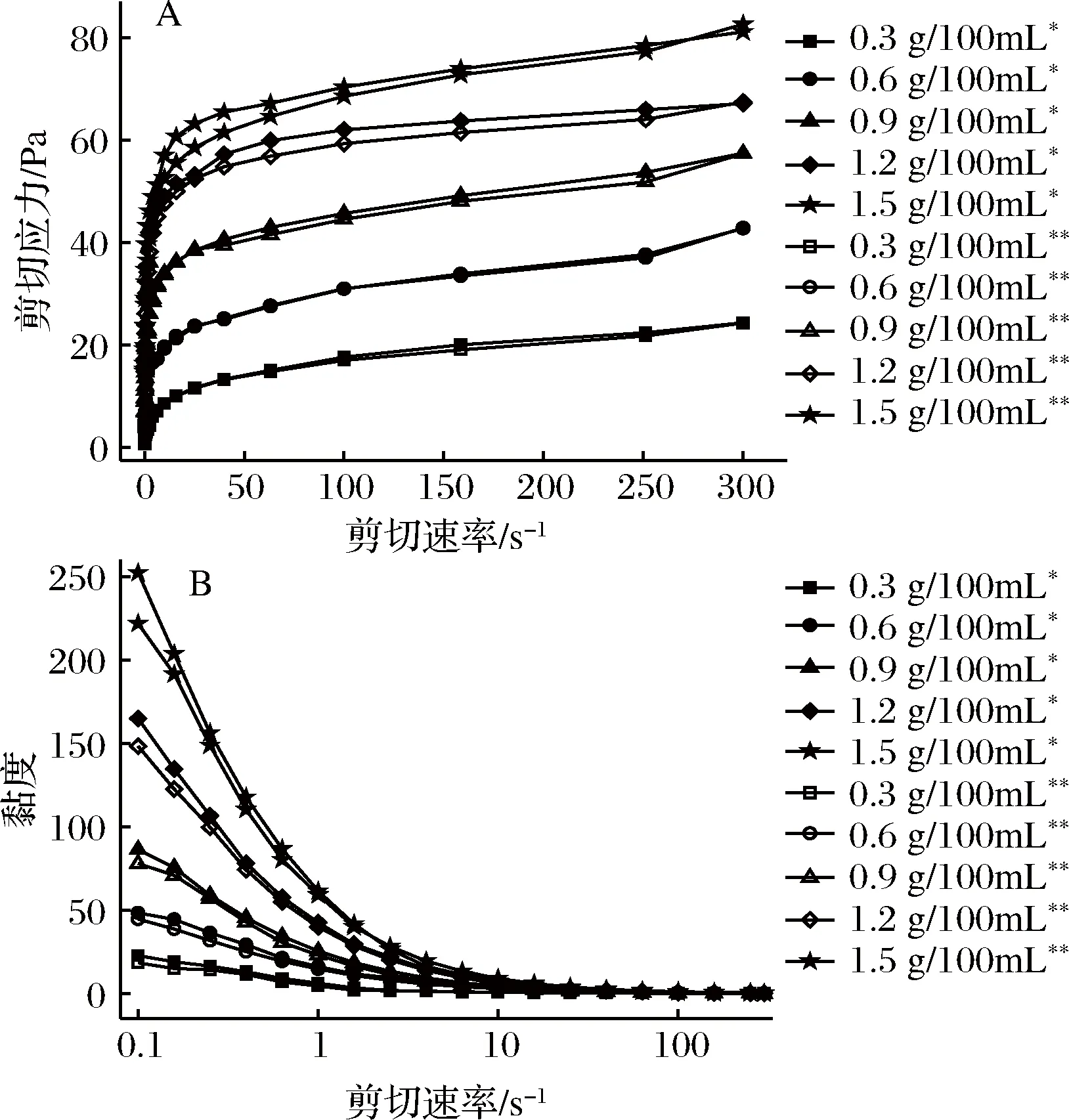
图1 LMP/NaCN复合体系剪切应力(A)及黏度(B)随剪切速率变化曲线Fig.1 Curves of shear force (A) and (B) viscosity of LMP/ NaCN mixed system with shear rate注:“*”表示上行;“**”表示下行。
表1是由上述数据通过Power-law模型进行拟合得到的结果。所得拟合曲线的决定系数R2均大于0.93,故模型的精度比较高。参数K代表体系的浓度和黏稠度,结果表明,随着果胶浓度的升高,K值上升,体系表观黏度也增大。指数n代表流体假塑性程度,结果中n值均小于1,表明在剪切速率范围(0.1~300 s-1)内,体系属于假塑性流体[27],随着浓度的增大,n值逐渐减小,体系的剪切变稀现象进一步增强,假塑性流体行为也更加明显[17]。从表1可以发现,参数K的变化规律比指数n的复杂,这可能是由于在低酯果胶质量浓度小于0.3 g/100mL时,其与Ca2+形成桥联网状结构不佳,而钙离子能够与酪蛋白酸钠中αs-及β-酪蛋白上的磷酸丝氨酸发生交联作用,故体系在低果胶浓度时主要表现出酪蛋白酸钠的流变学特性,随低酯果胶的浓度增大,带负电荷的低酯果胶一部分与酪蛋白酸钠通过静电作用结合,另一部分在溶液中呈线性链状构象的低酯果胶分子与Ca2+相互缠结,形成“蛋盒”模式结合区[28],当连接区的分子数增多,分子间作用力逐渐增强,同时分子链间以及分子间的相互缠结也加剧,使得体系黏度增大[29]。

表1 LMP/NaCN复合体系Power-Law方程拟合参数Table 1 Power-Law parameters for LMP/NaCN mixed system
2.1.2 动态黏弹流变特性
图2表示的是复合体系的动态模量随角速度变化的曲线图,由图可知,体系的储能模量(G′)和损耗模量(G″)均随角速度的增加而增加,且同一样品的G′始终大于其G″,说明体系在25℃时是以弹性为主[30],表现出较强的胶体行为[31]。同时也能发现:随着低酯果胶浓度提高,体系的G′和G″均有提高,说明体系的弹性逐渐增强,当果胶的含量达到1.5 g/100mL时,体系拥有最大的G′,此时体系具有最佳的凝胶强度。当果胶含量大于0.9 g/100mL时,G′和G″增加得更快,这可能是因为在pH=4.0时,少量带负电荷的低酯果胶加入,能吸附在带有正电荷的酪蛋白酸钠表面,一定程度上控制了酪蛋白酸钠的絮凝失稳现象,但低酯果胶此时与Ca2+形成的网联结构不佳,大量果胶加入之后,在与蛋白质形成较强静电作用的同时,自身形成凝胶形成空间位阻[32],其产生的网状结构,使体系弹性性能增强。
在动态流变学中,由于分子内部存在摩擦力,高分子化合物中分子链段的运动存在滞后现象,并不与交变应力的运动完全一致,故在交变应力的作用下会产生力学损耗角δ(应力与应变的相位差角),tanδ为损耗角正切,是损耗模量与储能模量的比值[33]。图3表示测试中的tanδ随频率变化的曲线,由图可知,体系tanδ均呈下降趋势,说明随着频率增大,体系分子链的运动越容易,几乎所有的tanδ值均处于0.1~1,说明样品主要显现出弹性,是典型的弱凝胶体系特征[34],当添加1.5 g/100mL的果胶时,这种特性更为突出。
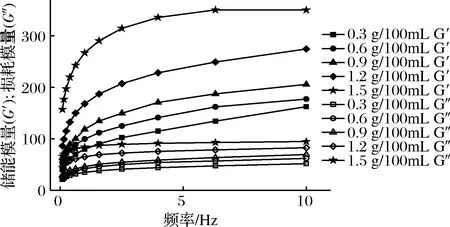
图2 LMP/NaCN复合体系动态模量随角速度变化曲线Fig.2 Curves of dynamic modylus of LMP/NaCN mixed system with angular

图3 LMP/NaCN复合体系tanδ随频率变化曲线Fig.3 Curves of tanδ of LMP/NaCN mixed system with frequency
2.1.3 动态时间扫描
图4-A和图4-B分别为体系储能模量(G′)和损耗角正切(tanδ)随时间变化的曲线。由图可知,随着果胶浓度的增大,体系的储能模量增大而损耗角正切减小,在质量浓度达到1.5 g/100mL时,具有最高的储能模量和最低的损耗角正切值。通过辅助线可以发现,施加剪切力的初期,储能模量有轻微的下降,随着剪切时间的延长,储能模量回复到初始值并略有上升,最后趋于平衡。这可能是由于,最初所施加的剪切力能够破坏体系原有的网络结构,但同时样品也具有较强的回复性能,体系内分子以及分子链间可以随着时间的延长能形成新的网络结构[31],这与动态黏弹体现出来性质相一致。低酯果胶质量浓度0.3 g/100mL的体系,储能模量处于最低但较为稳定,而其损耗角正切tanδ最大却存在下降幅度,这可能是由于少量的果胶的加入与酪蛋白酸钠发生“架桥絮凝”反应[16],蛋白质胶粒仍存在聚集失稳现象,体系中分子重排剧烈,水分子不能很好的被包裹在体系结构中,体系弹性特征不明显。随着低酯果胶浓度的增大,tanδ逐渐减小,体系具有更强的弹性和固性特征。

图4 LMP/NaCN复配体系储能模量G′(A)及损耗角正切(B)随保留时间变化曲线Fig.4 Curves of storage modulus G′(A) and tanδ (B) with retention time in LMP/NaCN mixed system
2.2 低酯果胶对酪蛋白酸钠Zeta电位的影响
Zeta电位是指带电粒子的“扩散双电层”产生的电势,代表体系中所有微粒的平均电位,可以通过Zeta电位观测新形成复合物表面的电荷密度变化,衡量蛋白质与多糖之间的相互作用,反映体系的稳定性[35-37]。前期实验表明,未添加果胶时,大部分酪蛋白酸钠溶液体系会在酸化过程中产生较大的海绵状物质,无法对其进行Zeta电位的测定。图5表示低酯果胶对酪蛋白酸钠Zeta电位的影响,由图可知,所有样品的Zeta电位均为负值,表明在pH=4.0时酪蛋白酸钠仍带有少量负电荷,此时与低酯果胶之间的相互作用主要是:蛋白质分子上带有正电荷的片段和果胶侧链上负电基团之间的静电引力。其他研究者也发现在黄原胶/酪蛋白酸钠[38]以及CMC/酪蛋白酸钠复合体系中存在类似的现象[23]。随着低酯果胶的添加量逐渐增大,体系的Zeta电位值逐渐升高,且不同的低酯果胶添加量也使得样品间Zeta电位值存在着显著性差异(p<0.05)。体系中Zeta电位的绝对值均小于25 mV,意味着体系粒子间存在着较强的静电吸引作用。低酯果胶分子结构中含有较多未被甲基化的羧酸基团,因而带有大量的负电荷,能够通过静电相互作用吸附在带正电荷的蛋白质表面。随着低酯果胶添加量的增加,一部分果胶吸附在蛋白质表面的,另一部分与体系内Ca2+形成点状或棒状交联[39],而体系内的静电排斥作用减弱,逐渐形成果胶网络包裹蛋白质的结构,且在低酯果胶质量浓度为1.5 g/100mL时,这种果胶附着层结构最为明显。
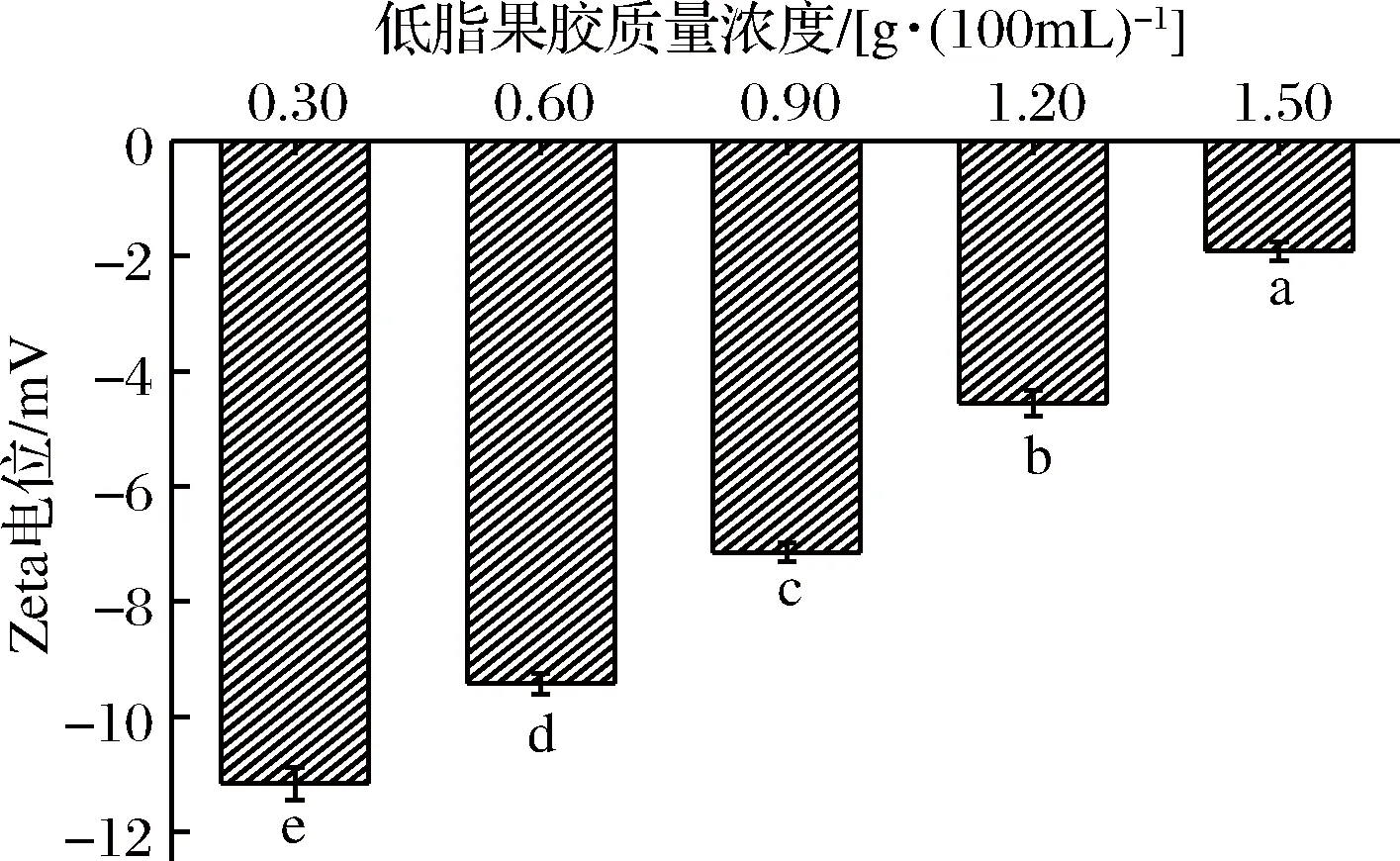
图5 低酯果胶对酪蛋白酸钠Zeta电位的影响Fig.5 Effects of low methoxyl pectin on Zeta potential of sodium caseinate注:字母不同表示有显著差异(p<0.05),下图同。
2.3 低酯果胶对酪蛋白酸钠粒径的影响
图6反映了在pH=4.0时低酯果胶对酪蛋白酸钠平均粒径的影响。由图可知,随着果胶浓度的增加,平均粒径也不断增加,且增加的程度也不断加大,在果胶质量浓度达到1.5 g/100mL时,体系平均粒径达到最大,这与NAKAMURA等[40]研究结果类似。表明酸性阴离子多糖低酯果胶通过静电作用吸附在了酪蛋白颗粒表面而使其粒径变大,且随着果胶浓度增大,果胶吸附层的厚度和空间位阻作用也增大,使得蛋白质聚集点降低,体系能在酸性条件下稳定。控制适当的果胶吸附层厚度也成为维持体系在酸性条件下稳定的重要手段之一[41]。同时可以发现,在不同果胶浓度之间,体系平均粒径大小存在着显著性差异(p<0.05)。在果胶添加量为0.3 g/100mL时,体系失稳现象在一定程度上得以改善,但仍出现了肉眼可见的絮凝现象,这是由于果胶浓度低,单个聚合物分子连接多个蛋白质分子引起的“架桥絮凝”现象[42],说明在低果胶浓度的体系中,果胶可以通过吸附在蛋白质表面来改善蛋白质之间发生的聚集沉淀,但仍有可能导致体系出现多糖/蛋白质复合物的失稳。随着果胶浓度的增加,果胶吸附层厚度增加形成空间阻力增大,复合体系平均粒径增大,在宏观上缓解了“架桥絮凝”现象的发生,体系也更加稳定。

图6 低酯果胶对酪蛋白酸钠粒径的影响Fig.6 Effects of low methoxyl pectin on sodium caseinate particle size
2.4 低酯果胶对酪蛋白酸钠微观结构的影响
图7是添加不同质量浓度的低酯果胶与酪蛋白酸钠酸化凝胶体系在500倍下的扫描电镜观察图。图7-A表示在酸性条件下未添加低酯果胶的酪蛋白酸钠体系微观结构示意图。单一的酪蛋白酸钠会在酸性条件下聚集絮凝产生沉淀。从图中可以清晰地看到裸露的、大小不一的球形酪蛋白胶束,聚集成较为粗大的蛋白簇,这种主要通过蛋白质分子间相互作用形成的简单聚合体,其间存在着连续相通的空隙小孔[43],这种结构具有较低的持水性。
图7-B和图7-C分别为添加0.3 g/100mL和0.6 g/100mL低酯果胶的酪蛋白酸钠体系微观结构图,果胶的加入对体系的影响较为明显,在一定程度上缓解了单一酪蛋白酸钠在酸性条件下出现的失稳现象,但是由于果胶量少,其与酪蛋白发生“架桥絮凝”反应[44-45],加剧了蛋白质的重排,蛋白质聚集收缩形成了类似蜂窝状的黑洞空隙小孔,使得体系束缚水的能力弱[46]。与图7-A相比,随着果胶浓度的增大可以发现体系中粗大的球形蛋白簇结构有所减少,呈现更加明显的蜂窝结构,体系中孔洞开始变得规则而致密的,球状酪蛋白簇之间的连续性增强,体系在宏观上表现出持水性和黏度增大,其对应了流变学测定的结果。
图7-D、图7-E和图7-F分别是添加0.9、1.2、1.5 g/100mL低酯果胶的酪蛋白酸钠体系微观结构图,可以发现随着果胶浓度的增大,结构整体空隙数目减少,体系变得更加致密,体系表面并出现出片状、条状结构,体系连续性变佳,这可能是由于果胶浓度的增大缓解了“架桥絮凝”反应。事实上,有学者研究发现阴离子多糖黄原胶在酸乳中,可以通过静电作用与空间位阻作用改善酪蛋白簇的原有结构[26],因此可以推测,阴离子多糖果胶也能通过静电作用干扰其原有结构,少量果胶填充在酪蛋白的空隙中,形成一种“嵌入”式结构,使其表面更加光滑,分支更细,体系开始更多的表现出低酯果胶的结构特征。当添加1.2 g/100mL的低酯果胶时,结构表面孔隙消失,果胶的“嵌入”式结构在体系中逐渐明显。当低酯果胶添加量达到1.5 g/100mL时,体系表面的条状、片状物质开始缠绕钩挂,产生的位阻作用也更强。这可能是因为低酯果胶分子中带负电荷的羧基集团与体系中的Ca2+之间形成了盐桥,再加上体系分子间的氢键和侧链间的疏水相互作用的存在[24],使得体系结构更稳定。这种网络结构能使体系在受到外界剪切作用时保持一定的抗性,从宏观上表现出其固性特征不易被破坏。因此,这种网络结构也能更好地诠释在动态流变特性上,体系果胶含量为1.5 g/100mL时总是拥有比其他体系更高的储能模量的现象。
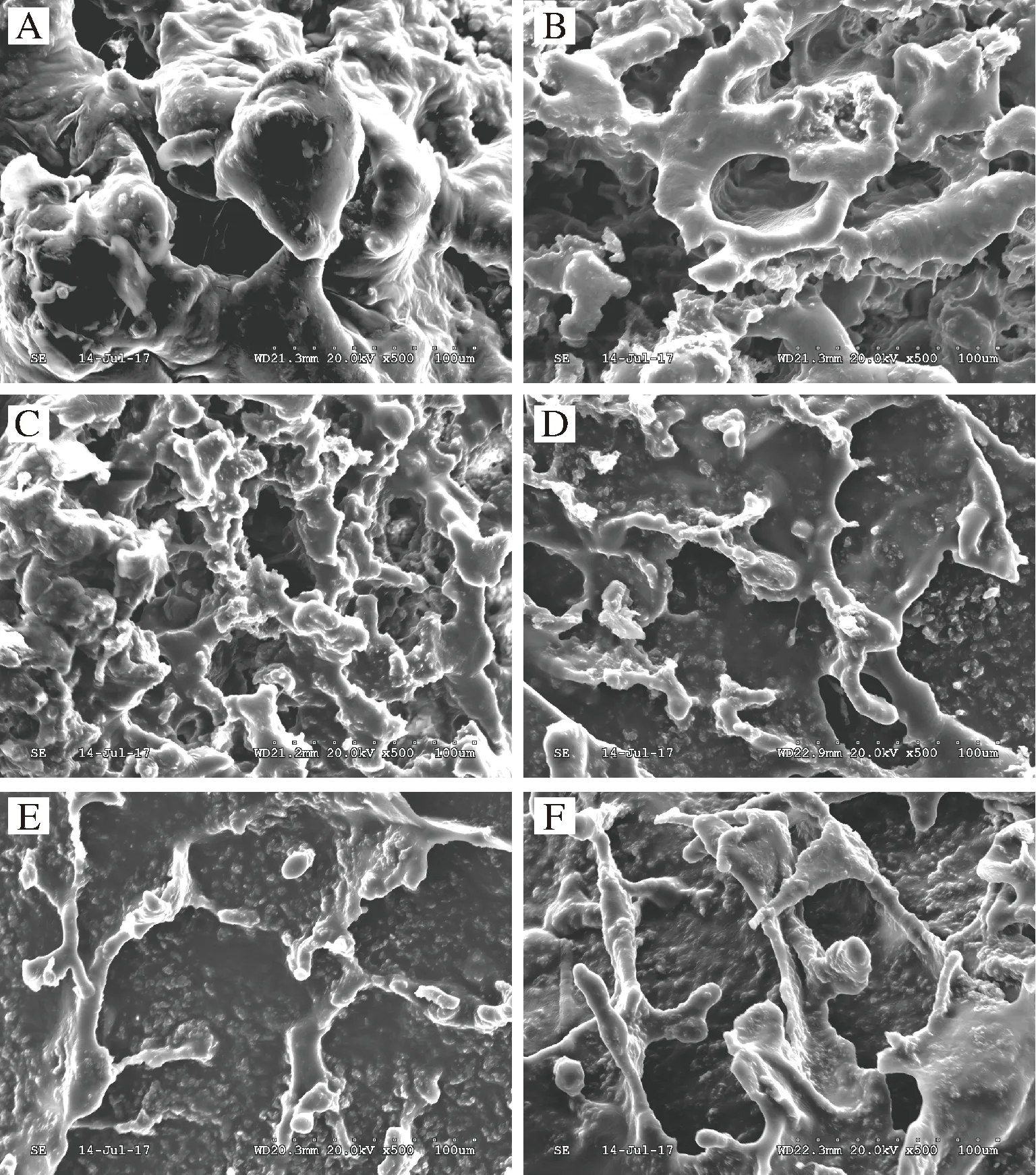
A-0;B-0.3 g/100mL;C-0.6 g/100mL;D-0.9 g/100mL;E-1.2 g/100mL;F-1.5 g/100mL图7 不同LMP质量浓度的LMP/NaCN复合体系电镜扫描图Fig.7 Electron microscopic scanning of LMP/NaCN mixed complex with different LMP concentrations
3 结论
LMP/NaCN复合体系是典型的剪切变稀的假塑性流体,随着果胶含量的增大,体系具有更高的稠度系数和更低的流体指数。低酯果胶的添加可以优化复合体系的流变性能。加入的果胶能附着在体系内蛋白质表面,随着果胶浓度的提升,体系静电吸引力增大,吸附层厚度增加,复合物粒径随之增大,并在低酯果胶浓度达到1.5 g/100mL时达到最大。体系结构最初为蜂窝状球型酪蛋白簇,果胶的加入在一定程度上能改善体系酪蛋白酸钠失稳聚集现象,使体系内出现致密的网状结构。低酯果胶能提高酪蛋白酸钠在酸性条件下的稳定性,可为酸性乳制品的生产提供理论依据,同时也可拓宽酪蛋白酸钠在食品行业中的应用范围。

