不同盐浓度下罗非鱼肌球蛋白热诱导凝胶的形成及机理
朱潘红,齐慧红,李婷,周春霞,洪鹏志
(广东海洋大学 食品科技学院,广东省水产品加工与安全重点实验室,水产品深加工广东普通高等学校重点实验室,广东 湛江,524088)
罗非鱼蛋白含量很高,肌原纤维蛋白约占60%~75%,而肌球蛋白占肌原纤维蛋白的55%~60%,是决定肌原纤维蛋白功能特性的主要蛋白质[1]。肌球蛋白是盐溶性蛋白,在一定盐浓度条件下热处理会形成凝胶,从而影响肉制品的质构、外观和出品率[2]。凝胶化在食品领域中具有重要的功能特性,食品中的蛋白质通常通过热诱导形成凝胶。热诱导凝胶主要涉及到初始蛋白的去折叠以及随后蛋白分子的聚集,影响热凝胶形成的因素包括肌肉类型[3]、pH值[4]、离子强度[3,5]、蛋白浓度[6]、加热条件[7]等,直接影响肉制品的微观结构和黏弹性[8]。鲤鱼肌原纤维蛋白40 ℃以上时蛋白头部构象发生显著变化,结构展开,疏水性氨基酸残基和巯基相互作用使蛋白分子产生热聚集[9]。而白鲢鱼肌动球蛋白在30 ℃时蛋白开始变性聚集,超过40 ℃时分子间二硫键形成,且其影响与pH值(1~13)和离子强度(0.2~2.0 mol/L NaCl)有关,在pH 5.42时,肌动球蛋白的溶解度最低,而盐浓度主要影响蛋白的溶解度,对热处理过程中二硫键的断裂与形成没有影响[3]。对罗非鱼肌球蛋白的研究发现,表面疏水性和巯基含量随着温度的升高而增大,且肌球蛋白轻链由于α-螺旋结构的影响热稳定性较好,电泳分析显示二硫键对肌球蛋白重链的热聚集至关重要[10]。对鲢鱼肌球蛋白的研究发现二硫键和疏水相互作用是导致蛋白聚集的主要因素[11]。本文以罗非鱼肌球蛋白为研究对象,研究了不同离子强度条件下肌球蛋白热诱导凝胶形成过程及机理,为重组类鱼肉制品及凝胶类鱼肉制品的生产提供理论依据和指导。
1 材料与方法
1.1 材料与试剂
活罗非鱼(Oreochromisspp.):湛江市昌大昌超市(2016.10~12),长30 cm,重1 kg。宰杀取其白肉部分切小块搅碎,并于4 ℃冰箱中保存备用。
二硫苏糖醇(DTT),广州齐云生物科技有限公司;快速Lowry法蛋白含量测定试剂盒,上海荔达生物科技有限公司;其他均为分析纯。
1.2 仪器与设备
高速冷冻离心机,Beckman公司;恒温水浴锅,Bibby Scientific有限公司;荧光分光光度计,日本岛津公司;日立S-4800 扫描电子显微镜,Hitachi公司。
1.3 试验方法
1.3.1 肌球蛋白的提取
肌球蛋白的提取流程见文献[12]。采用LOWRY法[13]检测蛋白含量,以牛血清白蛋白(BSA)为标准物,测量波长为750 nm。
1.3.2 样品的制备
将提取的肌球蛋白用不同离子强度的缓冲液(20 mmol/L PBS,NaCl浓度分别为0、50、150、600 mmol/L,pH 7.0)透析24 h,所得即为不同离子强度下的肌球蛋白溶液。取适量的不同离子强度下的肌球蛋白(2 mg/mL)溶液置于比色管中,进行热处理(20~80 ℃,1 ℃/min),每10 ℃取样,进行溶解度、浊度、表面疏水性和巯基含量的测定。
1.3.3 溶解度的测定
将热处理后的肌球蛋白溶液离心(50 000×g,15 min,4℃)取上清液,采用LOWRY法[13]检测其蛋白含量[12]。以下各实验每个样品均重复3次重复测定3次。
(1)
1.3.4 浊度的测定
参照LIU[3]的方法稍加修改。取3 mL热处理后的肌球蛋白溶液(蛋白质量浓度0.5 mg/mL),在350 nm下测定肌球蛋白溶液的吸光度(A350nm),即为肌球蛋白样品的浊度。
1.3.5 表面疏水性的测定
ANS荧光探针法[14]。将热处理后的肌球蛋白溶液离心取其上清液,并测定其浓度,梯度稀释蛋白(0.1、0.05、0.025、0.012 5 mg/mL),不同浓度的蛋白各取4 mL,加入20 μL的ANS溶液(8.0 mmol/L ANS,0.01 mol/L PBS,pH 7.0),振荡混匀,静置10 min(避光),使用荧光分光光度计检测样品的荧光强度(FI)。激发波长和发射波长分别为374 nm和485 nm,狭缝宽为5 nm。将添加探针样品荧光强度值减去对应样品的内源荧光强度值即为肌球蛋白的相对荧光强度值(RFI)。以RFI对蛋白质量浓度作图,其斜率为蛋白表面疏水性指标(ANS-S0)。
1.3.6 总巯基的测定
采用DTNB[15]的方法。
1.3.7 动态黏弹性的测定
动态黏弹性的测定参照BUAMARD[16]的方法并稍加修改,肌球蛋白样品的制备方法同凝胶的制备方法相似,只是不用进行热处理。取透析好的肌球蛋白溶液(20 mg/mL)进行流变学性质的测定。取3 mL肌球蛋白样品置于平板上,除去过量样品,为了防止样品蒸发,围绕平板周围滴加薄薄的一层液体石蜡,并盖上保温盖。设定参数:探头型号P35TiL,平板直径35 mm,间隙1 mm,应变1%,频率0.1 Hz;热处理温度范围:升温过程20~80 ℃、降温过程80~20 ℃,1 ℃/min。
1.3.8 凝胶化学作用力的测定
取适量的不同离子强度的肌球蛋白(蛋白质量浓度20 mg/mL)溶液分别置于烧杯中,制备肌球蛋白凝胶,20~80 ℃,1 ℃/min,80 ℃保温30 min,而后迅速放入冰水中冷却,置于4 ℃冰箱中过夜后用于凝胶化学作用力的和扫描电镜测定。化学作用力的测定方法参照TAN等[7]的方法。
1.3.9 扫描电镜的测定
参照兰冬梅[17]的方法。将制备好的凝胶样品用刀切成1 cm厚的小块,首先用2.5%的戊二醛溶液(pH 6.8)固定24 h,然后用0.1 mol/L PBS缓冲液(pH 6.8)重复洗涤3次,每次15 min。接着用不同体积分数的乙醇(50%、70%、80%、90%)梯度脱水,每次10 min。然后用100%的乙醇脱水3次,每次15 min。脱水后的样品用三氯甲烷脱脂1 h,最后分别用V(乙醇)∶V(叔丁醇)=1∶1的混合液和100%的叔丁醇溶液各置换1次,每次15 min。在-80 ℃下冷冻24 h,并用真空冷冻干燥机冻干。采用离子溅射镀膜法对样品喷金,扫描电子显微镜观察其表面形貌。
1.4 数据处理与分析
利用SPSS 22软件进行方差分析,差异显著性(p<0.05)分析使用多重比较。采用Origin 8.5软件对各指标的变化趋势进行作图。
2 结果与分析
2.1 肌球蛋白热处理过程中溶解度和浊度的变化
肌球蛋白在热处理过程中溶解度和浊度的变化见图1。随着热处理温度的升高,肌球蛋白的溶解度逐渐降低,浊度逐渐变大。在试验范围内,当NaCl浓度为1 mmol/L时,肌球蛋白的溶解度只有36.63%,之后随着离子强度的增加,溶解度逐渐增大,当NaCl浓度为600 mmol/L时,肌球蛋白的溶解度达到最大值。肌球蛋白是盐溶性蛋白,在高离子强度下分散成单体存在,处于可溶状态,溶解度高,浊度值较小;而在体外低离子强度下,肌球蛋白易形成丝状聚合物,溶解度较小,浊度值高[18];随着热处理温度的升高,肌球蛋白的溶解度逐渐降低,浊度值增大,因为温度升高使肌球蛋白变性聚集,在高浓度时就会形成凝胶;低离子强度(1、50 mmol/L NaCl)条件下肌球蛋白的溶解度在30 ℃就显著下降,而生理离子(150 mmol/L NaCl)及高离子强度(600 mmol/L NaCl)下,肌球蛋白溶解度的显著降低则出现在40 ℃(p<0.05)。说明了不同离子强度下肌球蛋白的变性温度不同。这主要与肌球蛋白头部的聚集有关[19],温度升高蛋白发生变性聚集,溶解度降低,浊度值变大。这与刘海梅[11]的研究结果一致,鲢鱼肌球蛋白的溶解度在40 ℃显著降低,浊度明显增大,且银鲤肌动球蛋白的浊度在40 ℃时变化最显著,在40 ℃之前变化不显著或没有变化,而高于40 ℃后逐渐趋于平稳[3]。浊度值的增大主要跟光的散射有关,加热导致肌球蛋白变性形成大的聚集体,增加了光的散射,因此浊度值逐渐变大。浊度反映了样品颗粒的大小,从而反映了肌球蛋白分子的聚集程度,对研究肌球蛋白热诱导凝胶起到辅助作用[20]。由此可见,不同离子强度下肌球蛋白的变性温度不同,这主要跟肌球蛋白在溶液中的存在状态有关。
2.2 肌球蛋白热处理过程中表面疏水性的变化
肌球蛋白的表面疏水性用来表征蛋白三级结构的变化。肌球蛋白在热处理过程中表面疏水性的变化见图2。未经热处理时,随着离子强度的增加,可溶性肌球蛋白表面疏水性明显增大(p<0.05),可能与高离子强度下肌球蛋白的溶解度较好以及肌球蛋白由粗丝转变为单体状态有关,使得更多的疏水基团暴露[18],对鸡胸肌球蛋白的研究也表明在高离子强度下的ANS-S0值最大[21]。随着热处理的进行,肌球蛋白表面疏水性逐渐增加,分子部分展开,且不同离子强度条件下变化不完全相同。当NaCl浓度为1、50、150 mmol/L时,温度为30 ℃时肌球蛋白的ANS-S0值显著增加,而高离子强度(600 mmol/L NaCl)下,肌球蛋白的ANS-S0值急剧增加则发生在40 ℃时(p<0.05)。这可能是因为温度较低(30 ℃)时,高离子强度下肌球蛋白还没有变性或小部分变性,肌球蛋白的疏水基团大都包埋在蛋白质分子内部;然而随着温度的逐渐升高,肌球蛋白受热就会发生变性,肌球蛋白的双螺旋结构解开,尾部的疏水性氨基酸逐渐从包埋状态开始转变,暴露于蛋白分子表面,导致他们相互聚集形成疏水性区域,随后发生疏水相互作用,蛋白表面的ANS-S0值就会随着变性温度的逐渐升高而逐渐增大[11]。比目鱼肌球蛋白热诱导凝胶的研究也发现类似的现象,随着温度的升高ANS-S0值逐渐增大,蛋白的结构发生改变[1]。肌球蛋白在热处理过程中ANS-S0值的增大说明了肌球蛋白在热处理过程中发生了变性,肌球蛋白的三级结构受到破坏,同时也说明了疏水相互作用参与了凝胶的形成,也说明了高离子强度下肌球蛋白的热稳定较好。
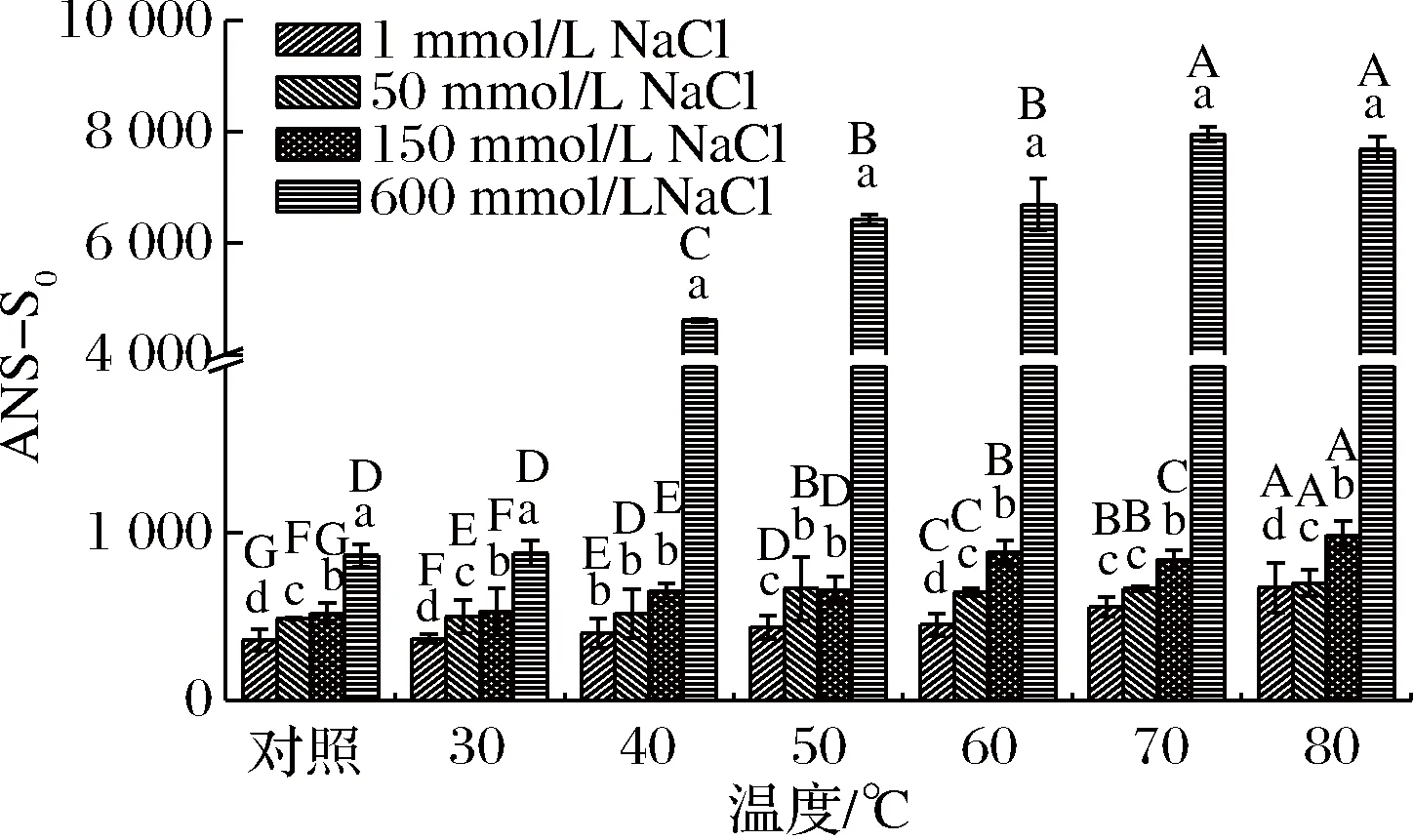
图2 不同离子强度条件下热处理对罗非鱼肌球蛋白体系表面疏水性的影响Fig.2 Effect of heating treatment on surface hydrophobicity of tilapia myosin dispersion under different ionic strength conditions
2.3 肌球蛋白热处理过程中巯基含量的变化
巯基属于较弱的次级键,主要是用来维持蛋白的三级结构,巯基的变化可以用来反映蛋白变性的程度[22]。肌球蛋白在凝胶形成过程中伴随着巯基含量的变化。由图3可以看出,不同离子强度下,肌球蛋白巯基含量差异显著,并且随着温度的升高,巯基含量显著下降(p<0.05),是因为随着温度的升高巯基被氧化形成二硫键,使巯基含量降低[1]。由此可以推断二硫键参与了凝胶的形成。而银鲤肌动球蛋白在较高温度(≥40 ℃)下由于巯基氧化或二硫化物的内部交换形成了二硫键,其总巯基含量显著减少。不同离子强度下巯基的变化情况不完全相同,低离子强度(1、50 mmol/L NaCl)下,当温度低于40 ℃时巯基变化不显著(p<0.05);生理离子强度(150 mmol/L NaCl)和高离子强度(600 mmol/L NaCl)下巯基含量在30 ℃就显著减少。低离子强度下肌球蛋白的变性温度较高,可能是因为此时的温度不足以使蛋白完全展开使埋藏在蛋白内部的巯基暴露。总巯基含量在线性升温(20~80 ℃)范围内显著减少,不仅说明了凝胶网络的形成有二硫键的参与,还预示了肌球蛋白头部参与了蛋白的凝聚。

图3 不同离子强度条件下热处理对罗非鱼肌球蛋白体系总巯基含量的影响Fig.3 Effect of heating treatment on total SH content of tilapia myosin dispersion under different ionic strength conditions
2.4 肌球蛋白热诱导动态弹性模量的变化
动态弹性模量反应了肌球蛋白从溶液状态逐渐变为凝胶状态,定量描述每一个温度点下热凝胶形成的流变参数的变化。图4为离子强度对肌球蛋白动态弹性模量的影响。随着离子强度的增大,肌球蛋白的弹性模量呈现出一个逐渐增大的趋势,说明了离子强度对肌球蛋白的弹性模量(G′)影响显著(p<0.05)。当温度达到40~50 ℃时,肌球蛋白首次出现最大G′值。不同离子强度下,肌球蛋白达到最大G′值的温度不同,当NaCl浓度为150和600 mmol/L时,肌球蛋白的最大G′值所对应的温度为50 ℃;当NaCl浓度为1、50 mmol/L时,肌球蛋白在45 ℃达到最大G′值。而比目鱼肌球蛋白的弹性模量在34 ℃首次达到最大值,这可能是凝胶劣化的初始温度[1]。初始肌球蛋白弹性模量的增加可能是由于低温条件下蛋白和蛋白之间的相互作用引起的。在某种程度上肌球蛋白的弹性网络结构得到加强,形成了较为疏松的凝胶网络结构[1]。随着温度的进一步升高至50~55 ℃,肌球蛋白的弹性模量急剧下降。这可能是有2个原因引起的:(1)在50~55 ℃温度范围内,热激活蛋白酶具有较高的活性,降解了肌球蛋白,形成了较为松散的凝胶网状结构。(2)肌球蛋白的构象转变可能破坏蛋白质网络的完整性并且增加了半凝胶的流动性[23]。随着温度的继续升高,弹性模量又逐渐增大,当温度为55~80 ℃时,弹性模量值逐渐趋于稳定。逐渐稳定的弹性模量值说明了在较高温度下形成了稳定坚固的三维网状结构,这主要归因于二硫键和疏水相互作用。在降温阶段,弹性模量继续增加,这说明了冷却使凝胶的网状结构得到加强。

图4 不同离子强度条件下罗非鱼肌球蛋白体系热诱导动态弹性模量的变化Fig.4 Changes of heat-induced dynamic elastic modulus of tilapia myosin dispersion under different ionic strength conditions
2.5 肌球蛋白热诱导凝胶的化学作用力
在肌球蛋白形成凝胶的过程中,蛋白构象发生变化,形成新的分子间作用力,变性的蛋白质分子有序聚集形成三维网状结构,此时体系中蛋白分子的相互作用力达到一种平衡状态[24]。本试验研究了不同离子强度条件下肌球蛋白热诱导凝胶的化学作用力。由图5可知,当NaCl浓度为1 mmol/L时,对应热诱导凝胶的疏水相互作用和非二硫共价键所占的比例较大,是维持低盐浓度条件下肌球蛋白蛋白凝胶结构的主要作用力,而离子键和氢键所占的比例较小,在凝胶形成过程中只参与肌球蛋白分子尾部的缠绕而不参与头部的聚集[11]。鱼糜凝胶过程中疏水作用显著增强,疏水相互作用是维持凝胶稳定的化学作用力[25],这与我们的试验结果基本一致。当NaCl浓度为50 mmol/L时,疏水相互作用是维持蛋白凝胶三维网状结构最主要的作用力;随着离子强度的增大,离子键的含量显著增大,但在生理离子强度(150 mmol/L NaCl)条件下,凝胶的离子键的含量显著减小(p<0.05);而氢键随着离子强度的增大与离子键的变化基本一致;离子强度对凝胶疏水相互作用的影响显著(p<0.05),随着离子强度的增大,凝胶的疏水相互作用逐渐增强,在NaCl浓度为600 mmol/L时有下降的趋势;离子强度对二硫键的影响显著,这说明了二硫键参与了凝胶的形成。对鸡胸肌原纤维蛋白研究的发现,疏水相互作用对其凝胶的形成至关重要,二硫键的作用不大;但是也有研究表明维持鲢鱼鱼糜凝胶网状结构稳定的主要化学作用力是二硫键[27]。

S1-离子键;S2-氢键;S3-疏水相互作用;S4-二硫键;S5-非二硫共价键图5 不同离子强度条件下罗非鱼肌球蛋白热凝胶化学作用力的变化Fig.5 Changes of chemical interactions of heat-induced gelation from tilapia myosin under different ionic strength conditions
2.6 肌球蛋白热诱导凝胶的微观结构
在实验范围内,肌球蛋白在较低离子强度条件下(1、50 mmol/L NaCl)形成不透明的凝胶,而在生理离子(150 mmol/L NaCl)和高离子强度(600 mmol/L NaCl)下形成透明的凝胶,由此进一步通过扫描电镜研究凝胶的亚显微结构。由图6可知,在实验范围内,不同离子强度下的肌球蛋白体系经热处理后均形成了较为稳定的三维网状结构,比较而言,在低离子强度下,肌球蛋白热诱导凝胶不均一,孔洞较大;而在高离子强度下则形成较均匀的表面结构,且形成的凝胶有序、孔径细小,凝胶的结构也比较致密,其三维网状结构稳定,这是因为在高离子强度下,肌球蛋白以单体形式存在,在经过热处理后,先凝聚形成颗粒,然后再交联形成比较均一的网络结构,多孔性佳。这与徐幸莲[19]的研究结果一致,在0.25 mmol/L KCl条件下骨骼肌肌球蛋白热诱导形成细丝的三维网状结构,而在0.6 mmol/L KCl条件下则形成球状颗粒凝集的凝胶立体结构。根据高聚物理论,聚合物分子单体越小越均匀,聚合物的弹性越好。因此认为在高离子强度下形成的凝胶弹性较高,与动态流变学的检测结果一致,当NaCl浓度为600 mmol/L时,肌球蛋白热诱导弹性模量最大。

图6 不同离子强度条件下罗非鱼肌球蛋白热诱导凝胶的微观结构图Fig.6 Scanning electron micrographs of heat3induced gels from tilapia myosin under different ionic strength conditions
3 结论
不同离子强度下,随着热处理温度的升高,蛋白受热变性、聚集,肌球蛋白的溶解度显著减小,浊度增大;温度升高使得肌球蛋白去折叠,埋藏在分子内部的疏水基团暴露,表面疏水性显著增加,巯基氧化形成二硫键,巯基含量显著减小,说明二硫键参与肌球蛋白热诱导凝胶的形成;不同离子条件下,蛋白的热稳定性不同,高盐条件下肌球蛋白的热稳定性更好;维持凝胶三维结构的主要作用力是疏水相互作用、二硫键和非二硫共价键,高盐条件下,肌球蛋白热诱导的凝胶孔洞小而均匀,而低盐浓度条件下,热诱导肌球蛋白凝胶孔洞较多、不均匀,结构不稳定。

