超高效液相色谱-三重四极杆质谱法测定人尿中9种邻苯二甲酸酯代谢物
张 续, 邱 天, 付 慧, 杨艳伟, 赵 峰, 林少彬, 胡小键
(中国疾病预防控制中心环境与健康相关产品安全所, 北京 100021)
邻苯二甲酸酯(PAEs)是一类重要的人工合成化学品,被广泛添加到各种工业产品、医疗器械、食品包装及个人护理品中[1-3]。PAEs已被证明是一类内分泌干扰物,具有潜在的生殖毒性、发育毒性、神经毒性及肝脏毒性[4-6]。流行病学结果表明,PAEs暴露与多种疾病相关,如导致幼童生殖器发育畸形、早熟、增加体重指数、导致哮喘及过敏反应、增加糖尿病患病率等[7-9]。为此,包括我国在内的多个国家都对PAEs的使用进行了限制[10]。
我国是PAEs生产、销售量大国,消耗量亦呈逐年上涨趋势。PAEs在使用过程中极易迁移至环境中,目前在我国大气、土壤、水体等环境介质中均有检出[11-14]。日常生活中,食品、呼吸、饮水、用药以及护肤品使用都是摄入PAEs的重要途径。PAEs在人体内的半衰期短,可迅速水解为活性较强的单酯,并进一步发生氧化或羟基化反应,再经葡萄糖醛酸化后经尿液排出。因此,美国、加拿大在其国家人体生物监测计划中,将尿中PAE代谢物作为重要的生物标志物,用于评估PAEs的人体内暴露[15,16]。而建立准确、可靠的分析测定方法对于开展PAEs暴露评估十分重要。
在国外,尿中PAE代谢物测定主要采用在线固相萃取液相色谱-串联质谱的方法[17,18]。该方法由美国疾病预防控制中心建立,并成功用于美国人体生物监测项目。近期,国内建立了全自动固相萃取串联质谱测定10种PAE代谢物的测定方法[19]。因上述方法的固相萃取装置在国内普及率不高,导致方法推广应用时受到一定限制。2011年,本实验室[20]利用离线固相萃取高效液相色谱-串联质谱建立了人尿中11种PAE代谢物的测定方法。该方法对邻苯二甲酸单辛酯(MOP)、邻苯二甲酸单异癸酯(MDP)和邻苯二甲酸单异壬酯(MNP)等长链PAEs具有较好保留回收,但对邻苯二甲酸单甲酯(MMP)和邻苯二甲酸单乙酯(MEP)等短链PAEs的灵敏度不高,样品测定时受到杂质干扰大。但相关研究[21,22]显示,人群实际尿液中的MOP、MDP、MNP等长链PAE代谢物含量检出率极低。
基于上述研究背景,本文建立了尿中9种常见PAE代谢物的离线固相萃取-超高效液相色谱-串联质谱测定方法。该方法操作简便、结果准确、灵敏度高、重现性好,能有效分离多种同分异构体,可用于尿液中9种常见PAE代谢物的测定。
1 实验部分
1.1 仪器与试剂
Waters Acqutiy UPLC-class型高效液相色谱仪(美国沃特世公司); API 4000型三重四极杆质谱仪,配电喷雾离子(ESI)源(美国AB公司);纯水仪(美国颇尔公司);漩涡震荡仪(美国Scientific Industries公司);电子天平(美国丹佛仪器公司)。Waters 0.45 μm GHP滤膜,Waters ACQUITY UPLC BEH Phenyl色谱柱(100 mm×2.1 mm, 1.7 μm), Waters OASIS MAX固相萃取柱(60 mg, 3 mL)(美国沃特世公司); Supelco VISIDRY固相萃取装置(美国Supelco公司)。
MMP、MEP、邻苯二甲酸单苄酯(MBZP)、邻苯二甲酸单环己酯(MCHP)、邻苯二甲酸单(2-乙基-5-氧己基)酯(MEOHP)、邻苯二甲酸单(2-乙基-5-羟己基)酯(MEHHP)、邻苯二甲酸单甲酯内标(MMP-[13C4])、邻苯二甲酸单乙酯内标(MEP-[13C4])、邻苯二甲酸单苄酯内标(MBZP-[13C4])、邻苯二甲酸单环己酯内标(MCHP-[13C4])、邻苯二甲酸单(2-乙基-5-氧己基)酯内标(MEOHP-[13C4])、邻苯二甲酸单(2-乙基-5-羟己基)酯内标(MEHHP-[13C4])、邻苯二甲酸单正丁酯内标(MNBP-[13C4])、邻苯二甲酸单(2-乙基己基)酯内标(MEHP-[13C4]),质量浓度均为100 mg/L,纯度均大于95%,购于美国Cambridge Isotope Laboratories。邻苯二甲酸单异丁酯(MIBP)、邻苯二甲酸单正丁酯(MNBP)、邻苯二甲酸单(2-乙基己基)酯(MEHP),纯度均大于95%,购于美国Accu Standard公司。邻苯二甲酸单异丁酯内标(MIBP-[2D4])纯度大于98%,购于加拿大TRC公司;含MEP、MIBP、MNBP、MEOHP、MEHHP、MEHP、MBZP的吸烟人群尿中有机污染物标准参考物质(简称标准参考物质)购于美国国家标准技术研究院(NIST)。
葡萄糖醛酸酶(85 000 U/mL)液体酶和葡萄糖醛酸酶固体酶购于美国Sigma公司;乙腈购于德国Merck公司;乙酸铵和甲酸(均为HPLC级)购置于美国CNW公司;乙酸(纯度大于99.8%)购于美国Fluka公司;氨水(25%~28%,体积分数,下同)购于美国Damas-beta公司;乙酸乙酯(HPLC级)购于美国Fisher公司;纯水为纯水仪所制超纯水,18.2 MΩ·cm。
1.2 溶液配制
准确称取MIBP、MNBP、MEHP及MIBP-[2D4]各0.010 0 g,用甲醇定容至10.0 mL。用甲醇稀释10倍,配制成100 mg/L标准储备液。分别取MMP、MEP、MCHP、MBZP、MIBP、MEOHP、MEHHP和MEHP标准储备液1.0 mL, MNBP标准储备液3.0 mL,用甲醇定容至25.0 mL,配制成9种PAE代谢物混合标准储备液,于4 ℃保存待用,其中MNBP为12.0 mg/L,其余8种物质均为4.0 mg/L。
分别取MMP-[13C4]、MEP-[13C4]、MCHP-[13C4]、MBZP-[13C4]、MIBP-[2D4]、MEOHP-[13C4]、MEHHP-[13C4]、MEHP-[13C4]和MNBP-[13C4]内标储备液1.0 mL,用甲醇定容至25.0 mL,配制成4.0 mg/L的9种PAE代谢物内标使用液,于4 ℃保存。
用甲醇将PAE代谢物混合标准储备液逐级稀释为2.0、1.0、0.5、0.1、0.05和0.01 mg/L标准序列溶液,4 mg/L内标使用液稀释为1 mg/L。分别向7支5 mL离心管中加入2 mL人工尿液,加入100 μL上述标准序列溶液、40 μL 1 mg/L内标溶液、20 μL葡萄糖醛酸酶、500 μL 1 mol/L乙酸铵溶液(pH=6.5),与样品一起进行前处理后,标准工作曲线的质量浓度分别为0、1、5、10、50、100和200 μg/L(MNBP为此曲线质量浓度的3倍),内标质量浓度为40 μg/L。
1.3 实验条件与方法
尿液酶解:冷冻尿液先在4 ℃冰箱中解冻过夜再放置室温,充分震荡后取2 mL,加入500 μL乙酸铵溶液(1 mol/L, pH 6.5),加入40 μL 1 mg/L同位素内标,加入20 μL葡萄糖醛酸酶,充分震荡后在37 ℃水浴中避光酶解2 h,加入1 mL 25%~28%氨水,充分震荡后以1 500 r/min的速度离心10 min,取上清进行固相萃取。
固相萃取:依次用3 mL乙腈和3 mL纯水活化OASIS MAX固相萃取柱,上清液依靠自然重力过柱(速度保持在1 mL/min);后依次用3 mL水和3 mL乙腈快速淋洗,空气吹干8 min;用3 mL含2%(体积分数,下同)甲酸的乙腈-乙酸乙酯(1∶1, v/v)洗脱。洗脱液氮吹近干,用5%乙腈水溶液定容至1 mL,样品涡旋混匀30 s后过0.45 μm GHP滤膜,上机待测。
色谱柱为Waters ACQUITY UPLC BEH Phenyl (100 mm×2.1 mm, 1.7 μm)。流动相A为0.1%乙酸水溶液,流动相B为0.1%乙酸乙腈溶液。梯度洗脱:0~14.5 min, 95%A~50%A; 14.5~18.0 min, 50%A~10%A; 18.0~19.0 min, 10%A; 19.0~19.5 min, 10%A~95%A; 19.5~23.0 min, 95%A。流速为0.3 mL/min,柱温箱温度为室温,进样量为10 μL。
离子化方式:ESI-;检测方式:多离子反应监测(MRM);碰撞气(CAD)压强:3.4×104Pa;气帘气(CUR)压强:2.1×105Pa;雾化气(GS1)压强:1.7×105Pa;加热气(GS2)压强:2.1×105Pa;喷雾电压(IS): -4 500 V;去溶剂温度(TEM): 450 ℃;扫描时间:50 ms。9种PAE代谢物及对应同位素内标的保留时间、离子对、碰撞电压(CE)和去簇电压(DP)等参数见表1。
2 结果与讨论
2.1 前处理优化
2.1.1酶的选择
以标准参考物质为样品,比较不添加酶、添加固体酶和添加液体酶3种方式对标准参考物质包含的7种PAE代谢物测定值的影响。结果显示,添加葡萄糖醛酸酶后PAE代谢物测定值高于不添加酶的测定值,说明在前处理过程中对样品进行去葡萄糖酸基酶解处理十分必要。添加液体酶可获得与标准参考物质更为接近的测定结果(见表2)。因此本文选择添加液体酶。此外,PAE代谢物在尿中以游离态和结合态共存。为探讨9种PAE代谢物在尿中的不同存在形式,选择10个不同来源的尿液样品,分别对其进行不加酶和加酶处理,并测定两种处理方式下的9种PAE代谢物质量浓度C1(不加酶)和C2(加酶)。当C1/C2大于0.5时,说明该类物质主要以游离态形式存在;当C1/C2小于0.5时,则表示该类物质主要以结合态存在。结果如图1所示,MMP、MEP、MBZP在尿液中的存在形式以游离态为主,而MEHP以结合态为主。

表 1 9种邻苯二甲酸酯(PAE)代谢物及同位素内标的质谱参数
* Quantitative ion.

表 2 PAE代谢物标准参考物质在不同酶解方式中的质量浓度(n=3)

图 1 不酶解及酶解处理后尿中8种PAE代谢物的质量浓度比值Fig. 1 Ratio of mass concentrations of the eight PAE metabolites in the urine with or without enzymatic treatment C1: mass concentration of the PAE metabolites with enzymatic treatment (μg/L); C2: mass concentration of the PAE metabolites without enzymatic treatment (μg/L). MCHP was not detected.
2.1.2酶解时间的确定
分别用液体葡萄糖醛酸酶水解标准参考物质1.5、2和24 h,比较酶解时间对PAE代谢物测定结果的影响。以MEHHP为例,酶解1.5和2 h时测定标准参考物质中MEHHP的质量浓度分别为(20.6±0.5)和(23.6±0.8) μg/L。与水解1.5 h相比,水解2 h时的MEHHP质量浓度与标准参考物质中MEHHP的参考质量浓度(24.8±0.40) μg/L更为接近。而在酶解24 h时,MEHHP的质量浓度为(23.1±0.96) μg/L,与酶解2 h的质量浓度相比差异不显著。因此本文酶解时间最终确定为2 h。
2.1.3净化条件的优化
目前用于尿中PAE代谢物净化处理的固相萃取柱主要有Waters OASIS HLB柱[23]、VARIAN NEXUS柱[20]和Waters OASIS MAX柱[19]。Waters OASIS WAX柱虽未被用于尿中PAE代谢物测定,但可用于指甲、毛发中的PAE代谢物前处理净化[24]。比较了上述几种常用固相萃取柱对PAE代谢物的净化效果。结果显示,上述4种固相萃取柱对9种PAE代谢物均具有较好的保留特性。但Waters OASIS HLB需要两步净化,以有效去除尿中的碱性有机物及盐成分,操作步骤较为繁琐[23]。使用VARIAN NEXUS固相萃取柱时,MMP、MEP两种代谢物的色谱峰较宽,基线不稳,样品中目标化合物含量低时色谱峰形差,影响定量结果。使用Waters OASIS WAX柱对样品进行前处理后,收集了上样和淋洗过程的过滤液并上机测定,结果显示,淋洗液中可检出目标化合物,这表明在前处理过程中存在目标化合物损失。使用同样方法测定Waters OASIS MAX柱的上样及淋洗过滤液,未见目标化合物检出。洗脱液经氮气吹干,复溶后上机测定,各目标化合物均具有较好的色谱峰形。因此,本文选择Waters OASIS MAX柱对样品进行固相萃取净化。
Waters OASIS MAX柱为混合阴离子交换柱,具有阴离子交换和反相吸附两种模式。因此,向样品中加入氨水,可促进PAE代谢物离子化,增加其在Waters OASIS MAX柱上的保留能力。通过比较乙腈、甲醇和含2%甲酸的甲醇水溶液(2∶3, v/v)3种不同淋洗液,发现以3 mL乙腈淋洗后可获得相对较好的加标回收率。在洗脱液中加入适量甲酸可调节Waters OASIS MAX柱pH值,有助于PAE代谢物的洗脱。因此,进一步比较了含1%、2%和4%甲酸的乙腈-乙酸乙酯(1∶1, v/v)的洗脱效果,结果显示,用含2%甲酸的乙腈-乙酸乙酯(1∶1, v/v)洗脱能够获得相对满意的加标回收率。最后比较了不同用量的洗脱液(1~6 mL)对洗脱效果的影响,确定使用3 mL含2%甲酸的乙腈-乙酸乙酯(1∶1, v/v)溶液进行洗脱。
2.2 液相色谱方法的优化
含苯基的硅胶键合固定相对PAE类物质具有良好的分离效果。因此,本文比较了CSH Fluoro-Phenyl柱、BEH Phenyl柱和Phenyl柱对9种PAE代谢物的分离效果。结果显示,Phenyl柱对大部分PAE代谢物分离效率良好,但不能实现MIBP和MNBP两种同分异构体的分离,其保留时间接近,色谱图呈现交叉峰,相互之间影响定量分析。CSH Fluoro-Phenyl柱和BEH Phenyl柱均能实现PAE代谢物的有效分离。但与BEH Phenyl柱相比,目标化合物在CSH Fluoro-Phenyl柱上的保留较长。在实际工作中,使用BEH Phenyl柱比CSH Fluoro-Phenyl柱节约1/3工作时间。因此,选用BEH Phenyl柱对9种PAE代谢物进行分离。
PAE代谢物是一系列具有极性差异的羧基化合物,在中性或碱性条件下可出现不同程度的解离。因此,在流动相中加入适量乙酸可抑制羧酸解离,增强目标化合物在色谱柱上的保留。通过调研文献[19,22],本文采用0.1%乙酸水溶液和0.1%乙酸乙腈作为流动相,对目标化合物进行梯度洗脱,以实现物质的有效分离。实际尿液中,MBP以MIBP和MNBP两种同分异构体状态共存,分别代表了不同种类PAE物质的暴露。其中MIBP是DIBP(邻苯二甲酸二异丁酯)的代谢产物,而MNBP是DNBP(邻苯二甲酸二正丁酯)和BZBP(邻苯二甲酸二芐基酯)的代谢产物。通过对两种同分异构体的有效分离,可反映出人体受到不同PAEs的暴露情况。在目前国内的研究方法[22,25,26]中,尚未见到能将MIBP和MNBP进行有效分离。本文通过优化梯度洗脱程序,实现了MIBP和MNBP的有效分离和精准定量(见图2)。
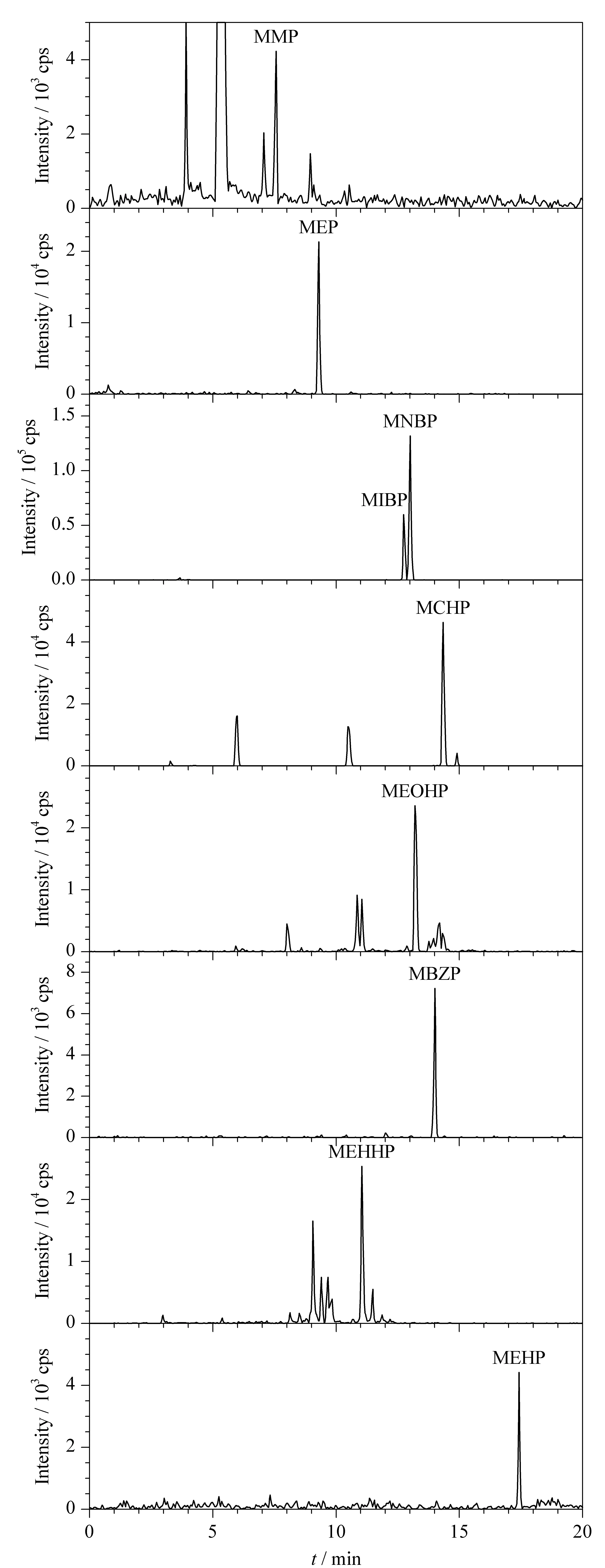
图 2 9种PAE代谢物在尿液中的提取离子色谱图Fig. 2 Extracted ion chromatograms of the nine PAE metabolites in the urine sample MCHP and MBZP showed spiked (2 μg/L) human urine sample.
2.3 基质效应评价及定量方法选择
利用HPLC-MS/MS进行复杂基质的污染物测定时,其复杂基质可能会对测定结果产生影响,因此,在方法建立时需进行基质效应(ME)评价[24]。本方法中,由于无法获得不含PAE代谢物的实际尿液基质,因此利用人工尿液代替实际尿液基质。分别用人工尿液和乙腈溶液配置两条标准曲线,质量浓度为0、0.39、0.78、1.57、3.13、6.25、12.5、25、50、100和200 μg/L,将人工尿液配置的标准曲线进行前处理,与乙腈标准曲线一同上机测定,按文献[27]中基质效应计算方法对绝对基质效应进行评估。结果显示,9种PAE代谢物最终计算的|ME|范围为0.81%~15.42%,说明绝对基质效应良好。在评估相对基体效应时,选择了6份不同来源的实际尿液,将上述尿液进行前处理后,得到6个不同的尿液基质。取490 μL上述尿液基质,加入10 μL 100 μg/L9种PAE代谢物混合内标。通过计算9种同位素内标的质谱响应峰面积,评估其相对基质效应。结果显示9种PAE代谢物在不同来源的尿液基质中质谱信号强度稳定,峰面积精密度为8.3%,说明相对基质效应稳定。
基质效应评估结果显示,在进行定量检测时可用标准曲线代替基质匹配工作曲线。然而,本文在利用标准曲线和基质匹配工作曲线对NIST质控样进行定量分析时,发现以人工尿液为基质的基质匹配工作曲线对NIST质控样进行定量分析更为准确。虽然基质效应评价中表示基质效应可忽略,但为获得更为准确的测定结果,本文采用人工尿液基质匹配的标准工作曲线进行定量计算。
此外,评估了外标定量法的准确性。结果显示,标准曲线各点在前处理过程中出现不同程度的损失,无法呈现良好线性。而选择性质相似的同位素作为内标,能够提供准确的定性和定量信息,校正方法误差,显著提高方法的准确度和精密度。
2.4 线性范围、方法检出限和定量限
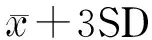
标准曲线拟合过程中采用不同的权重方式会对标准曲线定量结果造成影响。因此,本文比较了不加权重、1/x和1/x23种权重方式对定量结果的影响。结果显示,以1/x2权重模式下计算的标准曲线能更好兼顾低浓度标准点,而高浓度标准点不受影响。这说明当标准曲线线性范围跨度较大时,在标准曲线拟合时需将权重方式考虑在内。

表 3 9种PAE代谢物回归方程、相关系数、检出限、定量限及线性范围
Y: relative peak area ratio;X: mass concentration, μg/L.
表 4 尿中9种PAE代谢物在3个加标水平的回收率和精密度(n=6)
* Spiked levels of MNBP were 6, 30 and 150 μg/L.
2.5 回收率及精密度
以实际尿液进行3个加标水平的9种PAE代谢物加标回收试验,加标水平分别为2、10和50 μg/L(MNBP为6、30和150 μg/L),每个水平进行6次平行试验,进行前处理后上机测定。其回收率和精密度结果如表4所示,9种PAE代谢物的回收率分别为84.1%~122%,精密度为4.5%~14.3%。在同一天及不同天对实际尿液样品进行前处理后上机分析测定(n=6),以确定方法的日内精密度和日间精密度,结果如表4所示,9种PAE代谢物的日内精密度为1.2%~9.3%,日间精密度为2.3%~10.1%。
2.6 稳定性实验
随机选择15份人尿样本,分别在不同保存条件下对处理的样本进行稳定性考察,测定样品质量浓度与第一天测定结果比较,如表5所示,在-20 ℃保存14天后,样品测定值为0 h测定值的91.5%~107%,说明样品可在-20 ℃中保存14天。反复冻融3次的结果显示MMP和MBZP的准确度与0 h测定值相比较差,说明反复冻融影响样品测定,可能与低浓度物质降解或挥发有关。
表 5 9种PAE代谢物的稳定性(n=15)
ND: not detected.
2.7 实际样品测定
利用本方法测定50份北京市人群尿液样本。结果表明,除MCHP未检出外,其余8种PAE均可检出。除MBZP外,其余7种物质检出率为100%,结果见表6。测定结果显示,人尿中MNBP和MIBP的浓度较高,其中位值分别为219和56.7 μg/L, MEOHP和MEHHP等代谢物处于同一水平,中位值分别为13.3和17.8 μg/L。MMP、MEP和MEHP 3种代谢物存在水平较低,分别为8.90、9.09和6.95 μg/L。上述结果表明,北京市城市居民存在广泛的PAE暴露,需引起一定关注。

表 6 PAE代谢物在人尿中的测定值
P25-P70: mass concentration of PAE metabolites from 25th to 70th percentile. ND: not detected.
3 结论
本文建立了测定人尿液中9种PAE代谢物的UPLC-MS/MS分析方法。考察了酶的种类、酶用量、酶解时间和净化过程等,采用同位素内标法定量。本方法操作简便,结果可靠,检出限低,重现性好,已应用于生物样本的检测,为今后开展人体生物监测项目奠定了良好的实验基础。

