模拟移动床色谱分离二十碳五烯酸乙酯和二十二碳六烯酸乙酯
董 青, 李 敏, 杨亦文, 鲍宗必, 杨启炜, 张治国, 任其龙
(浙江大学化学工程与生物工程学院, 生物质化工教育部重点实验室, 浙江 杭州 310027)
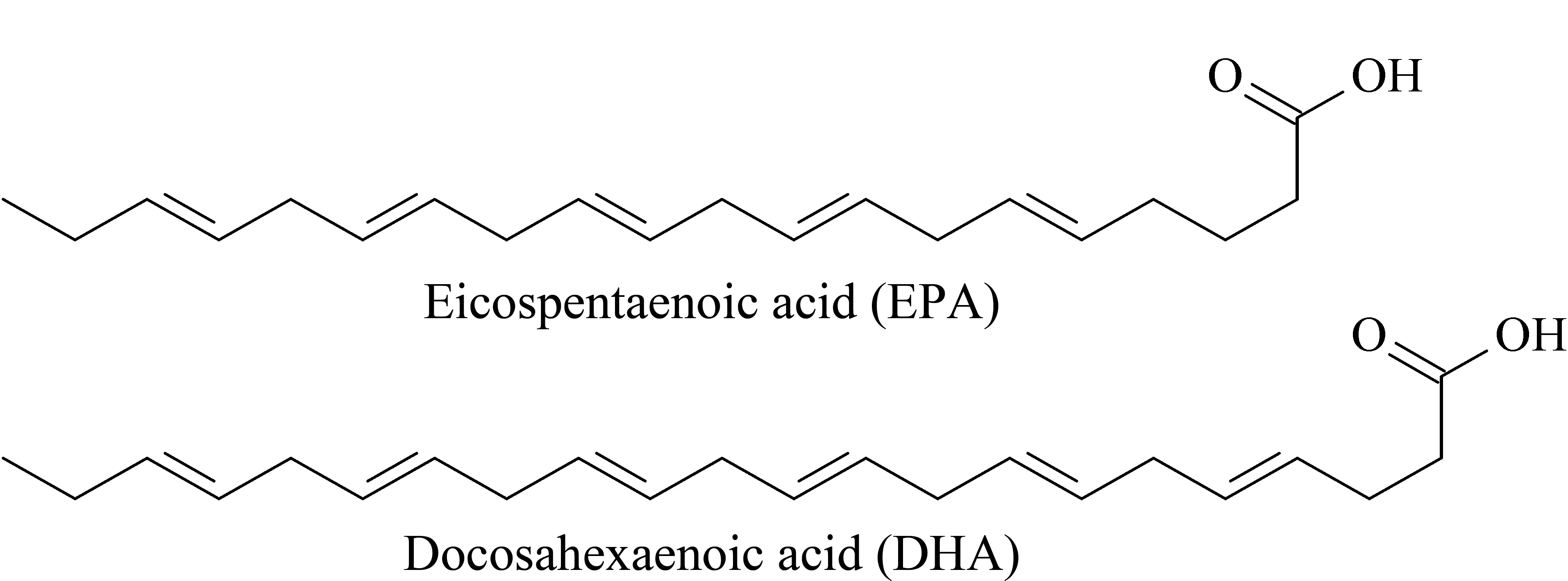
图 1 EPA和DHA的结构式Fig. 1 Chemical structures of EPA and DHA
ω-3多不饱和脂肪酸是人体自身不能合成的必需脂肪酸[1],对人类健康的重要性自20世纪80年代就被大量报道。特别是源于深海鱼油中的二十碳五烯酸(eicosapentaenoicacid, EPA)和二十二碳六烯酸(docosahexaenoic acid, DHA),它们是ω-3多不饱和脂肪酸中的重要成员,结构式如图1所示。大量流行病学和随机试验表明,它们在治疗心脑血管疾病[2,3]、炎症[4]、癌症[5-7]、抑郁症[8]、阿尔茨海默病[9]和促进婴儿生长发育[10]等方面有着一定的功效。目前市场上已经有许多鱼油膳食补充剂,还有治疗高甘油三酯血症(人体内甘油三酯水平大于或等于500 mg/dL)的ω-3鱼油处方药,如Lovaza[11](二十碳五烯酸乙酯(EPA-EE)含量46%、二十二碳六烯酸乙酯(DHA-EE)含量38%)、Vascepa[12](EPA-EE含量96%)、Epanova[13](EPA、DHA)。同时有许多研究[14,15]表明EPA和DHA的生理功能并不完全相同,因此需根据不同用途将两者分离,但是EPA和DHA结构相似、容易发生氧化等变性反应,分离难度大。目前有低温结晶法[16]、尿素包合法[17]、分子蒸馏法[18,19]、银离子络合法[20]、超临界萃取法[21,22]、脂肪酶法[23]等可从鱼油中富集EPA和DHA,但是这些方法很难将EPA与DHA分开;EPA与DHA的分离主要用色谱法[24-26],分离时EPA和DHA多以甲酯或者乙酯的形式存在。
20世纪60年代发展起来的模拟移动床(simulated moving bed, SMB)色谱技术,是连续化的制备色谱技术[27]。SMB分离具有产品纯度和回收率高、固定相利用率高、溶剂消耗小、可自动控制等优点,特别适合难分离两组分体系的规模化制备[28]。SMB技术在分离EPA与DHA方面也有一些报道。宋磊等[29]以二次分子蒸馏得到的较高纯度的鱼油乙酯为原料,以C18柱为固定相,甲醇/水(95∶5, v/v)为流动相,运用六区串联SMB工艺实现了EPA-EE、DHA-EE和杂质的3组分分离。Li等[30]在SMB上配置了8根C18柱,以甲醇洗脱EPA-EE和DHA-EE混合物,提取液中DHA-EE和提余液中EPA-EE的相对纯度达到99%。
本文在前人的基础上以PS/DVB聚合物为固定相,甲醇为洗脱剂,采用四区模拟移动床分离EPA-EE和DHA-EE;并对Ⅱ区和Ⅲ区流量、进料流量和进料浓度对分离的影响进行了探究,为工业化生产EPA-EE和DHA-EE单体提供实验探究基础。
1 实验部分
1.1 仪器、试剂与材料
高效液相色谱仪(美国Waters公司); CSEP®C9116模拟移动床(德国KNAUER公司); GC-2010 plus气相色谱仪(日本Shimadzu公司); Beckman Coulter LS13320粒度分布仪(美国库尔特公司); SU-8010场发射扫描电子显微镜(日本Hitachi公司)。
EPA-EE(纯度99%)、DHA-EE(纯度95%)、高纯度EPA-EE与DHA-EE混合物(纯度≥95%,质量比1∶1)(苏州仁普药业有限公司); PS/DVB聚合物填料(苏州纳微科技有限公司);十七酸甲酯(纯度>97%,日本TCI公司);甲醇(分析纯,国药集团化学试剂有限公司);甲醇(色谱纯,美国Tedia公司),乙醇(色谱纯,德国Merck公司),乙腈(色谱纯,美国Tedia公司)。
1.2 实验方法
1.2.1填料的表征
实验中所用到的PS/DVB聚合物填料,用粒度测试仪测定粒径分布,用扫描电子显微镜观察球形度和粒径分布。
1.2.2液相色谱脉冲进样实验和评价参数
液相色谱脉冲进样实验有两个部分,其一是为SMB分离选择合适的洗脱剂、填料粒径和操作温度,其二是测试8根半制备色谱柱(150 mm×10 mm, 20 μm)装填的均一程度。
EPA-EE和DHA-EE混合物溶于甲醇中,配制成1.0 g/L的溶液,在PS/DVB聚合物色谱分析柱(150 mm×4.6 mm)上进样并用甲醇洗脱;流动相流速1.0 mL/min,进样量10 μL,检测波长210 nm,用分离度RS来评价EPA-EE和DHA-EE分离的程度,从而确定较优的选择:
(1)
式中,tR,1和tR,2是两组分的保留时间(min),w1和w2是两组分的峰宽(min)。
尿嘧啶溶于甲醇,配制成0.1 g/L溶液,用于测定半制备色谱柱的总孔隙率εt。液相色谱操作条件为:流动相为甲醇;进样量10 μL;柱温40 ℃;检测波长254 nm。在0.5 ~2.5 mL/min的流速下测定尿嘧啶在8根半制备色谱柱上的保留时间,扣除仪器死时间后得到柱死时间t0,根据公式(2)做出回归直线,回归直线斜率的数值就是色谱柱总孔隙率εt:
t0=εtL/u
(2)
式中,t0是色谱柱柱死时间(min),L是柱长(cm),u是表观流速(cm/min)。
1.2.3模拟移动床实验和评价参数
在德国KNAUER公司CSEP®C9116四区SMB上分离EPA-EE和DHA-EE混合物,操作步骤如下:(1)准确称取一定量EPA-EE和DHA-EE混合物溶解于甲醇中,配成一定浓度的溶液,用0.45 μm的有机滤膜过滤后备用,准备足够量洗脱剂备用;(2)将8根柱子(150 mm×10 mm)装在SMB系统内,设置好切换时间10 min、温度40 ℃,以及4个泵的流量,温度达到设定值后开始实验;(3)待SMB系统达到平衡时取样,分别在提取液口和提余液口接一次完整切换时间的产品,分析产品组成。
在气相色谱上采用内标法测定SMB两出口产品的组成,内标物为十七酸甲酯。气相色谱分析条件为:Agilent J&W HP-5非极性柱(30 m×0.25 mm×0.25 μm);进样口温度250 ℃;柱温220 ℃;氢火焰检测器(FID)温度280 ℃;进样量1 μL;分流比1∶20。
SMB分离效果用纯度、回收率、固定相生产率、溶剂消耗4个参数评价。
纯度(%)为两出口中目标组分的浓度与两组分浓度和之比,是相对纯度:
(3a)
(3b)
回收率(%)为目标组分的含量与原料液中该组分的比值:
(4a)
(4b)
固相相生产率(g/(L5h))为在单位时间内单位体积的固定相所能生产的两目标产品的质量:
(5)
溶剂消耗(L/g)为生产单位质量的产品需消耗的溶剂体积:
(6)
上述式中A代表强吸附组分,B代表弱吸附组分。CEx,A、CRa,B分别是提取液和提余液中相应组分的质量浓度(g/L),QEx、QRa、QD、QF分别对应提取液出口流量、提余液出口流量、洗脱剂流量、原料进料流量(mL/min),Vcol是单根半制备色谱柱的体积(mL)。
2 结果与讨论
2.1 聚合物色谱填料表征结果
填料粒径均一、球形度良好在分析实验和实际生产中都十分重要[31],单分散的球形填料可以减小压降,便于放大后用于实际生产。图2的粒径分布图表明,20 μm的粒径呈现窄正态分布,测得的平均粒径为19.19 μm;图3的扫描电镜图表明,PS/DVB聚合物的球形度好,粒径分布均一。因此本实验选择的PS/DVB聚合物色谱填料具有工业放大的良好前景。
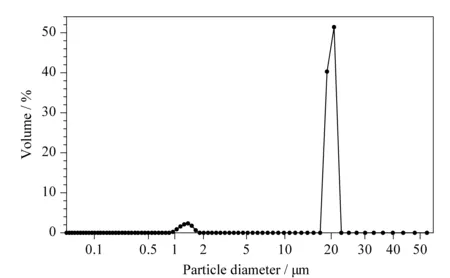
图 2 粒径20 μm的PS/DVB聚合物粒径分布图Fig. 2 Particle diameter distribution of poly(styrene-co- divinylbenzene) (PS/DVB) (particle diameter 20 μm)

图 3 粒径20 μm的PS/DVB聚合物扫描电镜图Fig. 3 Scanning electron microscopy (SEM) images of PS/DVB polymer (particle diameter 20 μm)
2.2 流动相的选择
在色谱分离中,固定相填料对样品的分离具有重要影响,合适的流动相对改善分离效果有重要的辅助作用[32]。实际工业中确定流动相时,不仅需要考虑分离度,还要考虑成本、柱压力降限制以及后续产品纯化的难易程度,因而低黏度、低沸点的纯溶剂是最佳的选择。
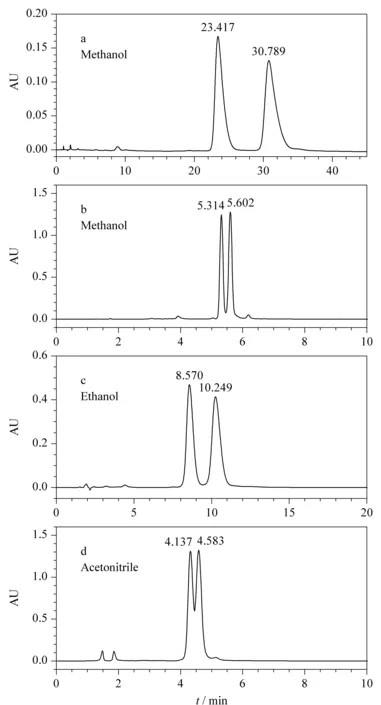
图 4 不同流动相洗脱EPA-EE和DHA-EE的流出曲线Fig. 4 Chromatograms of eicosapentaenoic acid ethyl ester (EPA-EE) and docosahexaenoic acid ethyl ester (DHA-EE) with different mobile phases Chromatographic column: (a, c, d) PS/DVB (150 mm×4.6 mm, 10 μm), (b) C18 (250 mm×4.6 mm, 5 μm); column temperature: 40 ℃; flow rate: 1.0 mL/min; injection volume: 10 μL; feed mass concentration: 1.0 g/L.
本实验选择了3种反相色谱常用的不同极性溶剂:甲醇、乙醇以及乙腈;探讨这3种溶剂对EPA-EE和DHA-EE在PS/DVB色谱柱(150 mm×4.6 mm, 10 μm)上分离的影响,并与实验室常用的C18柱(250 mm×4.6 mm, 5 μm)进行对比。图4为洗脱的流出曲线,EPA-EE和DHA-EE的出峰顺序由EPA-EE和DHA-EE纯品的保留时间确定,4个谱图中先流出的是弱保留组分EPA-EE,后流出的是强保留组分DHA-EE。
根据结果可知,3种流动相在PS/DVB柱上的洗脱强度依次为:乙腈>乙醇>甲醇;分离度依次为:甲醇>乙醇>乙腈。乙腈不能实现EPA-EE和DHA-EE的基线分离,而乙醇和甲醇均可以实现基线分离。乙醇为流动相时,EPA-EE和DHA-EE的分离度为1.83。甲醇在PS/DVB柱上的分离度达到2.75;而同样条件下,实验室常用的C18柱上的分离度仅为1.39。考虑到甲醇较乙醇便宜,且甲醇的黏度小,可以减小压降,沸点低更容易实现与产品分离,后续实验均采用纯甲醇为流动相。
2.3 粒径的选择
固定相填料的粒径对分离影响很大。分别选取了粒径为10、15、20、30、40 μm,孔径均为10 nm的PS/DVB聚合物装填在150 mm×4.6 mm柱子里,在温度为40 ℃、甲醇为流动相、流速1.0 mL/min、上样质量浓度1.0 g/L、上样体积10 μL的条件下比较了粒径对EPA-EE和DHA-EE分离的影响。EPA-EE和DHA-EE在不同粒径色谱柱上的色谱图如图5所示,这5种粒径的填料都能分离EPA-EE和DHA-EE的混合物。随着固定相粒径的增大,出峰时间提前,峰宽变宽,分离度减小。粒径10 μm分离效果最好,分离度可达2.75。粒径为15 μm时分离度为2.24,粒径20 μm时分离度为1.86,均能达到基线分离。粒径30 μm和40 μm则不能实现基线分离。因此,根据分离度,粒径10 μm是最佳的选择。
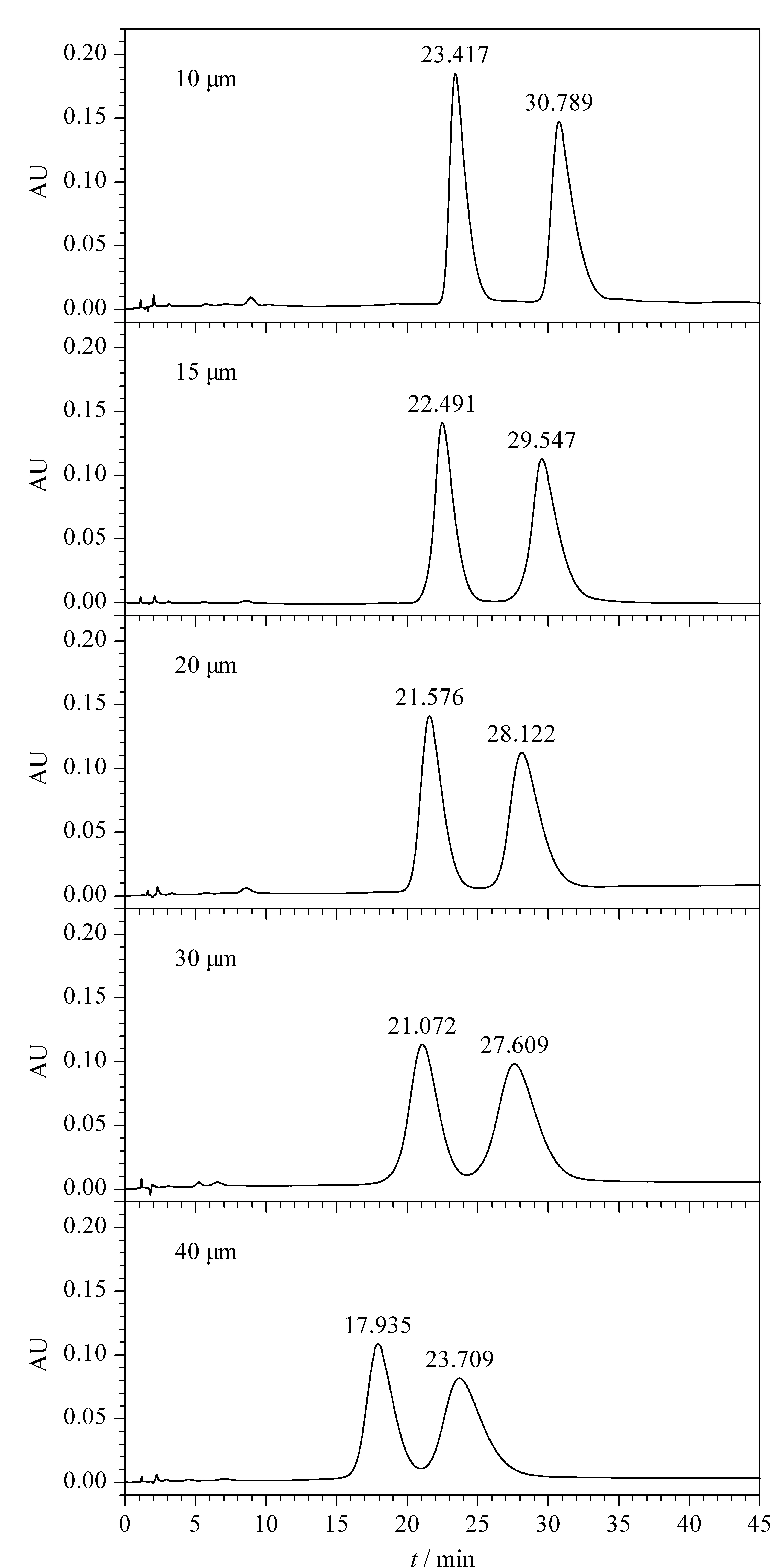
图 5 在不同粒径PS/DVB柱分离EPA-EE和 DHA-EE的色谱图Fig. 5 Chromatograms of EPA-EE and DHA-EE on PS/DVB columns with different particles diameters Chromatographic column: PS/DVB (150 mm×4.6 mm); mobile phase: methanol; column temperature: 40 ℃; flow rate: 1.0 mL/min; injection volume: 10 μL; feed mass concentration: 1.0 g/L.
在实际工业生产时,除了考虑分离度,柱压降也是一个重要的参数。在液相色谱上测定了不同粒径的PS/DVB填料的柱压降,柱规格为150 mm×4.6 mm,流动相为甲醇,柱温40 ℃。如图6所示,粒径10 μm的压降最大;当粒径增大到20 μm时,压降与30 μm时的已十分接近。同时考虑到分离度的影响,在工业生产中可采用粒径为20 μm的填料,在实验室分析中可采用粒径为10 μm的填料。
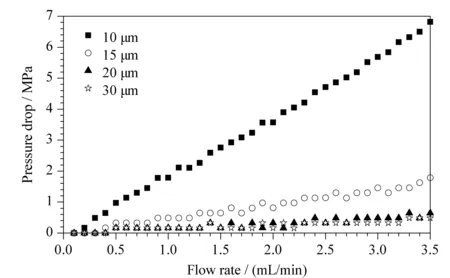
图 6 不同粒径PS/DVB的柱压降Fig. 6 Pressure drop of PS/DVB columns with different particle diameters Chromatographic column: PS/DVB (150 mm×4.6 mm); mobile phase: methanol; column temperature: 40 ℃.
2.4 温度的选择
提高温度可以缩短保留时间,对于分离度的影响则因分离物质不同而有所差别。在PS/DVB色谱柱(150 mm×4.6 mm, 10 μm)上测定了温度对EPA-EE和DHA-EE分离的影响,流动相为甲醇,流速1.0 mL/min,进样质量浓度1.0 g/L,进样量10 μL。不同温度下的流出曲线如图7所示。在20~50 ℃范围内,随着温度升高,EPA-EE和DHA-EE流出时间缩短,峰宽变窄,这说明随着温度增加,脱附速率加快,物质在色谱柱上停留时间变短。最重要的是,随着温度升高,分离度不断增大,因此选择较高的操作温度对分离更有利,考虑到PS/DVB聚合物适宜的操作温度在60 ℃以下,因此本实验选择40 ℃为较佳的操作温度。
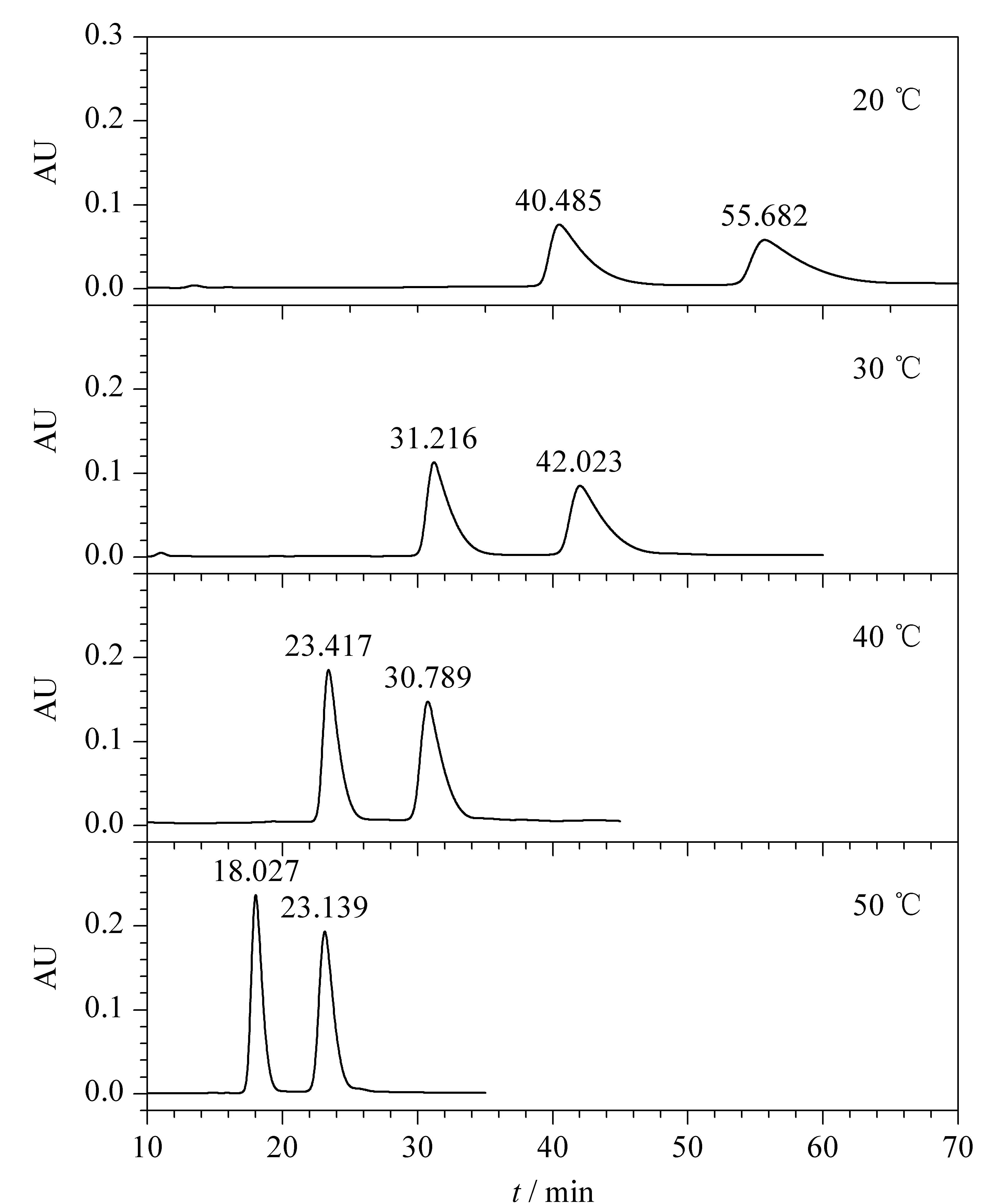
图 7 不同温度下EPA-EE和DHA-EE的流出曲线Fig. 7 Chromatograms of EPA-EE and DHA-EE at different temperatures Chromatographic column: PS/DVB (150 mm×4.6 mm, 10 μm); mobile phase: methanol; flow rate: 1.0 mL/min; injection volume: 10 μL; feed mass concentration: 1.0 g/L.
2.5 半制备色谱柱均一性的评价
10 μm的PS/DVB色谱填料虽然对EPA-EE和DHA-EE分离度高,但小粒径的填料压降较大。综合考虑分离度和压降,确定选用粒径20 μm、孔径10 nm的PS/DVB聚合物装填了8根半制备柱(150 mm×10 mm)。SMB分离系统的稳定运行要求8根色谱柱填装均一、性能相近[33]。按照1.2.2节中方法测定8根PS/DVB聚合物半制备色谱柱的总孔隙率,平均值为0.698,相对偏差在1%以内,这说明色谱柱的装填效果一致,不会影响SMB色谱系统运行的稳定性。
2.6 模拟移动床分离实验结果
根据上文对流动相种类、粒径和温度的考察结果,确定以甲醇为洗脱剂,操作温度40 ℃,填料粒径20 μm,在SMB色谱上分离EPA-EE和DHA-EE。3组不同条件的实验结果如表1所示。A组考察Ⅱ、Ⅲ区流量对分离EPA-EE和DHA-EE的影响,B组考察进料流量对分离的影响,C组考察进料浓度对分离的影响。从液相色谱上保留顺序可知,DHA-EE是强吸附组分,EPA-EE是弱吸附组分。因此在合适的操作参数下,DHA-EE从提取液口流出,EPA-EE从提余液口流出。
2.6.1Ⅱ、Ⅲ区流量对分离的影响
根据前人的研究[34],两个相近组分的分离是在SMB的Ⅱ区和Ⅲ区完成的。在Ⅰ区和Ⅳ区流量满足分离条件时,Ⅱ区和Ⅲ区的流量对EPA-EE和DHA-EE的分离有着至关重要的影响。A组实验中保持进料流量不变,只改变Ⅱ区Q2的流量,Ⅲ区的流量Q3也会增加。当Ⅱ、Ⅲ区流量增加时,提取液中DHA-EE的相对纯度缓慢增加,提余液中EPA-EE的相对纯度则先缓慢下降后迅速下降。这是因为当Ⅱ、Ⅲ区流量增大时,EPA-EE和DHA-EE的浓度峰均向提余液口移动,导致提余液中EPA-EE的纯度从93.8%下降到69.0%,提取液中DHA-EE的纯度则从83.0%上升到95.9%。因Ⅱ、Ⅲ区流量变化对两出口目标组分的纯度有着相反的影响,当Ⅱ、Ⅲ区流量增大时,提取液出口DHA-EE的回收率不断下降,提余液出口EPA-EE的回收率不断增加。因此存在一组最合适的Ⅱ、Ⅲ区流量,在此流量下两出口产品纯度均较高、回收率高、固定相生产率大,同时溶剂消耗小。在本实验流量变化范围内,综合考虑到产品纯度和回收率,A3为最佳的操作点,此时固定相生产率最大,为5.97 g/(L5h);溶剂消耗最小,为1.52 L/g。
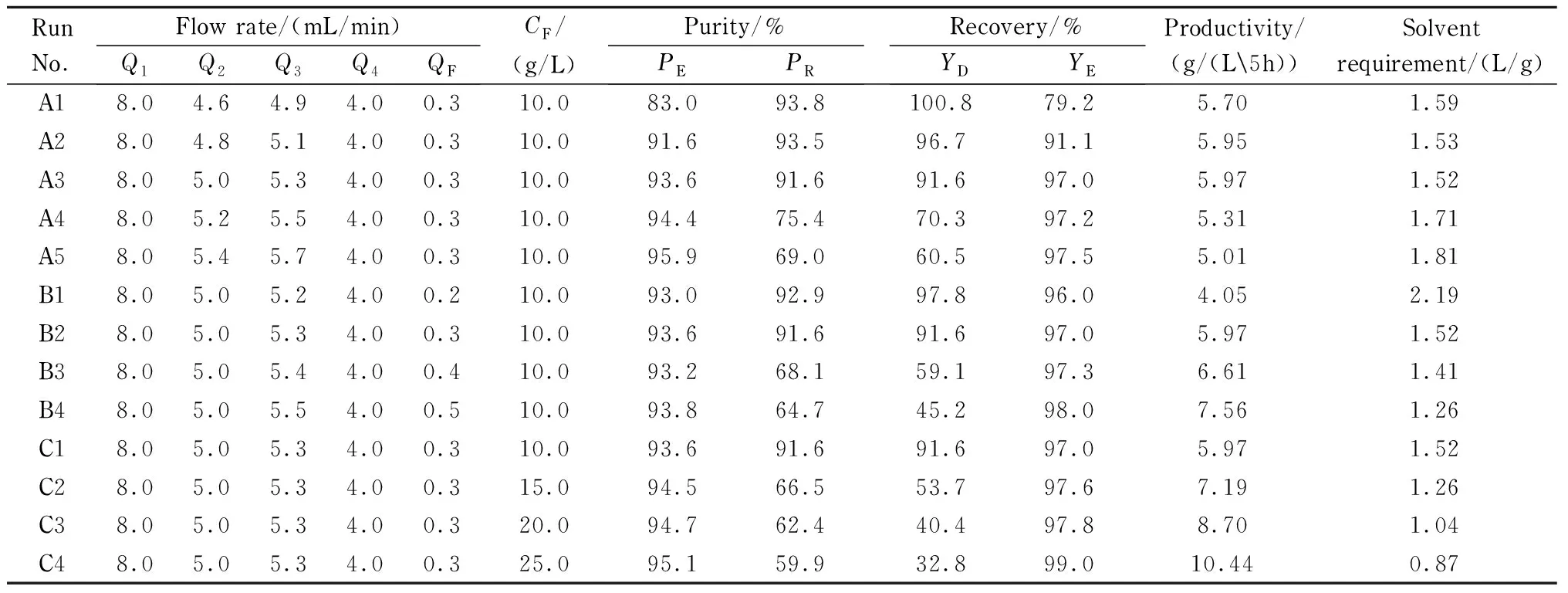
表 1 模拟移动床分离EPA-EE和DHA-EE的实验结果
Q1,Q2,Q3,Q4,QF: flow rates of zones Ⅰ, Ⅱ, Ⅲ, Ⅳ and feed;CF: feed mass concentration;PE: purity of extract;PR: purity of raffinate;YD: recovery of DHA-EE;YE: recovery of EPA-EE. Elution solvent: methanol; temperature: 40 ℃; switching time: 10 min.
2.6.2进料流量对分离的影响
加大进料流量可以提高SMB的处理能力,但过大的进料量会影响分离效果。在B组的实验中,Ⅰ、Ⅱ、Ⅳ区流量均保持不变,进料流量从0.2 mL/min增加到0.5mL/min。加大进料流量,提取液出口DHA-EE的纯度基本保持不变,提余液出口EPA-EE的纯度则不断下降,特别是当进料流速从0.3 mL/min增加到0.4 mL/min时,EPA-EE的纯度从91.6%降到68.1%。这是因为进料流量QF增大,Ⅲ区流量也相应增大,EPA-EE和DHA-EE更多从提余液中流出,导致提余液中EPA-EE的纯度急剧下降;而Ⅱ区流量没有改变,提取液出口中DHA-EE的纯度也就没有太大变化。EPA-EE和DHA-EE的回收率与它们纯度的变化趋势相反。另一方面,增大进样流量,固定相生产率不断增加,溶剂消耗在减小,但是两者变化的幅度趋于平缓。考虑到纯度和回收率是最主要的考察指标,因而B2对应的是此条件下的最佳进样量,为0.3mL/min。
2.6.3进样浓度对分离的影响
与增加进料流量一样,提高进样浓度可提高SMB的处理量,C组是不同进料浓度的实验结果。进料浓度增加,提取液出口DHA-EE的纯度略有上升,提余液出口EPA-EE的纯度急剧下降;DHA-EE的回收率不断下降,EPA-EE回收率基本不变。随着进料浓度的增加,分离效果显著变差,这表明EPA-EE和DHA-EE在PS/DVB聚合物上存在较强的非线性吸附效应。因此在同样的操作条件下,只改变进样浓度,对分离的结果影响很大,但是相应的固定相生产率增大,溶剂消耗减小。因此进料浓度改变后需相应调整SMB的参数才能保证较佳的分离效果。
3 结论
用PS/DVB聚合物分析色谱柱实现了EPA-EE和DHA-EE的完全分离。通过在分析柱上的优化实验,确定以粒径20 μm的PS/DVB聚合物为SMB分离的填料,以甲醇为洗脱剂,操作温度40 ℃。SMB实验能够成功制备较高纯度的EPA-EE和DHA-EE单体,通过改变Ⅱ区和Ⅲ区的流量、进样流速、进样质量浓度,得到了较佳的分离效果。SMB分离EPA-EE和DHA-EE具有较大开发潜力。

