白藜芦醇对PC-3细胞上皮间质转化及Hedgehog信号通路的影响
李建平,刘 莹,翟晓强,南 宁,王 莉,王振龙,李和程,种 铁
(西安交通大学第二附属医院泌尿外科,陕西西安 710004)
前列腺癌是全球范围内常见的男性泌尿系统恶性肿瘤,据统计2015年在美国约有23万新发前列腺癌患者,死亡病例约3万例[1]。近几年我国前列腺癌发病率显著升高,已成为发病率最高的泌尿系统恶性肿瘤[2]。手术治疗联合内分泌治疗和放疗可以明显改善患者预后,但在治疗一段时间后,绝大部分患者会发生远处转移,肿瘤侵袭转移是前列腺癌患者死亡最主要的原因。研究表明,上皮间质转化(epithelial-mesenchymal transition,EMT)是促进前列腺癌等恶性肿瘤侵袭转移的主要机制。肿瘤细胞发生EMT后,其上皮样特性缺失而表达间质细胞表型,从而获得迁移和侵袭能力[3-4]。因此,探究抑制EMT的机制对于改善前列腺癌患者预后,提高患者生存率具有重要意义。
白藜芦醇是一种天然多酚类化合物,具有一定的抗炎、抗氧化及抗肿瘤作用。有研究表明,白藜芦醇在肺癌、胰腺癌和乳腺癌中可以通过抑制上皮间质转化过程发挥抗肿瘤作用[5-7]。我们前期在前列腺癌细胞中发现,白藜芦醇可抑制前列腺癌细胞的上皮间质转化过程,同时初步提示Hedgehog信号通路在白藜芦醇调控EMT过程中可能发挥重要作用,但其作用机制尚未真正明确[8]。因此,本研究在前列腺癌细胞PC-3中,以Hedgehog信号通路抑制剂环巴明为阳性对照,观察白藜芦醇对细胞增殖、侵袭转移、EMT过程和Hedgehog信号通路的影响,为白藜芦醇对前列腺癌作用机制的深入研究和临床应用提供依据。
1 材料与方法
1.1材料PC-3细胞购自ATCC,白藜芦醇和环巴明购自Sigma公司,达尔伯克改良伊戈尔培养基 (dulbecco’s modified eagle medium,DEME)购自Gibco公司、MTT[3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,汉语化学名:3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐]购自Sigma公司,Transwell小室购自Corning公司,Gli-1、SMO、E-caderin、N-caderin和Vimentin抗体购自Santa Cruz公司,反转录聚合酶链式反应(reverse transcription polymerase chain reaction,RT-PCR)引物由生工生物工程有限公司合成, Trizol试剂购自Invitrogen 公司,反转录试剂盒购自TaKaRa公司。
1.2实验方法
1.2.1细胞培养及实验分组 将PC-3细胞接种于DMEM培养基(含10%胎牛血清)中。将含细胞的培养基置于37 ℃、5% CO2孵箱中贴壁培养。实验时取对数生长期细胞。实验分为3组:分别为空白对照组(仅含培养基)、白藜芦醇组(0~50 μmol/L)、环巴明组(0~50 μmol/L)。
1.2.2细胞增殖抑制实验 取对数生长期消化并计数,以5×103个/mL接种在96孔板,贴壁培养过夜后吸出培养液。白藜芦醇组分别加入200 μL不同浓度白藜芦醇(0、5、10、20、30、50 μmol/L)、环巴明组(cyclopamine)分别加入不同浓度环巴明(0、5、10、20、30、50 μmol/L)、空白组细胞仅加入相应培养基,分别培养 24、48和72 h。药物干预完成后,弃去培养基,加入20 μL 5 mg/mL MTT继续培养4 h,最后加入150 μL DMSO处理,用酶标仪在490 nm时测定细胞吸光度值(A),计算抑制率。计算公式:抑制率=(1-药物干预组A/对照组A)×100%。每组实验重复3次。
1.2.3划痕实验 用胰蛋白酶消化细胞成单细胞悬液,按 5×105个/mL的接种于6孔板。于37 ℃、5%CO2孵箱中贴壁培养24 h。用干净的10 μL无菌枪头的尖端分别在6孔版的各组细胞上划痕。PBS清洗细胞3次,去除划下的细胞。实验组分别加入10 μmol/L白藜芦醇培养液(白藜芦醇组)和10 μmol/L环巴明培养液(环巴明组),对照组仅加入等量培养液。各组细胞在37℃、5% CO2孵箱中贴壁培养,分别在开始时及48 h时取出6孔板在倒置显微镜下观察细胞迁移情况并拍照。
1.2.4Transwell 侵袭实验 Transwell上室聚碳酸脂膜上铺入50 μL稀释的Matrigel胶,将小室放入37 ℃的培养箱中孵育4 h使Matrigel胶凝固。用无血清培养基稀释对数生长期细胞(5×105个/mL)和药物。取100 μL细胞悬液和100 μL药液加入Transwell上室,分为3组,即对照组、10 μmol/L白藜芦醇组、10 μmol/L环巴明组。下室加入500 μL(含10%胎牛血清)培养基。37 ℃培养48 h,取出Transwell小室,PBS清洗3次,使用甲醇固定细胞15 min,0.1%结晶紫染色液染色15 min,PBS清洗后,用干净棉签擦去上室中未侵袭细胞,显微镜下(放大倍数为200倍)观察并采集图像,计数10个视野中的细胞,反映细胞的侵袭能力。
1.2.5RT-PCR 检测Hedgehog信号通路相关基因(Gli-1、SMO)和EMT标记基因(E-cadherin和Vimentin)mRNA表达情况,10 μmol/L白藜芦醇和10 μmol/L环巴明分别处理各实验组细胞48 h,胰蛋白酶消化后收集细胞,使用Trizol法提取总RNA,按照PrimeScript RT reagent Kit with gDNA Eraser试剂盒操作要求对提取的RNA进行反转录。分别应用表1中的引物进行RT-PCR反应,β-actin为内参基因。反应条件为95 ℃变性30 s、60 ℃退火30 s、72 ℃延伸45 s。PCR产物在1.2%琼脂糖凝胶电泳,凝胶成像系统下观察电泳结果,并进行灰度值分析。
1.2.6Western blotting 实验 分别向培养48 h的对照组和药物处理组细胞加入1 mL细胞裂解液提取总蛋白。分别取50 μg样品蛋白/孔上样至10%SDS-聚丙烯酰胺凝胶,电泳分离蛋白并转移到NC膜上,用5%脱脂牛奶封闭2 h,然后分别加入相应的一抗(1∶1 000)4 ℃平摇过夜,TBST洗涤3次,辣根过氧化物酶标记二抗(1∶2 000)避光孵育2 h,TBST洗涤3次后用显色液显色,定影,扫描条带并进行凝胶成像分析,以目的条带与β-actin条带吸光度的比值作为目的蛋白的相对表达量。
表1RT-PCR检测引物序列

基因名称引物序列上游下游E-cadherin5'-CGCATTGCCACATACA-3'5'-CGTTAGCCTCGTTCTCA-3'Vimentin5'-CGCTTCGCCAACTACAT-3'5'-AGGGCATCCACTTCACAG-3'Gli-15'- AGCGTGAGCCTGAATCTGTG-3'5'- CAGCATGTACTGGGCTTTGAA-3'SMO5'-TCGAATCGCTACCCTGCTG-3'5'-CAAGCCTCATGGTGCCATCT -3'β-actin5'-ATCGTGCGTGACATTAAGGAGAAG-3'5'-AGGAAGGAAGGCTGGAAGAGTG-3'

2 结 果
2.1白藜芦醇和环巴明对前列腺癌细胞增殖抑制作用MTT法分别检测白藜芦醇和环巴明对前列腺癌PC-3细胞增殖的抑制作用。结果如图1所示,随着白藜芦醇和环巴明浓度的增加和作用时间的延长,增殖抑制率越大。根据MTT实验结果,分别选择10 μmol/L白藜芦醇和10 μmol/L环巴明作为进一步的实验药物浓度。

图1环巴明和白藜芦醇抑制PC-3细胞增殖
2.2白藜芦醇和环巴明对前列腺癌细胞迁移能力的抑制作用在开始时和48 h时间点分别测量3组划痕间的宽度,结果显示对照组划痕愈合率为(93.4±4.0)%。环巴明组划痕愈合率为(75.2±6.4)%。白藜芦醇组划痕愈合率为(69.1±8.4)%。白藜芦醇组和环巴明组划痕宽度大于对照组,有统计学差异(P=0.009,图2),表明白藜芦醇组和环巴明组愈合速度慢于对照组。
2.3白藜芦醇和环巴明抑制前列腺癌细胞的侵袭能力应用10 μmol/L的白藜芦醇和10 μmol/L环巴明分别处理PC-3 细胞48 h,Transwell法检测细胞侵袭能力。结果如图3显示,与对照组相比,经白藜芦醇处理的PC-3细胞的侵袭数均低于对照组。经环巴明处理的PC-3细胞侵袭数低于对照组(P=0.001)。提示抑制Hedgehog信号通路可抑制前列腺癌PC-3细胞的侵袭能力。

图2 环巴明和白藜芦醇抑制PC-3 细胞迁移
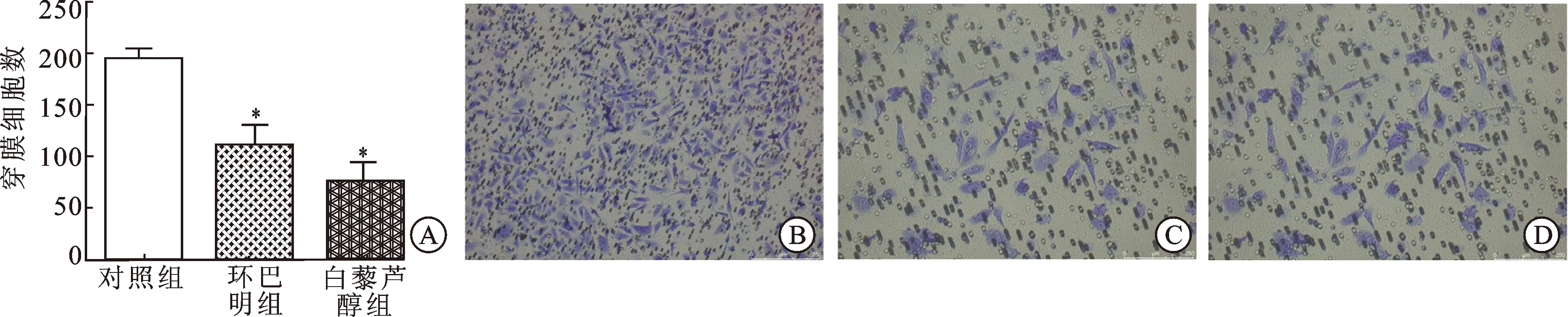
图3 白藜芦醇和环巴明抑制前列腺癌细胞侵袭能力
2.4白藜芦醇和环巴明影响PC-3细胞Gli-1、SMO和EMT标记物(E-cadherin和Vimentin)mRNA的表达环巴明组Hedgehog通路关键蛋白Gli-1和SMO mRNA表达水平均低于对照组,差异具有统计学意义(P=0.011,P=0.002)。环巴明组EMT上皮型标记物E-cadherin mRNA表达显著高于对照组(P=0.025),而间质性标记物Vimentin mRNA表达水平显著低于对照组,差异具有统计学意义(P=0.000)。白藜芦醇组Gil-1和SMO mRNA表达水平均低于对照组,差异具有统计学意义(P=0.004,P=0.001)。白藜芦醇组EMT上皮型标记物E-cadherin mRNA表达显著高于对照组(P=0.002),而间质性标记物Vimentin mRNA表达水平显著低于对照组,差异均具有统计学意义(P=0.000)。白藜芦醇组SMO和Gil-1表达高于环巴明组,表明白藜芦醇对Hedgehog通路抑制作用强于环巴明,但两者无统计差异。白藜芦醇组E-caderin mRNA表达水平高于环巴明组(P=0.015)。Vimentin mRNA表达在白藜芦醇组中低于环巴明组(P=0.091)。
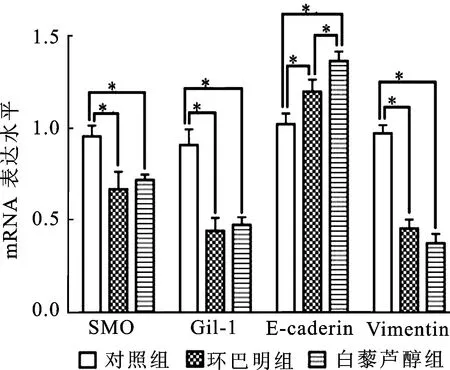
图4 白藜芦醇和环巴明影响Gli-1、SMO和
2.5白藜芦醇和环巴明对PC-3细胞中Gli-1、SMO和EMT标记物(E-cadherin和Vimentin)蛋白表达的影响环巴明组Hedgehog通路关键蛋白Gil-1和SMO 蛋白表达水平均低于对照组。环巴明组EMT上皮型标记物E-cadherin 蛋白表达高于对照组,而间质性标记物Vimentin 蛋白表达水平低于对照组(图5A)。白藜芦醇组Hedgehog通路关键蛋白Gil-1和SMO 蛋白表达水平均低于对照组。白藜芦醇组EMT上皮型标记物E-cadherin 蛋白表达高于对照组,而间质性标记物Vimentin 蛋白表达水平低于对照组(图5B)。

图5 白藜芦醇和环巴明影响PC-3细胞Gli-1、SMO和EMT标记物蛋白表达
3 讨 论
白藜芦醇是从葡萄、花生等植物中提取的一种多酚类化合物。多项研究表明,白藜芦醇可通过抑制细胞增殖,促进凋亡,抑制肿瘤细胞侵袭转移等发挥抗肿瘤作用。因此,对于白藜芦醇抗肿瘤作用的分子机制的进一步阐明,可为白藜芦醇的临床应用奠定坚实基础。本研究首先使用MTT法检测白藜芦醇对前列腺癌细胞PC-3的增殖作用。研究发现,白藜芦醇可以呈时间——剂量依赖性地抑制PC-3细胞增殖。白藜芦醇浓度越大,作用时间越长,对PC-3细胞增殖抑制作用越强。这些结果提示白藜芦醇可能对前列腺癌具有一定的治疗价值。
侵袭转移是前列腺癌患者死亡的主要原因,约90%的前列腺癌患者因发生骨转移而死亡[9]。近年来研究发现, EMT是肿瘤细胞获得侵袭转移能力的重要机制。EMT过程伴随着肿瘤细胞E-cadherin等上皮型标志物表达下调,Vimentin等间质性标记物表达上调,促进上皮表型细胞转变为间质表型细胞,获得较强的迁移侵袭能力[10-11]。本研究采用划痕实验和Transwell侵袭实验,发现白藜芦醇可以抑制PC-3细胞的迁移和侵袭能力。为进一步验证白藜芦醇是否通过抑制EMT过程发挥抗迁移和侵袭能力,采用RT-PCR和Western blotting法分别检测E-cadherin和Vimentin mRNA和蛋白表达,结果提示,经白藜芦醇处理的细胞中,间质性标记物Vimentin均表达下调,提示白藜芦醇可能通过抑制EMT过程发挥抗肿瘤细胞迁移和侵袭作用。
EMT过程的发生受多因素多基因调控作用,Hedgehog信号通路都可能调控EMT过程[12-15]。本研究进一步采用Hedgehog信号通路抑制剂环巴明作为阳性对照,检测白藜芦醇处理前后细胞的Hedgehog信号通路关键因子Gil-1和SMO mRNA和蛋白表达,结果表明,Hedgehog信号通路在白藜芦醇调控前列腺癌细胞EMT过程中发挥着关键作用。
综上所述,白藜芦醇可通过抑制Hedgehog信号通路从而抑制前列腺癌转移,这将为白藜芦醇在前列腺癌治疗中的应用提供新的依据。

