肾癌转移关键基因的Top250基因集富集分析
徐 珊,张海宝, 种 岳,田娟华,穆丽君,贺大林,杜岳峰
(1.西安交通大学第一附属医院泌尿外科,陕西西安 710061;2.西安交通大学环境和疾病相关基因教育部重点实验室,陕西西安 710061)
肾细胞癌(renal cell carcinoma,RCC)是泌尿系常见肿瘤,占成人恶性肿瘤的3%,其中以透明细胞型RCC 为主,约占 85%~90%,发病率和死亡率逐年增加[1-3]。早期 RCC 的治疗以外科手术切除为主,尤其是近年来以腹腔镜为代表的微创手术在我国广泛开展,为早期 RCC 患者带来了希望。但遗憾的是,术后仍有30%患者很快出现肿瘤复发或远处转移,还有一部分患者在首次就诊时肿瘤已发生远处转移[1-3]。目前,以酪氨酸激酶抑制剂(舒尼替尼、索拉非尼)和mTOR抑制剂(替西罗莫司、依维莫司)等为代表的小分子靶向药物是转移性肾癌(metastatic RCC,mRCC)的一线药物,但是mRCC对临床放、化疗以及免疫治疗高度耐受,临床预后很差,约50%患者的生存期<1年,且5年生存率只有10%[4-5]。虽然大多数研究证明希佩尔-林道蛋白(von hippel-lindau,VHL)-低氧诱导因子(hypoxia-inducible factors,HIFs)信号通路激活是肾癌发生发展以致转移的主要原因[6-8],但是YOUNG等[9]对比研究了177名肾癌患者,发现VHL突变以及缺失与患者预后并无关系,所以针对VHL-HIFs信号通路之外的机制研究,寻求肾癌治疗的新靶点,开创肾癌治疗的新策略,仍是必要阐明的机制研究。
传统“一种疾病一个基因”的研究模式不能从多层次多基因协同模式下了解疾病的发生和发展,高通量测序和基因表达芯片技术相结合可获得疾病基因组中所有基因的表达水平[10-11]。研究者利用高通量数据,采用基因功能富集分析,可全面而系统的阐明疾病发生或发展过程中起关键作用的信号通路,从而可揭示疾病的基本分子机制[11-12]。本研究从基因表达综合数据库(gene expression omnibus,GEO)下载mRCC基因表达谱(GSE47352),该研究共收集5名未转移RCC患者和4名mRCC患者,提取患者肿瘤组织获取基因表达谱,利用现代生物学信息分析工具,对未转移RCC患者和mRCC患者进行差异表达基因富集分析,以期了解肾癌发生转移的分子机制以及关键的生物学信号通路,为肾癌治疗寻找新靶点。
1 材料与方法
1.1基因芯片数据肾癌转移芯片数据GSE47352从GEO数据库官方网站下载,基因芯片数据处理见文献[13]。
1.2方法
1.2.1基因芯片数据提取 使用GEO数据库官方网站GEO2R在线分析软件,RCC患者分为两组,非转移组(5位)和转移组(4位),提取非转移组和转移组显著表达差异的前250位基因(Top250)信息,包括:基因符号基因名(Gene.symbol)、基因标题(Gene.title)、P值(P.Value)、调整后P值(adj.P.Val)和差异倍数(logFC)等,同时删去不确定的基因检测结果。
1.2.2基因功能富集分析 使用Omicsbean(http:∥www.omicsbean.com:88∥)数据分析系统对GSE47352 Top250基因进行基因本体(gene ontology,GO)富集(生物过程、细胞组成、分子功能),京都基因与基因组百科全书(kyoto encyclopedia of genes and genomes,KEGG)富集以及蛋白质-蛋白质互作用(protein-protein interaction,PPI)模型构建,该软件由金弗康生物科技(上海)有限公司开发研制和维护。
1.2.3Venn分析肾癌转移关键基因 结合作者信号传递网络(signal-net)分析、差异基因P值、差异基因变化幅度以及介数中心性(betweenness centrality)筛选得出的肾癌转移的6位关键基因,与Top250基因结合分析,筛选出肾癌转移的核心基因。
2 结 果
2.1分子功能富集分析本研究应用GO分子功能富集分析对未转移RCC患者和mRCC患者Top250基因进行分析。结果显示,在纳入富集分析的基因中,值得注意的是有36位基因产物参与核酸结合,其中有转录因子SOX21、内皮PAS1蛋白(endothelial PAS domain-containing protein 1,EPAS1)、人肿瘤蛋白63(tumor protein 63,TP63)、JUN以及TEAD2等重要肿瘤细胞增殖、耐药以及血管生成等信号通路调控因子,35位基因产物与细胞内阳离子结合,调控细胞生理过程,有12位基因产物参与调控RNA聚合酶Ⅱ转录因子活性(图1)。
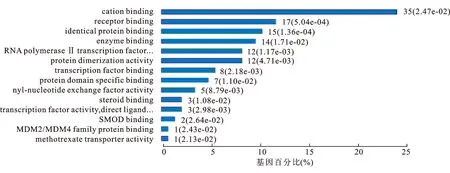
图1肾癌转移Top250基因分子功能富集分析
2.2细胞组成富集分析本研究拟通过细胞组成成份的富集分析,进一步探知在肾癌发生转移的病程进程中,细胞哪部分组成发生最显著的变化,为药物研究提供依据。Top250基因细胞组成富集分析发现,在肾癌转移疾病进程中有86位基因产物,约占细胞器相关基因的60%,参与细胞内细胞器的功能调节,如肿瘤坏死因子(tumor necrosis factor,TNF)、ADAM8和RAB25等;39位基因产物,参与细胞囊泡储存以及运输的生命活动;另外我们也发现,有9位基因产物是细胞外基质蛋白粘连蛋白α4链(laminin alpha4,LAMA4)、基质金属蛋白酶28(matrix metallo peptidase,MMP28)、带有血小板凝血酶敏感蛋白结构域的解聚素与金属蛋白酶-3(a disintegrin-like and metalloprotease domain with thrombospondin type I motifs-Like 3,ADAMTSL3)、LAMA1等。
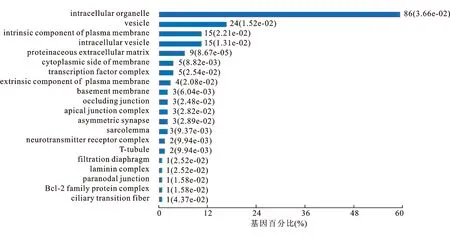
图2肾癌转移Top250基因集细胞组成富集分析
2.3生物学途径富集分析本研究Top250基因生物学途径富集分析结果发现,Top250基因中基因富集较多或者P值较小富集通路主要为细胞生长发育、信号转导、细胞化学应激反应等,其中SOX21、TNF、白细胞介素-2(interleukin2,IL2)、EPAS1、TP63、JUN等参与多条信号通路调控(图3)。直接与肾癌侵袭转移相关的富集通路有血管形态、内皮细胞生长,细胞分化以及小管形成等信号通路。
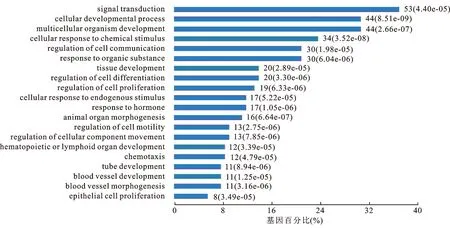
图3肾癌转移Top250基因集生物学途径富集分析
2.4KEGGpathway富集分析KEGG是一个整合了生物基因组以及生物系统的生物学信息数据库,联合基因芯片技术能够找出疾病发生过程中起决定性的信号通路,为疾病研究方向提供指引。本研究通过分析转移和未转移肾癌患者的差异表达基因,利用KEGG从更高生物层次和更复杂的肿瘤细胞行为中得到肾癌转移最为显著区别的细胞生化过程。Top250基因进行Pathway通路富集分析发现,转移组和未转移患者Top250基因主要集中在人类疾病相关通路上(图4),包括:肿瘤、肾癌、炎症、肺癌、肿瘤微小RNA(MicroRNA)等;转移患者和未转移患者丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)以及两面神激酶(janus kinase,JAK)信号转导子和转录激活子(signal transducer and activator of transcription,STAT)信号通路变化显著;Top250基因富集结果也显示转移患者和未转移患者在细胞粘附生物学行为发生显著变化。
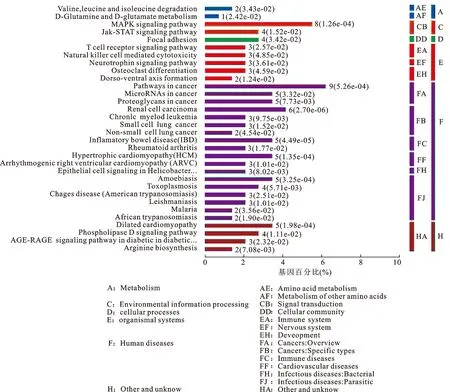
图4肾癌转移Top250基因集KEGGpathway富集分析
2.5蛋白互作网络构建对Top250基因产物蛋白质进行PPI网络构建,分析网络中的hub蛋白,寻找与肾癌转移相关的关键基因。本研究PPI结果显示与肾癌转移主要相关通路是肾细胞癌通路,囊括了6种基因产物:非受体型蛋白酪氨酸磷酸酶11(protein-tyrosine phosphatase,nonreceptor-type 11,PTPN11)、内皮PAS1蛋白(endothelial PAS domain protein 1,EPAS1),又称缺氧诱导因子-2(hypoxia induced factor-2,HIF-2)、 Ras/Rho 鸟苷酸交换因子(SOS Ras/Rho guanine nucleotide exchange factor 2,SOS2)、转移生长因子β2 (transforming growth factor beta 2,TGFB2)、E26转录因子1(E26 transformation specific-1,ETSl)和JUN(图5);同时结果还显示转录因子EPAS1以及JUN在肾癌发生发展中起重要作用,JUN有可能在肾癌发展中具有至关重要的作用。
2.6肾癌转移核心基因筛选为了进一步筛选肾癌转移的关键基因,我们联合Top250基因,signal-net分析结果,转移和未转移患者差异表达基因的P值,介数中心性betweenness centrality和差异基因变化幅度5个筛选条件得出LAMA4和JUN这两个基因(图6),推断LAMA4和JUN可能是潜在的肾癌转移的核心基因。

图5肾癌转移Top250基因集KEGG信号通路分析
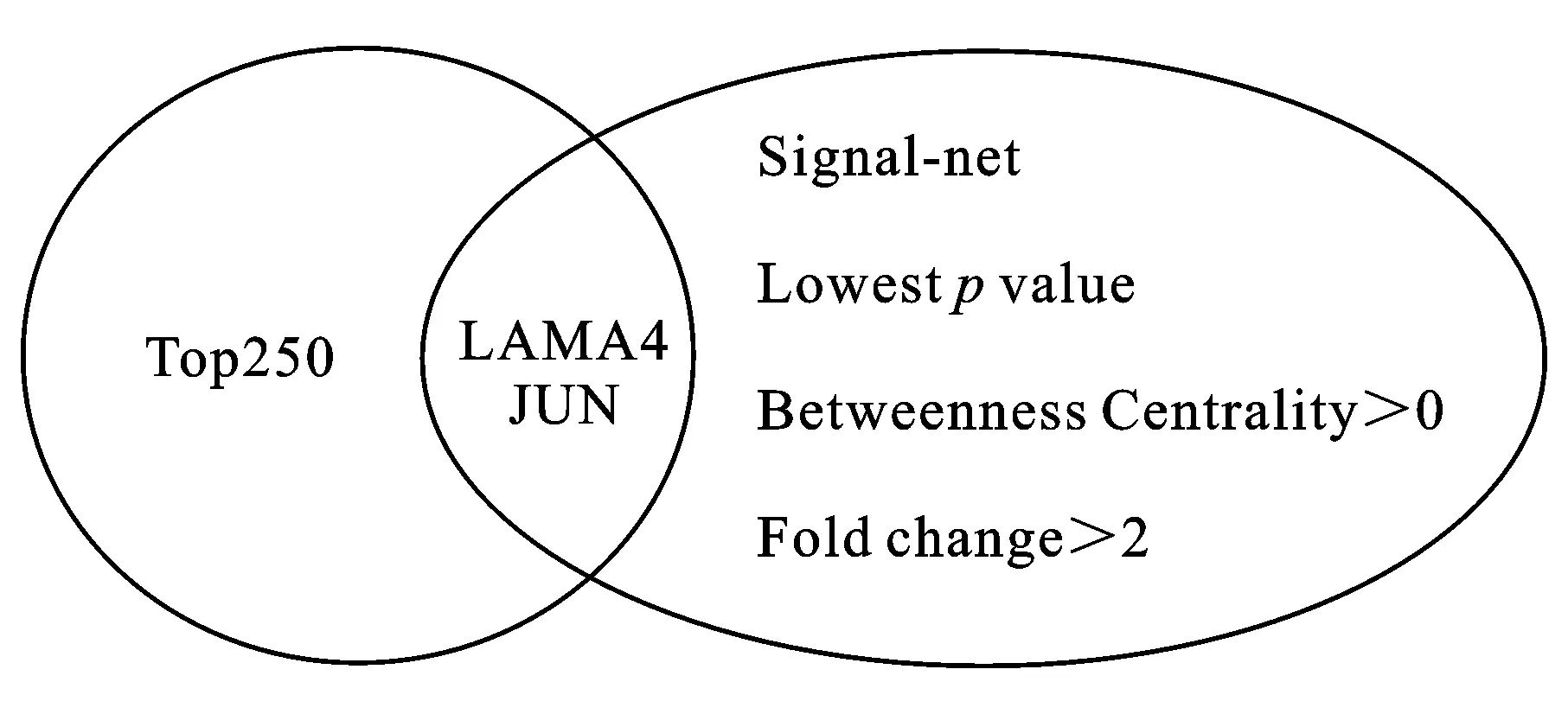
图6肾癌转移关键基因Venn图分析
3 讨 论
肾癌转移,与肾癌细胞本身恶性度有很大关系,目前关于肾癌细胞转移分子机制研究还不明晰。本研究通过软件分析,从基因丛的水平而非单基因水平探寻肾癌转移的关键基因。Top250 GO分析、KEGG pathway富集以及PPI等分析方法得出转移与未转移肾癌细胞发生的显著变化是基因表达调控、细胞生长、细胞应激、细胞粘附特性、血管生成以及细胞向外信息传递等生物学功能。
血管生成是肿瘤细胞自我生存以及转移的重要条件[14],在我们的富集分析结果中大部分Top250基因参与肾癌血管生成,分泌促内皮细胞生长因子促进内皮细胞生长以及小管形成等细胞通路上,包括促进血管生成的重要转录因子Hif 2α[6-7],该结果也和目前肾癌靶向药物设计靶点相符合。肿瘤细胞发生转移需要改变细胞外基质粘附和降解,且研究证明肿瘤细胞发生转移首先需要冲破基底膜,之后再转移到别处组织,所以肿瘤细胞外基质改变是肿瘤细胞侵袭迁移的重要改变。在我们的富集分析结果中有9个基因产物是细胞外基质蛋白,其中有MMP家族MMP28,以及LAMA家族LAMA4和LAMA1,MMP和LAMA家族都是细胞外基质的重要组成部分,与肿瘤细胞转移密切相关。近几年研究发现,外泌体是肿瘤细胞靶向转移的重要信号传递者,肿瘤细胞可通过释放外泌体抑制机体免疫、促进肿瘤细胞生长、促进内皮细胞形成血管、同时携带特异性膜蛋白,到达特定器官,形成转移转“龛”,等待肿瘤细胞形成转移灶[15-17]。在我们的研究结果中有39位基因都与细胞外囊泡以及囊泡运输有关,其中RAB25和TNF等报道在肺癌、卵巢癌以及胃癌等多种肿瘤中具有促进肿瘤细胞增殖、侵袭以及转移作用[18-20]。研究结果还揭示KEGG pathway富集分析和PPI结果显示TNF、EPAS1、TP63、JUN等基因在肾癌转移中可能具有至关重要的作用。
以上结果提示Top250中存在肾癌转移的关键调控基因,为了进一步筛选出肾癌转移的核心基因,本研究结合signal-net分析构建出的肾癌转移关键基因,差异基因的改变倍数(大于2)、P值和betweenness centrality值综合因素筛选出6个潜在的促进肾透明细胞癌转移的基因产物:LAMA4、JUN、炭疽毒素受体(anthrax toxin receptor,ATR)、叉头框蛋白O3a (forkhead box O3a,FOX03a)、 E26转录因子1(E26 transformation specific-1,ETSl)、山梨醇(Sorbin)和SH3结构域连接蛋白2 (sorbin and SH3 domain containing 2,SORBS2)[13],再与Top250结合分析,筛选得到两个基因LAMA4和JUN,提示LAMA4和JUN极有可能是肾癌转移的关键核心基因,该结果与PPI结果相互印证。
进一步,我们对LAMA4和JUN两个基因产物在Pubmed数据库上检索相关信息及其生物学功能。LAMA4是层粘连蛋白8的功能亚基,而层粘连蛋白是重要的细胞外基质,在细胞支持、连接以及维持形态方面有重要作用,并且影响细胞粘附、生长、迁移以及信号传递等功能[21]。有研究者报道LAMA4可以调控MMPs家族,影响细胞基底膜,影响细胞侵袭迁移能力[22]。虽然目前关于LAMA4在肿瘤转移中的作用研究较少,从整个基因组水平客观分析结果提示我们LAMA4有可能在肾癌的转移过程中发挥重要作用,后续我们会进一步验证其在肾癌转移中的生物学功能。JUN在基因名片网(Gene card)显示又名c-Jun,是细胞内转录激活蛋白-1(activator protein-1,AP-1)二聚体的亚基[23]。AP-1是细胞应激应答(辐射、生长、压力等)的一个重要因子,AP-1可调节基因的表达以应对细胞因子、生长因子、细菌和病毒感染以及压力等,从而控制细胞的分化、增殖以及凋亡等,在多种肿瘤中均有报道,在肿瘤细胞转移过程中发挥着重要作用[23-24],JUN有可能是肾癌转移的重要转录因子。
本研究通过比对肾癌转移患者和未转移患者肿瘤组织Top250基因,运用多种生物信息学分析方法,结合筛查因素筛选得出JUN和LAMA4在肾癌转移中具有重要的作用。在今后的研究中,笔者将在组织样本中检测LAMA4和JUN的表达,阐明和肾癌患者预后以及生存率的关系,以及在肾癌转移中的生物学功能,为肾癌临床治疗提供依据。

