改良经会阴单切口新途径人工尿道括约肌植入术(附5例报道)
张 帆,廖利民
(中国康复研究中心北京博爱医院泌尿外科,首都医科大学泌尿外科学系,北京 100068)
人工尿道括约肌(artificial urinary sphincter,AUS)植入术适用于各种尿道括约肌功能缺失(intrinsic sphincter deficiency,ISD)导致的压力性尿失禁。目前,AUS手术开放植入多选择两种手术入路,即传统经会阴及腹股沟双切口及经阴囊单切口方式[1-3]。对于既往多次手术史、下尿路情况比较复杂的患者,在植入AUS套件之前需根据个体情况设计方案,AUS植入的手术入路应考虑局部皮肤情况及既往手术途径,以使得患者手术区域条件符合AUS植入标准,提高手术成功率[3-5]。本文报道我中心5例改良经会阴单切口新术式AUS植入治疗尿失禁患者资料,探索该新方法的安全、有效性及优缺点。
1 资料与方法
1.1临床资料本组5例,均为男性,平均年龄(47.2±24.5)岁。患者病程9个月至6年,均存在严重尿失禁症状。其中尿道损伤后尿失禁3例(骨盆骨折尿道断裂患者2例,骑跨伤导致尿道断裂1例),前列腺癌根治术后尿失禁患者2例。术前3例患者选择穿纸尿裤,2例患者选择佩戴阴茎套。术前所有患者行膀胱镜检查下尿路情况,行影像尿动力检查明确患者术前膀胱容量及顺应性正常。尿道损伤后尿失禁患者中2例为原始装置机械故障取出同期行新装置植入手术。患者分别为第一次人工尿道括约肌植入后6个月和4.5年尿失禁复发,膀胱镜下证实无尿道侵蚀,经盆腔计算机断层扫描(computerized tomography scan,CT)检查明确储水囊尺寸缩小,且无局部感染征象,故考虑装置渗漏(表1)。
表15例患者基本情况

患者序号年龄(岁)病因一期植入方式一期并发症二期植入方式*VAS(术前)VAS(术后)172PPI经会阴单切口--81.5276PPI经会阴单切口--93330PFUI经会阴单切口--7.52428PFUI经阴囊单切口储水囊渗漏,RI经会阴单切口93530PFUI经阴囊单切口袖套渗漏,RI经会阴单切口82
*常规行膀胱镜检查明确无尿道侵蚀,盆腔CT明确原有括约肌装置渗漏,且无局部感染情况可选择同期取出故障AUS装置后植入新装置。PPI:前列腺术后尿失禁;PFUI:骨盆骨折尿道外伤;RI:尿失禁复发;VAS:视觉模拟症状严重程度评分。
1.2手术方法AUS装置为AMS800型(美国波科公司产品)。手术选择阴囊下会阴部横行切口约3~4 cm,逐层分离皮下组织至球海绵体肌,纵行切口球海绵体肌,暴露尿道海绵体,游离球部尿道约2 cm(如需取出原有AUS装置,可向尿道远端游离尿道海绵体及袖套,逐步取出AUS 3个部件)。①袖套植入:依据术中测量球部尿道周径选择袖套(5例均为4.5 cm),将袖套环套包绕该部尿道。②储水囊植入(两种方式):第一种方式是经腹股沟高位肌间隙植入(4例):以尿道袖套包绕部为起点向右上方分离组织抵达腹股沟管外环口,经外环进入腹股沟管内,逐层分离至腹股沟内环,将储水囊(61~70 cmH2O)置入内环附近的腹内斜肌与腹横肌间隙。第二种方式是传统骨盆内膀胱外间隙植入(1例):经会阴切口向右上方分离组织抵达腹股沟管外环口,经外环向下分离膀胱外盆腔间隙并植入储水囊。③控制泵植入:从会阴切口向上分离右侧阴囊肉膜下间隙,将控制泵底部向上放入其中。将储水囊内充盈24 mL生理盐水后将各部件以连接管道及接头连接,挤压控制泵显示AUS系统工作正常,逐层闭合切口(图1)。术后控制泵制动于失活状态,术后2 d拔除尿管,第4~6周激活控制泵,观察控尿状态,指导患者正确使用AUS装置。
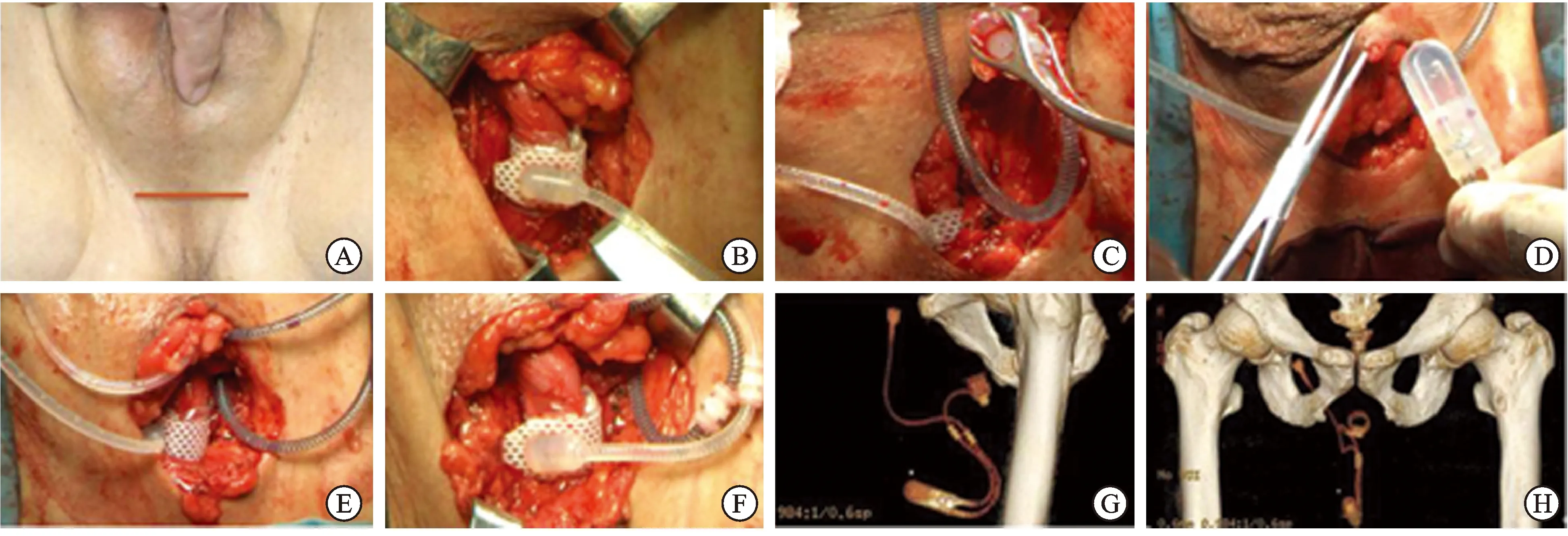
图1经会阴单切口改良人工尿道括约肌植入手术步骤
A:会阴横切口5 cm;B:常规分离尿道球部植入袖套;C:储水囊经腹股沟管置入腹股沟管内环;D:控制泵植入阴囊肉膜下间隙;E:调整连接管道;F:三件套在会阴切口内连接;G:盆腔CT重建(侧位)显示AUS植入后三件套的相对位置;H:盆腔CT重建(正位)显示AUS装置同骨盆的位置关系。
1.3术后评估患者术后定期接受问卷调查。问卷内容包括患者每日尿垫使用量、发生漏尿次数、并发症情况及处理,服用药物及患者满意度等。患者术后1个月、6个月进行常规随访。评价患者24 h尿垫使用量及对尿失禁处理满意度使用视觉模拟症状严重程度评分(visual analogue score,VAS)10分量表,0分表示完全不影响生活,10分表示尿失禁症状很糟。
1.4统计学方法应用SPSS 11.5软件。手术前后尿动力学参数比较采用t检验,患者下尿路处理情况评分表比较采用方差分析。P<0.05为差异有统计学意义。
2 结 果
5例患者中术后1个月均成功激活装置并正常使用。截止最近一次随访,植入患者均能达到社交控尿水平(每日尿垫使用<2片),其中4例患者可达到完全干燥、1例患者使用1片尿垫。总体手术成功率达到100%。尿失禁影响生活质量评分改善平均超过6分[术前(8.3±0.6) 分,术后(2.3±0.7)分,P<0.001]。
3 讨 论
AUS植入术为治疗前列腺术后尿失禁(Post-prostatectomy incontinence,PPI)等尿道括约肌源性压力性尿失禁的金标准,因此,AUS的使用群体多为成年男性患者[1-2]。传统的AUS植入的的入路为经会阴及腹股沟双切口方式。经会阴切口将袖套植入尿道球部,经腹股沟切口将储水囊植入盆腔膀胱周围间隙,将控制泵植入阴囊肉膜下后再将三件套连接。这种植入方式便于将三件套安置在最合适的位置,延长其使用寿命、并发挥最大功效。
随着AUS适应证的拓宽,一些特殊患者群体加入,包括各种原因导致尿道外伤后尿失禁患者、神经源性尿失禁患者、先天发育异常导致尿失禁及女性压力性尿失禁患者等。AUS植入也出现了各种改良入路方式,主要包括开放方式及腹腔镜植入方式[6-9]。其中开放植入方式在经典的两切口的基础上出现了经阴囊单切口方式植入三件套,其优点为减少了一个手术切口、降低了感染发生率、缩短手术时间及住院时间[10]。如患者同时存在尿失禁及男性勃起功能障碍,可经阴囊切口同期植入阴茎假体装置。然而有研究表明,经阴囊单切口植入术式后完全干燥率较传统两切口植入低(27.4%vs.44.1%)[11];并且经阴囊单切口游离的球部尿道比较靠前端,尿道海绵体较经会阴游离者薄,因此是否容易发生尿道萎缩和侵蚀尚需长期随访。
APPELL等[7]报道女性AUS植入方式为经阴道及腹部两切口,这种方式为效仿传统男性手术入路。经阴道将袖套植入膀胱颈周围,经腹部植入储水囊,将控制泵植入大阴唇后将三件套连接。经耻骨后植入方式主要目的是将袖套植入膀胱颈周围,其主要患者群体为各种女性压力性尿失禁手术失败患者。腹腔镜植入方式受众群体为女性患者,其优点为美观,微创且新通道可避免之前手术入路形成的陈旧瘢痕[8-9]。有报道膀胱扩大术联合单件袖套球部尿道植入治疗小儿神经源性尿失禁,其优势为可根据年龄增长更换合适的袖套,并保留后期如病情需要植入AUS其他两件套的可能[12]。另外,有经阴茎海绵体白膜单件替换袖套修复尿道侵蚀的报道,这种手术方式有以下优点:在尿道背面将袖套放入阴茎海绵体白膜内,可以增加尿道周围组织体积,降低侵蚀的危险。但修复术后发生勃起功能障碍发生率较高[13-14]。
近年来有研究报道,经会阴单切口联合植入AMS800和/或AMS700,一次手术达到控尿及治疗勃起功能障碍的目的[15]。我们体会到改良经会阴单切口植入AUS有以下优点:①会阴切口远离尿道外口及阴囊皮肤皱褶,可降低因术后漏尿及围手术期皮肤消毒不彻底导致感染发生风险;②如患者既往有经阴囊尿道手术史或骨盆骨折修复手术史,会阴切口可避开上述切口,降低分离陈旧瘢痕结缔组织手术难度,避免延迟愈合或不愈合发生;③会阴切口皮下脂肪组织丰富,可增加对连接套件的衬垫保护,可提高患者植入后舒适程度及减少皮肤侵蚀;④经腹股沟放置储水囊于腹股沟管内环口下方,可降低储水囊一期放置的难度,也可降低发生并发症后二期取出及更换袖套的难度[16]。值得指出的是,该方法储水囊放置相对原有更接近腹壁,术后发生储水囊移位及损坏的风险加大。患者经腹部可触感储水囊的存在,这样一方面可方便检查装置是否渗漏,然而另一方面也需要告知患者注意保护该区域,避免外力损伤储水囊。
AUS的预期使用时间为7~10年,植入术后5年内约20%患者因各种并发症需要二次手术更换装置[17,19]。植入术后的并发症分为机械性和非机械性。机械故障原因包括装置渗漏、系统内气泡或有机碎片引起泵功能障碍、导管扭曲梗阻等。非机械性并发症中,最常见为尿道萎缩、尿道及皮肤侵蚀、感染。文献报道机械故障发生率7.6%~21%。其中袖套是系统最脆弱的部分,故障多发生于植入后2~3年;其次为控制泵功能障碍[20]。我中心前期报道30例AUS术后机械故障发生率仅为1例(3.3%),为储水囊破裂[4]。本组2例患者为前期AUS机械故障患者的二次植入,故障原因为液体渗漏,1例为初次植入后4年半发生的袖套渗漏、1例为初次植入后半年发生的储水囊渗漏。本组中2例二期植入患者,一期植入根据尿道损伤修复术后局部皮肤条件均选择经阴囊单切口途径,二期术中取出旧装置、同期更换全套新装置。二期手术选择经会阴单切口途径,既可避免一期手术入路下瘢痕,又可以更加充分暴露原有袖套近段球部尿道位置,增加二期植入后控尿效果。有研究报道一期括约肌植入后3年内发生单件机械故障,可单独更换故障套件,如已经使用3年以上建议整套更换[20]。本研究中2例术后尿失禁复发患者,术中证实均为装置渗漏,单件渗漏后套件整体无法稳定液压传导,袖套无法对尿道保持足够的压力。由于装置漏液内部已同外界相连通,套件内处于暴露易感染状态,故选择取出后同期更换全部套件。
总之,改良经会阴单切口新术式植入AUS装置较传统双切口术式更加微创、美观;该术式较经阴囊单切口术式降低了感染风险,为AUS植入及二期修复提供了新的手术入路选择。改良术式的效果仍需病例数累积及长期随访进一步验证。

