华南地区猪圆环病毒3型分子流行病学研究
蒋智勇,蔡汝健,楚品品,林德锐 ,勾红潮,李 艳,宋 帅,李春玲
(1.广东省农业科学院动物卫生研究所/ 广东省畜禽疫病防治研究重点实验室/广东省兽医公共卫生公共实验室/农业部兽用药物与诊断技术广东科学观测实验站,广东 广州 510640;2. 广东永顺生物制药股份有限公司,广东 广州 511356)
猪圆环病毒(Porcine circovirus,PCV)属于圆环病毒科(Circoviridae)圆环病毒属(Circovirus),为无囊膜的单股环状DNA(ssDNA)病毒,基因组约2 kb,是最小的自主复制病毒基因组。现已知PCV有PCV1和PCV2 2个血清型[1],其中PCV1不具有致病性,而PCV2能引起断奶仔猪多系统衰竭综合征、猪皮炎肾病综合征、猪增生性坏死性肺炎及其他猪圆环病毒相关疾病[2-3]。
2016年美国学者从猪群中检测到一种能引起母猪皮炎肾病综合征与繁殖障碍的PCV3,该病毒从出现病症的母猪或仔猪中分离得到,同时PCV2检测为阴性[4-5]。基因组序列分析发现,PCV3基因组包含2 000 bp,具有与PCV1和PCV2相似的基因组结构,主要编码Cap和Rep两个基因[5]。随后在我国辽宁、福建、河北、江西、重庆、广东、广西和山东等地也有发现PCV3 感染[6-8]。
为更好地了解和监控PCV3在华南地区的流行、遗传进化以及毒株的变异情况,本研究应用荧光定量PCR技术对华南地区猪场送检的临床样品进行PCV3检测,并对阳性样品进行全基因组扩增和测序,以了解PCV3的分子流行病学状况,为PCV3的免疫预防和分子致病机制研究等提供理论依据。
1 材料与方法
1.1 试验材料
病料采自2017年华南地区(广东、海南、广西和湖南)26个猪场,共采集样品246份,包括淋巴结、脾脏、肺脏、血清、精液以及流产胎儿等。
主 要 试 剂:PremixExTaqTM和DL 2000 Marker为大连宝生物工程有限公司产品(TaKaRa),病毒DNA/RNA提取试剂盒为Magen公司产品,Taq PreMix聚合酶为Promega公司产品。
1.2 试验方法
1.2.1 引物设计与合成 参照Palinski等[5]合成1对引物用于PCV3的荧光定量PCR检测,并设计2对引物用于PCV3全基因组扩增(表1)。引物所在位置参照PCV3株(GenBank收录号:KY075988.1),引物和探针由上海生工生物工程有限公司合成。
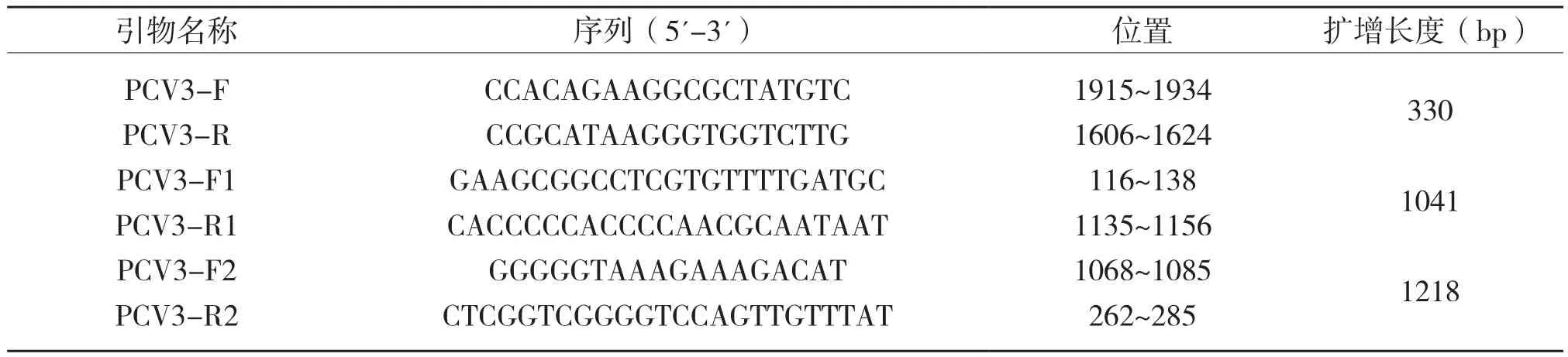
表1 PCV3引物和探针序列
1.2.2 PCV3荧光定量PCR检测 病毒DNA的提取按照病毒DNA/RNA 提取试剂盒操作说明书进行,提取的DNA用于荧光定量PCR扩增。扩增方法参照Palinski等[5]进行临床样品的PCV3检测并统计结果。
1.2.3 PCV3全基因组序列测定与分析 PCV3全基因组扩增反应体系(50μL) :去离子水21μL,上、下游引物各1μL(工作浓度0.2μmol/L),2×PremixEx Taq25μL, 提取的DNA模板2μL。扩增反应条件:95℃预变性5 min;95℃变性20 s、60℃退火30 s、72℃延伸 90 s,共 35个循环;72℃后延伸5 min。PCR产物用1%琼脂糖凝胶电泳检测,对符合预期大小的PCR产物送上海生工生物工程有限公司测序。
1.2.4 全基因序列的拼接及系统进化树分析将测序获得的2 段序列进行拼接后得到PCV3的全基因序列,应用生物学分析软件DNAStar、ClustalX 2.1和Mega 6.0对PCV3全基因组及ORF2基因序列以及推导的氨基酸序列与国内外PCV3参考毒株序列进行比对并绘制遗传进化树。
2 结果与分析
2.1 PCV3临床样品的检测
应用荧光定量PCR方法对26个猪场临床送检的组织、精液和血清共246份样品进行检测,结果26个猪场中有19个猪场为PCV3阳性场,猪场阳性率为69.2%(18/26),PCV3样品总检出阳性率为46.3%(114/246)。
2.2 PCV3的PCR检测及全基因组扩增
经荧光定量PCR检测为阳性的病料和血清进行全基因组扩增,引物PCV3-F1/PCV3-R1经PCR扩增后获得大小为1.1 kp的片段,引物PCV3-F2/PCV3-R2扩增的PCR产物片段约1.2 kb(图1),与预期大小相符。将PCR产物送到上海生工生物工程有限公司进行测序并拼接,用于遗传信息分析。
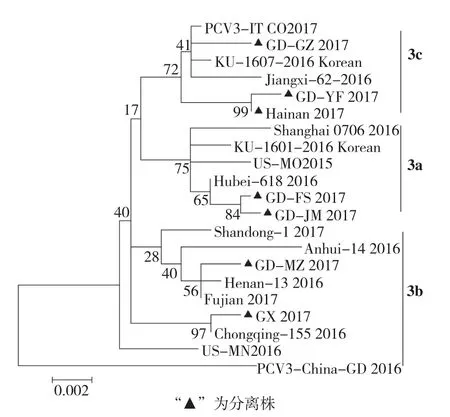
图2 基于PCV3全基因序列的遗传进化树
2.3 PCV3全基因组的遗传进化分析
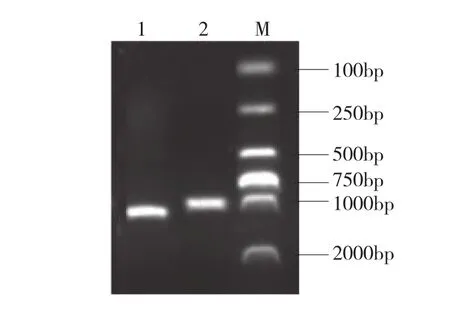
图1 PCV3全基因组PCR产物电泳结果
将扩增测序的毒株序列拼接后提交GenBank,获得7株PCV3,分别命名为GDFS、GD-GZ、GD-JM、GD-MZ、GD-YF、GX 2017和Hainan株,GenBank收录号分别为MG253678~MG253684。对分离的 7株 PCV3毒株与来自美国(US-MO2015、US-MN2016)、意大利(PCV3-IT CO2017)[9]、韩国(KU-1601,KU-1607)[10]和国内的 9株 PCV3毒株序列应用DNAstar的MegAline软件进行核苷酸同源性比较分析并构建了遗传进化树(图2)。结果表明,分离测序的7株PCV3毒株之间的核苷酸序列同源性为98.9%~99.8%,PCV3分离株与PCV3国内外参考毒株的核苷酸同源性在97.4%~99.8%之间。PCV3可分为PCV3a、PCV3b和PCV3c 3个亚群,在华南地区分离的7株PCV3分别有2株、2株和3株分别位于PCV3a、PCV3b和PCV3c亚群,表明PCV3在华南地区呈现出遗传多样性。
2.4 PCV3 ORF2基因的遗传进化分析
PCV3 ORF2基因长645 bp,编码214 aa,PCV3 ORF2基因比PCV2的ORF2基因短。本研究分离测序的7株PCV3毒株之间的核酸序列同源性为98.1%~99.5%,而与PCV3国内外参考毒株的核苷酸同源性在96.6%~99.8%之间。
分离的7株PCV3 ORF2基因推导的氨基酸序列与参考毒株同源性在96.7%~99.5%之间。ORF2基因编码的Cap蛋白序列出现了4处比较一致的突变,分别为V24A、K27R、T77S和L150I。基于 PCV3 ORF2基因构建的遗传进化树(图3)与PCV3全基因组构建的遗传进化树(图2)存在部分差异,结果同样表明这些毒株可以大致分为3个分支(PCV3a、PCV3b和PCV3c)。GD-GZ与参考毒株Jiangxi-62-2016、KU-1607-2016和 PCV3-IT CO2017具有V24A和K27R突变属于PCV3c,GD-MZ与参考毒株Anhui-14-2016、PCV3 Fujian和Henan-13-2016株具有T77S和L150I突变属于PCV3b,GD-YF和Hainan株同时具有PCV3c的V24A和PCV3b的T77S突变暂归为PCV3c,GD-JM具有1处L150I突变,不具有这4处突变的GX 2017和GD-FS株与其余的参考毒株属于PCV3a(图4)。
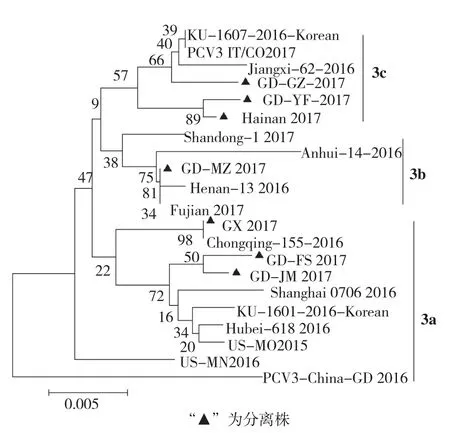
图3 基于PCV3 ORF2基因序列的遗传进化树
3 结论与讨论
自2016年以来,我国部分省(市)相继出现以母猪流产和死亡、断奶仔猪呼吸衰竭和死亡为临床特征的PCV3感染报道[8,11],也有研究表明PCV3可引起仔猪腹泻[12]。目前尚不清楚PCV3的起源,追溯性研究表明PCV3于2015年即存在于我国猪场,此后呈现上升趋势[13]。
目前国内外先后建立了PCR、荧光定量PCR、ELISA以及鉴别诊断PCV2与PCV3的双重荧光定量PCR方法[14-18]。本研究应用荧光定量PCR方法对临床样品进行PCV3检测,结果PCV3总检出率为46.3%(114/246),猪场阳性率为69.2%(18/26)。PCV3可以在不同的猪组织如脑、肺、脾脏、淋巴结、扁桃体、心脏、肾以及精液和血清中均可检出,其中以肺和淋巴结检出率最高,研究结果表明PCV3在华南地区已广泛存在。
将PCV3荧光PCR检测为阳性的样品进行全基因组扩增与测序分析,共获得7株PCV3全基因组序列,PCV3全基因组长为2 000 bp,ORF2基因长为645 bp。本研究分离的7株PCV3与国内外的参考毒株的全基因组核苷酸同源性在97.4 %~99.8%之间,ORF2基因的同源性在96.6%~99.8%之间。基于ORF2基因构建的遗传进化树可以将PCV3分为PCV3a、PCV3b和 PCV3c亚 型, 与 Fu等[13]以 PCV3 Cap蛋白的V24A、K27R突变将PCV3分为3个亚型结果一致。 本研究进一步结合另外2个突变T77S和L150I作为分型依据。中国分离株与美国、欧洲和韩国分离株具有很高的同源性,也说明PCV3毒株的基因组比较稳定。本研究对PCV3的分子流行病学研究为开展PCV3的监测与防控提供了技术支持,PCV3的致病性与PCV2的关系等有待进一步研究。

图4 PCV3分离株Cap蛋白推导的氨基酸序列比对分析

