高胆红素血症及胆红素脑病新生大鼠模型的建立与评价
,,,
新生儿黄疸或高胆红素血症是一组由于胆红素代谢异常在体内积聚引起的可见皮肤或其他器官黄染,是新生儿期最常见的临床问题,其发病率高达60%~85%[1],并可致胆红素脑病,但胆红素脑病的神经系统损害早期是可逆的。目前有效的预测方法是根据健康新生儿的小时胆红素列线图及个体化随访计划结合头颅核磁来判断[2]。然而胆红素神经毒性的作用机制及环节尚不清楚,因此,建立合适的动物模型,对有效降低严重高胆红素血症的风险,避免胆红素脑病的发生及评估胆红素脑病是至关重要的。本研究根据7 d龄新生SD大鼠,利用超微结构下观察发现其脑组织发育不完善[3],血脑屏障的重要组成成分脑血管内皮细胞[4]及星形胶质细胞容易受到胆红素的破坏等特点,腹腔注射不同剂量的胆红素,并进行相关指标测定和评价,建立稳定的动物模型。
1 材料与方法
1.1 实验动物 选择7 d龄清洁级Sprague-Dawley(SD)大鼠30只,体重11 g~17 g,雌雄不限,由山西医科大学动物实验中心提供。
1.2 药品及试剂 晶体胆红素(美国Sigma公司),总胆红素(南京建成生物工程研究所),S-100 β试剂盒(武汉贝茵莱生物科技公司),神经细胞凋亡率试剂盒(罗氏公司)。
1.3 主要仪器 电子天平,多功能全波长酶标仪(Thermo),石蜡包埋机(EG1150Hfc),轮转切片机(RM225),显微照相(OLYMPU BH-2)。
1.4 实验方法
1.4.1 胆红素的配制 避光称取晶体胆红素20 mg,溶于0.1 mL 0.5 mol/L氢氧化钠溶液中,并加入双蒸水0.9 mL,用0.5 mol/L盐酸滴定调至pH8.5,浓度为20 mg/mL,于1 h内使用。
1.4.2 胆红素脑病动物模型的建立 随机将30只7 d龄SD大鼠分为5组:腹腔注射生理盐水组(T0组)、腹腔注射50 mg/kg胆红素组(T1组)、腹腔注射100 mg/kg胆红素组(T2组)、腹腔注射150 mg/kg胆红素组(T3组)、腹腔注射200 mg/kg胆红素组(T4组),室温环境母鼠哺育。
1.4.3 测定指标
1.4.3.1 实验大鼠的一般状况 包括精神情况、皮肤颜色、对外界刺激的反应及体重。
1.4.3.2 血清总胆红素及S-100β浓度 造模24 h后,麻醉并心脏取血0.5 mL~1.0 mL,按说明书用化学氧化酶标法测胆红素,酶联免疫吸附法(ELISA)测S-100 β。
1.4.3.3 脑组织胆红素及S-100β浓度 造模24 h后,麻醉并灌洗,取脑组织,左侧脑组织于冰醋酸中制成10%匀浆,以等体积丙酮抽提,测定方法同血清测定法。
1.4.3.4 脑组织HE染色 右侧脑组织保存于4%多聚甲醛,室温固定24 h,包埋切片,染色,光镜下观察脑组织形态。
1.4.3.5 原位末端标记(TUNEL)法测神经细胞凋亡率 选取5个视野计细胞总数及阳性细胞数,计算凋亡率。

2 结 果
2.1 各组大鼠一般情况分析 实验前,各组大鼠皮肤颜色红润,行为表现未见异常。造模24 h后,T0组皮肤红润,活动正常;T1组皮肤欠红润,活动稍迟缓;T2组及T3组皮肤黄染,皮肤弹性较差,活动次数减少,对外界刺激反应迟钝,伴翻滚及俯伏;T4组皮肤黄绿色,皮肤弹性差,对外界刺激无反应甚至昏迷,体重出现负增长。
2.2 各组大鼠血清及脑组织总胆红素及S-100 β水平比较(见表1) T1组T2组血清S-100 β水平比较,差异无统计学意义(P>0.05)。

表1 各组大鼠血清、脑组织总胆红素及S-100 β水平比较(±s)
2.3 脑组织病理变化 T0组海马区神经细胞排列整齐,神经元结构完整,形态正常;T1组可见神经元细胞有较轻的肿胀、变形;T2组和T3组神经元结构紊乱,数量较少,细胞肿胀、变形明显,部分细胞核染色质致密浓缩,胞浆空化,可见胶质细胞;T4组可见细胞坏死,神经元数量少。详见图1。
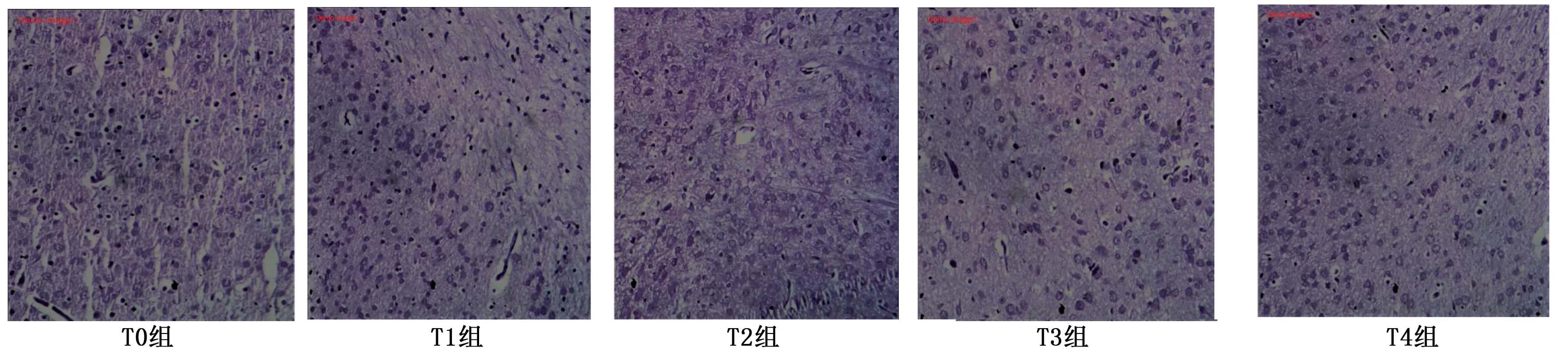
图1 各组HE染色脑组织病理变化
2.4 各组神经细胞凋亡率 随着胆红素浓度的增加,神经细胞凋亡率渐增。详见图2。T0组少见细胞凋亡,其他各组神经细胞凋亡率与T0组比较,差异均有统计学意义(P<0.05);T3组神经细胞凋亡率与T4组比较,差异无统计学意义(P>0.05)。详见表2。

图2 各组神经细胞凋亡阳性表达(×400)

表2 各组神经细胞凋亡率(±s)%
3 讨 论
高胆红素血症是新生儿期最常见的临床病症之一,主要由于胆红素的产生及消除不平衡所致。Hachiya等[5]认为胆红素通过DNA氧化损伤影响胆红素脑病急性期壳核及苍白球,增加中脑、脑桥和延髓,尤其是纹状体和海马区血管密度,增加血管内皮生长因子及受体-2、白蛋白外渗入脑实质,同时诱导基底节、中枢和外周听觉及视觉通路、海马、间脑、MIC核、中脑、小脑和小脑蚓部的神经元损伤及胶质细胞增生[6],但胆红素脑病神经损伤机制尚不清楚,无有效的治疗药物,仍有较高死亡率。为有效的治疗和预防胆红素脑病,需建立简便可行、成功率高且具有良好模拟性的动物模型。
目前国内外存在多种高胆红素的动物模型。①基因突变(缺陷)模型。纯合子Gunn大鼠,编码葡萄糖醛酸转移酶的基因缺陷使游离胆红素不能转化为结合胆红素,但胆红素的浓度达不到胆红素脑病的程度且基因突变存在潜在的影响[7]。②胆红素经静脉或延髓注入。有研究显示脑干中可见胆红素结晶,但胆红素在体内存留时间短,不能模拟持续损害的过程且操作性差[8-9]。③皮下或腹腔注射盐酸苯肼,通过溶血建立模型,但化学药物同时损伤红细胞及免疫系统[10]。
以腹腔注射胆红素增加胆红素来源,肠肝循环结合血浆白蛋白联结胆红素能力不足及肝细胞处理能力差的特点,模拟新生儿黄疸发生条件。本研究结果显示:随着大鼠血清和脑组织中胆红素浓度的升高,大鼠的一般情况变差,表现为皮肤黄染加重,弹性变差,活动次数减少,对外界刺激反应变差,体重增长幅度变小。此结果与李水冰等[11]的研究结果相符合。T3组与T4组血清及脑组织S-100 β水平比较,差异均无统计学意义,与Silva等[12]的研究结果一致。S-100 β是EF手型的钙离子结合蛋白之一,是星形胶质细胞增生标志物。在细胞内,低生理量的S-100 β 3.5倍增加,刺激细胞增殖、迁移,抑制细胞分化和凋亡,参与大脑、软骨和骨骼肌的发育和修复;然而,神经炎症及脱髓鞘损伤后,S-100β释放增加,通过细胞外调节蛋白激酶(ERK)通路氧化应激,激活核转录因子-κB(NF-κB)(呈剂量依赖性)增加近端启动子的转录活性和增强内源性晚期糖基化终产物受体(RAGE)表达,暴露星形胶质细胞Toll样受体2(TLR2)、一氧化氮合酶(NOS)和白介素-1β(IL-1β),从而加重组织损伤[13-16]。非结合胆红素(UCB)诱导星型胶质细胞白介素1(IL-1)、肿瘤坏死因子(TNF)等炎症因子表达,降低少突胶质细胞祖细胞(OPC)的生存分化及髓鞘形成[17-18]。目前多数研究认为神经系统后遗症与星形胶质细胞的活化有关[19],不能单独应用血清胆红素峰值来预测患儿预后(神经性耳聋、智商、语言发育等),这与不同神经细胞对胆红素的敏感程度不一有关。本实验结果显示:T3组与T4组神经细胞凋亡率比较差异无统计学意义,推测凋亡是胆红素诱发细胞早期损伤的重要方式,而后期的神经改变则以突触的神经元缺失及坏死为主。
本实验中7 d龄大鼠腹腔注射50 mg/kg、100 mg/kg、150 mg/kg和200 mg/kg胆红素均可成功建立高胆红素血症模型,结合大鼠一般情况、血清及脑组织S-100 β含量、神经细胞凋亡率及脑组织HE染色等,进一步认为大鼠腹腔注射100 mg/kg和150 mg/kg胆红素可复制出稳定胆红素脑病的模型,腹腔注射150 mg/kg胆红素更适合胶质细胞损伤研究。采用腹腔注射胆红素的方法造模,重复性好,简单易行且经济,进而治疗高胆红素血症,预防胆红素脑损伤,抑制神经细胞凋亡,减少神经细胞损伤。

