高流量鼻导管湿化氧疗联合人免疫球蛋白治疗新生儿感染性肺炎的疗效及安全性分析
房冰
(哈尔滨医科大学附属第一医院,黑龙江 哈尔滨 150001)
新生儿感染性肺炎(neonatal infectious pneumonia,NIP)是新生儿期常见的感染性疾病,患病率约占新生儿呼吸系统疾病的30%。NIP可发生在宫内、分娩过程或出生后,主要由细菌、病毒、霉菌等病原体致病,产后NIP患儿临床表现为发热、体温上升、气促、三凹征象等症状。重症肺炎可出现严重缺氧、呼吸衰竭等严重并发症,若治疗不及时可导致死亡。围生期NIP患儿死亡率约5%~20%,占新生儿死因的10%~20%[1]。改善新生儿NIP的氧供系统是临床救治的关键环节,其中高流量鼻导管湿化氧疗(high flow nasal cannulae oxygen therapy,HFNC)是一种新型无创通气技术,目前广泛用于呼吸窘迫、慢性肺疾病、毛细支气管炎等治疗,均取得较好效果[2]。NIP发病和患儿免疫系统发育不良紧密相关[3],免疫学干预如静脉注射人免疫球蛋白(IVIG)有助于改善机体抗感染能力,对缓解NIP症状体征具有积极作用,但也存在免疫抑制的可能,安全性有待严谨评估。为优化临床治疗方案,本研究对100例NIP患儿分组治疗,旨在探讨HFNC联合IVIG的疗效与安全性,现报告如下。
1 资料和方法
1.1 一般资料
研究对象为哈尔滨医科大学附属第一医院2015年3月至2018年3月收治的100例NIP患儿。纳入标准:严格按照《诸福棠实用儿科学》(第8版)[4]中NIP相关标准确诊。排除标准:(1)患有心、肝、肾等器质性病变;(2)对相关治疗不耐受者;(3)机体条件较差,如出现重度窒息、多器官功能衰竭等。NIP患儿随机数表法分为对照组和观察组,每组各50例。对照组中,男性31例,女性19例;年龄4~28 d,平均(16.7±5.1)d;出生体重2.5~3.4 kg,平均(3.1±0.3)kg;阴道分娩22例,剖宫产28例。观察组中,男性29例,女性21例;年龄3~29 d,平均(16.5±4.9)d;出生体重2.4~3.4 kg,平均(3.0±0.4)kg;阴道分娩21例,剖宫产29例。两组NIP患儿性别、年龄、体重及分娩方式比较,差异均无统计学意义(P>0.05)。
1.2 方法
两组NIP患儿均给予保温、化痰、抗菌、限制液量、纠正水电解质紊乱等对症治疗。对照组给予HFNC通气治疗,相关参数:吸入氧浓度30%~40%,呼吸末正压5~7 cm H2O,流量6~8 L/min。观察组在对照组基础上联合IVIG静脉注射治疗,注射剂量200~400 mg·kg-1·d-1,初始输注速度0.01~0.02 mL·kg-1·min-1,30 min后无异常可加速至0.03~0.04 mg·kg-1·min-1,输注时间2~4 h/次,1次/d,连续3 d。治疗期间密切观察NIP患儿症状体征情况,若出现不良反应及时对症处理。
1.3 观察指标
分别于治疗前后检测血氧分压(PaO2)、二氧化碳分压(PaCO2) 及相关免疫学指标IgG及亚类IgG1、IgG2、IgG3、IgG4表达;治疗7 d后结合症状体征改善情况和影像检查判定疗效。显效:咳嗽、发绀、呼吸困难、气促等症状消失,体征恢复正常且保持稳定,X线检查未见胸部阴影;有效:NIP症状体征有显著改善,影像检查显示胸部阴影基本消失;无效:未达到显效有效标准,NIP症状体征无明显改善甚至继续加重,X线检查可见胸部阴影。治疗总有效率=(显效+有效)/总数×100%;统计两组不良反应发生情况,评估治疗安全性。
1.4 统计学分析
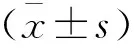
2 结果
2.1 两组患儿治疗前后血PaO2、PaCO2比较
两组患儿治疗前PaO2、PaCO2比较,差异无统计学意义(P>0.05),治疗后PaO2均提高,PaCO2均下降,差异均具有统计学意义(P<0.05);观察组治疗后PaO2、PaCO2较对照组均有改善,但差异无统计学意义(P>0.05)。见表1。
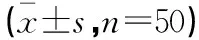
表1 两组患儿治疗前后血PaO2、PaCO2指标比较
*P<0.05,与本组治疗前比较。
2.2 两组患儿治疗前后IgG及亚类指标比较
两组治疗后IgG及亚类IgG1、IgG2、IgG3、IgG4较治疗前均有显著升高(P<0.05);观察组治疗后IgG、IgG2、IgG4表达高于对照组,差异均具有统计学意义(P<0.05)。见表2。
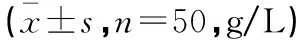
表2 两组患儿治疗前后IgG及亚类比较
*P<0.05,与本组治疗前比较;#P<0.05,与对照组治疗后比较。
2.3 两组患儿疗效比较
观察组治疗总有效率高于对照组,差异具有统计学意义(P<0.05)。见表3。
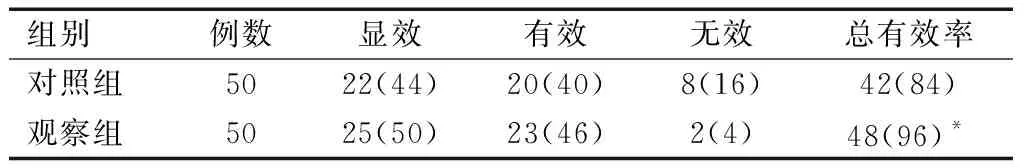
表3 两组患儿疗效比较[n(%)]
*P<0.05(χ2=4.000),与对照组比较。
2.4 两组患儿治疗不良反应比较
两组患儿治疗整体较为平稳,出现少量轻度不良反应症状。其中,对照组有2例鼻损伤,3例有胃肠道反应,不良反应率10.00%(5/50);观察组出现1例鼻损伤和2例恶心呕吐者,不良反应率6.00%(3/50)。两组不良反应发生率比较,差异无统计学意义(χ2=0.544,P>0.05)。
3 讨论
NIP的高发原因多和新生儿呼吸系统结构发育欠充分、自身免疫调节功能低下等有关。由于NIP早期症状缺乏特异性,病情进展快,容易进展为重症肺炎和引起相关严重并发症。一项某地区2006~2015年住院新生儿病因及死亡分析报告[5]显示NIP是新生儿死亡的主要原因,因此及时诊疗NIP意义重大。祛痰、抗感染是治疗NIP的常规手段,加上无创通气技术(如HFNC)的发展和辅助应用,取得积极治疗效果,已成为临床施治的经典方案[6]。但报道[7]指出NIP发病后,病原体感染能启动患儿自身免疫系统,但自身免疫对抗机制尚不健全,抗原抗体结合过程中可能造成自身免疫损伤,进一步降低免疫功能。基础抗菌抗感染和HFNC辅助治疗虽然较好控制病情,但远期疗效可能并不令人满意,因此临床治疗NIP采取必要的免疫学干预显得尤为重要。
本研究两组患儿均接受基础治疗和HFNC通气辅助治疗,结果显示:两组患儿治疗后PaO2均提高,PaCO2均下降,但两组间比较,差异并无统计学意义(P>0.05)。HFNC通气不仅具有同传统正压通气治疗相同的增加氧浓度作用,而且能纠正NIP患儿体内的缺氧状态,改善血气分析指标,对毛细支气管炎、呼吸窘迫及慢性肺疾病等应用效果较好[8]。有报道[9]指出HFNC能对通气气体进行加温、加湿,减少NIP患儿呼吸道黏膜热量和水分散失,对呼吸道通畅和减轻发绀、气促、三凹征等效果显著。观察组联合IVIG静脉注射治疗取得满意效果,治疗后血清IgG、IgG2、IgG4均显著高于对照组(P<0.05),和文献报道[10]相吻合。IgG是新生儿体液免疫的重要成分,但新生儿阶段免疫系统无法合成IgG,血清IgG低水平导致新生儿感染各类病原体的机率增加[11]。IVIG提取于健康人血清或血浆中的免疫球蛋白,由人体淋巴B细胞合成,其中IgG含量≥90%,富含人体血液中多种抗体,具有识别、清除抗原和调节免疫反应的生物学功能[12]。有报道[13]指出IVIG富含多种特异性抗体,能和NIP病原体(细菌、病毒等)产生中和作用,提高血清IgG及其亚类的含量表达,对增强机体免疫调节功能和抗感染能力显著,对缩短NIP新生儿发热、肺部湿啰音、呼吸困难等症状持续时间也十分有利。观察组治疗总有效率(96%)显著高于对照组(84%),也充分说明了HFNC通气联合IVIG静注治疗的显著优势。两组治疗不良反应率比较无显著差异(P>0.05),仅出现少量鼻损伤、胃肠道反应等轻微症状,说明联合IVIG静注治疗并不增加不良反应发生率,安全性值得肯定。
本研究不足点体现在:(1)研究样本量偏少;(2)NIP具有易复发的特点,缺乏对远期疗效的随访评估;(3)IVIG的最佳剂量有待优化,比如:根据NIP患儿不同个体情况制定个性化的IVIG剂量方案。以上不足将在后续研究中不断完善。
总之,HFNC联合IVIG治疗NIP效果显著,且不良反应少,可作为临床优化治疗NIP的参考方案。

