结核分枝杆菌感染对BALB/c小鼠B细胞发育分化的影响
刘文文,吕 艳,王 聪,赵 微,王 涛,白 丽,2
由结核分枝杆菌(Mycobacterium tuberculosis,Mtb)引起的结核病(tuberculo-sis,TB)是全世界范围内高发、危害大的呼吸道传染病,位居单一病原引起死亡的严重传染病之首[1-2].从骨髓的造血干细胞(或胎肝)到能够分泌免疫球蛋白的浆细胞,B细胞经历了复杂的发育分化过程,不同的发育分化阶段呈现出特征性的表面分子[3-4],虽然目前国外对B细胞分化发育研究较多,但TB感染时,对B细胞分化发育的各个阶段的影响尚不清楚,且B细胞在结核感染中的作用也不清楚.本研究分析了Mtb感染小鼠B细胞发育分化情况,并试图了解B细胞分化发育对抗结核感染的作用.
1 材料与方法
1 材 料
1.1.1 实验动物 SPF(Specific pathogen free)级BALB/c小鼠,许可证编号SCXK京2006-0009(已通过大理大学动物伦理委员会批准),5~6周龄,体重(18±2)g,雌性,购于北京维通利华实验动物技术有限公司.
1.1.2 菌株 Mtb临床分离株分离自大理肺结核病人,经鉴定为大理地区流行的优势菌株(由吴利先教授提供).
1.1.3 主要仪器及分析软件 FACS Calibur流式细胞仪(美国BD公司),分析软件使用CellQuest software(美国BD公司).CO2培养箱(MCO-18AIC,日本SANYO).
1.1.4 荧光抗体及其他试剂 全部抗小鼠荧光抗体购自BD公司:CD43-APC(Cat:560663)、CD45RPE(Cat:553090)、IgD-FITC(Cat:553439)、Ig MPerCP-Cy5.5(Cat:550881)、CD69-FITC(Cat:561929)、CD27-APC(Cat:560691).新鲜配制的Gey’s液(0.15 mol/L NH4Cl、1 mmol/L KHCO3和0.1 mmol/LNa2EDTA)、PK-30L 血 液 稀 释 液(Cat:G1906,sysmex公司).
1.2 方 法
1.2.1 动物感染模型的建立 将BALB/c小鼠24只随机分为2组,感染组每只小鼠从尾静脉注射Mtb临床分离株106CFU/0.2 m L、对照组0.2 m L生理盐水(NS).感染后4周和8周取小鼠的肺、肾及肝组织,经罗氏培养基培养均有Mtb生长,提示成功建立了Mtb鼠感染模型.
1.2.2 小鼠细胞获取与处理 于感染4周及8周后分别处死小鼠,获取下列细胞:
1.2.2.1 骨髓细胞 取小鼠股骨和胫骨,剥离肌肉,用5 m L注射器吸取含3%FBS-血细胞稀释液冲洗骨髓细胞于无菌离心管中,洗涤并调细胞浓度至107/m L备用.
1.2.2.2 脾细胞 取小鼠脾脏用孔径为70μm 的细胞滤器(Cell Strainer,BD Falcon)研磨并滤过细胞以除去包膜及结缔组织制成单细胞悬液,用Gey’s液溶解红细胞,经3%FBS-血细胞稀释液洗涤并调细胞浓度至107/m L备用.
1.2.2.3 脾细胞培养 获取小鼠脾细胞,除去红细胞后被用含10%FBS-RPMI-1640(GIBCO)培养液(含L-谷氨酰胺、100 U/m L青霉素、100μg/m L链霉素)培养在12-孔 “U”形底培养板上,培养的细胞浓度为106/m L,按0.1 IU/106/m L加入结核纯蛋白衍生物(TB-Purified protein derivative,TB-PPD,北京祥瑞生物制品有限公司),37℃、5%CO2培养24 h,收集细胞染色,设不加TB-PPD作对照.
1.2.3 染色及流式细胞仪分析 取骨髓细胞106,用 CD45R-PE/Ig M-Per CP-Cy5.5/CD43-APC/IgDFITC染色;取脾细胞或刺激培养的脾细胞106,用CD45R-PE/Ig M-Per CP-Cy5.5/IgD-FITC、CD45RPE/CD69-FITC、CD45R-PE/CD27-APC/IgD-FITC染色.染色按BD公司推荐在细胞中加入上述适量荧光抗体,4℃避光反应30 min,3%FBS-血细胞稀释液洗涤2次,末次离心后加入400μL 3%FBS-血细胞稀释液,样品经FACSCalibor收集适量细胞,然后用Cell Quest software分析,对于所有样品的分析均需首先通过FSC(Forward light scatter)和SSC(Side light scatter)分析去除死细胞和细胞碎片,只分析活细胞.
1.2.4 数据统计 采用SPSS22.0统计软件建立数据库,对实验结果以x±s表示,组间比较采用两组独立样本的t检验,P<0.05有统计学意义.
2 结 果
2.1 Mtb感染促进了骨髓B细胞的分化发育 骨髓B细胞的分析参照文献[4-6]进行,骨髓细胞经CD45R-PE/Ig M-PerCP-Cy5.5/CD43-APC/IgDFITC染色.经SSC和FSC分析,“gate”淋巴细胞群分析骨髓总B细胞、祖B细胞(pro-B)、前B细胞(pre-B),然后“gate”CD45R+B细胞进行未成熟B细胞(immature B cell)和成熟B细胞(mature B cell)分析.感染4周时,Mtb感染小鼠与NS对照小鼠比较,骨髓总B细胞(CD45R+)(t=3.429,P<0.05)、pro-B细胞(CD45R+CD43+)(t=2.886,P<0.05)、pro-B+pre-B 细胞(CD45R+Ig M-)(t=5.939,P<0.05)及未成熟B细胞(CD45R+Ig M+IgD-)(t=4.760,P<0.05)降低,成熟 B 细胞(CD45R+Ig M+/-IgD+)增加(t=-3.485,P<0.05),该细胞8周时也有所增加(t=-2.594,P<0.05).与4周相比,感染8周时,pro-B+pre-B细胞(t=5.983,P<0.05)及未成熟B细胞(t=3.472,P<0.05)升高.感染不同时期,骨髓各发育阶段B细胞分布基本一致(见图1、图2),Mtb感染促进了骨髓B细胞向成熟B细胞发育.
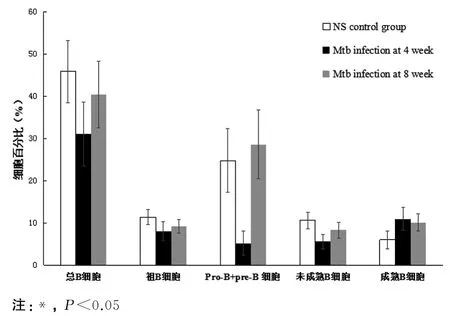
图1 Mtb感染小鼠与对照小鼠骨髓B细胞分析Fig.1 Analysis of B cells of mice infected with Mtb and uninfected in bone marrow
2.2 Mtb感染促进了脾B细胞的分化发育 脾脏B细胞的分析参照文献[5-6]进行,脾细胞经CD45R-PE/Ig M-PerCP-Cy5.5/Ig D-FITC抗体染色,经FSC、SSC分析,“gate”淋巴细胞群,分析小鼠脾B淋巴细胞亚群分布情况(见图3、图4).Mtb感染小鼠与NS对照小鼠比较,脾脏总B细胞(CD45R+)(4周:t=2.709,P<0.05;8周:t=1.945,P<0.05)及T1B细胞(transitional 1 B cell,CD45R+Ig Mhi IgDlow)(4周:t=2.238,P<0.05;8周:t=2.148,P<0.05)降低;脾脏成熟B细胞(mature B cell,CD45R+Ig Mlow IgDhi)升高4周:t=-2.27,P<0.055;8周:t=-2.97,P<0.05);感染8周与4周时比较,Mtb感染小鼠脾脏T2 B细胞(transitional 2 B cell,CD45R+Ig MhiIgDhi)(t=2.189,P<0.05)及成熟B细胞(t=-2.733,P<0.05)升高.
2.3 Mtb感染促进了B细胞的活化 Mtb感染小鼠的脾脏细胞体外培养或与TB-PPD共同培养24 h后,细胞经CD45R-PE/CD69-FITC染色,“gate”CD45R+细胞群,分析B细胞活化分子CD69的表达.感染4周及8周时,Mtb感染小鼠与NS对照小鼠比较,脾脏B细胞CD69分子的表达升高,表现为只加培养液(4周:t=-2.271,P<0.05;8周:t=-2.052,P<0.05);加 入 TB-PPD(4 周:t=-2.265,P<0.05;8周:t=-4.062,P<0.05),即Mtb感染促进了B细胞的活化,且感染4周时,B细胞已得到充分活化,表现为感染4周和8周的活化B细胞比例相似,且感染4周体外培养加入特异性抗原TB-PPD再刺激时活化B细胞比例未见明显增加.
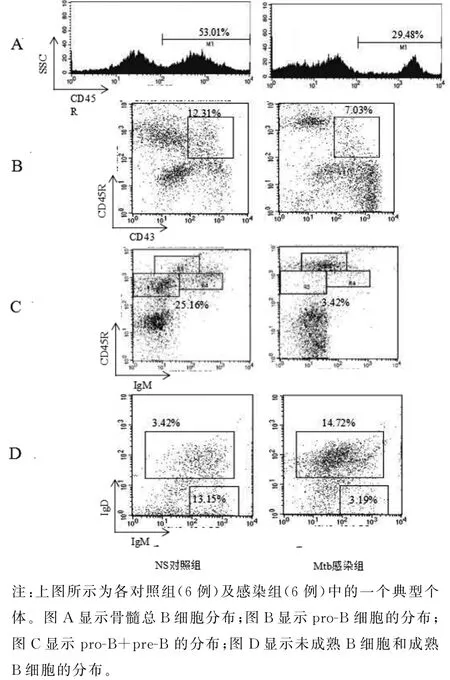
图2 感染4周时骨髓B细胞的分布图Fig.2 Distribution of B cells in bone marrow at infection 4 week
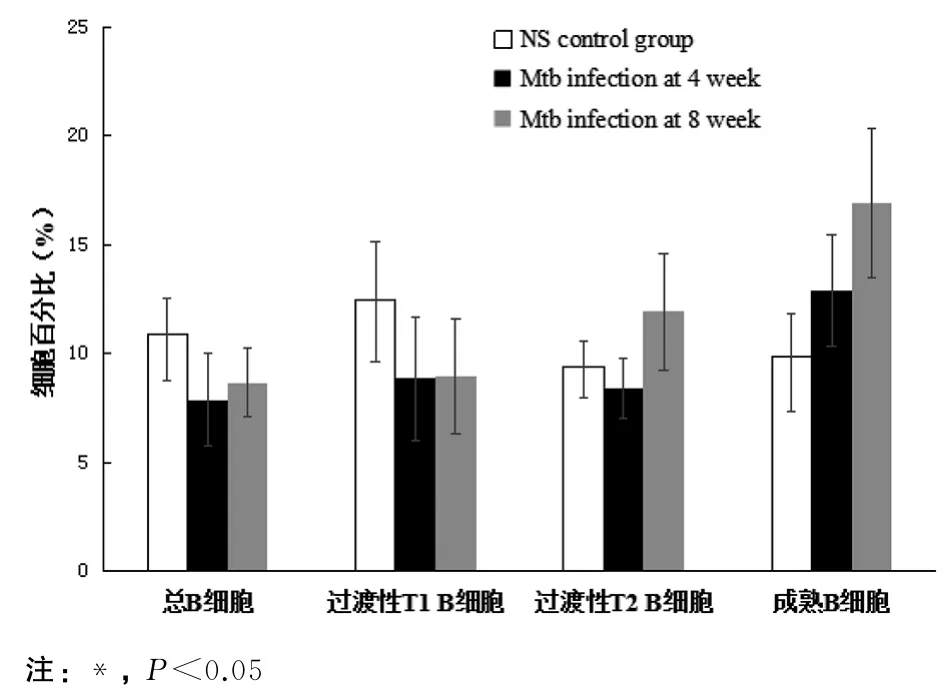
图3 Mtb感染小鼠与对照小鼠脾脏B细胞分析Fig.3 Analysis of splenic B cells of mice infected with Mtb and uninfected
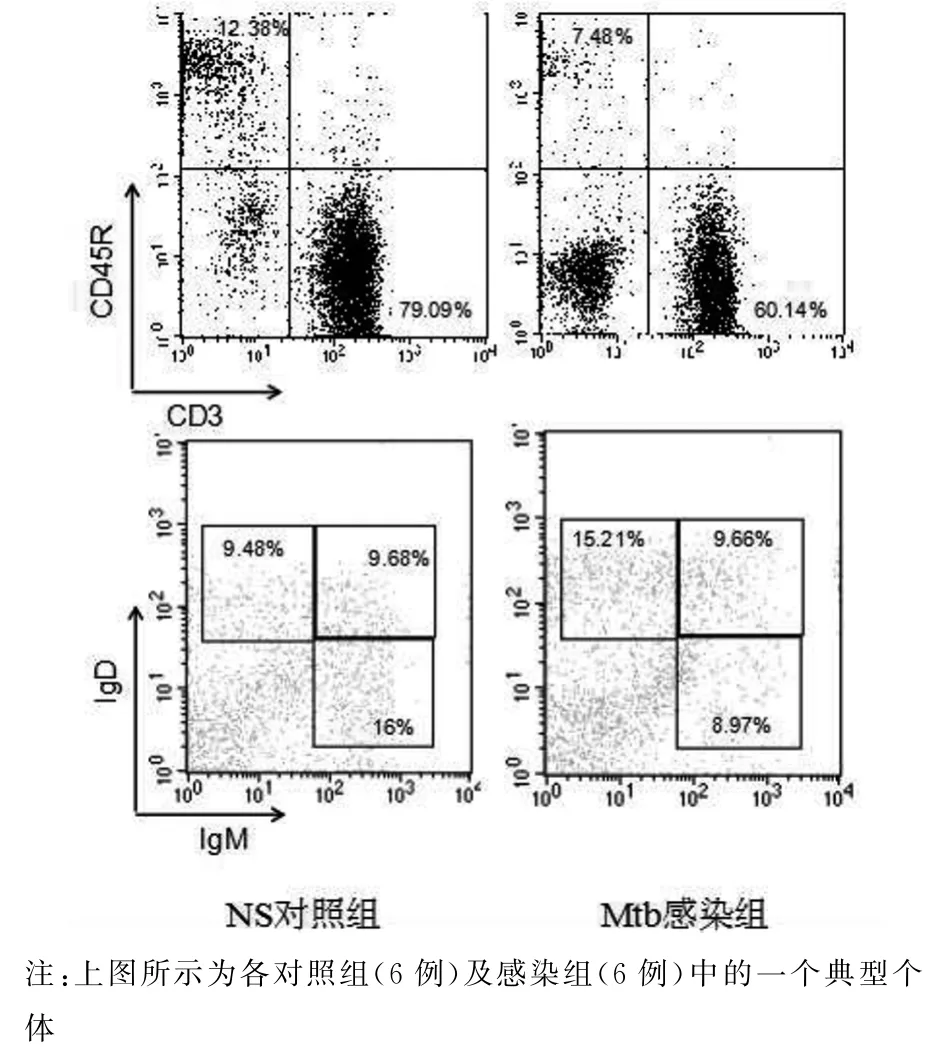
图4 感染4周时脾脏B细胞的分布Fig.4 Distribution of B cells in spleen at 4 week of Mtb infection
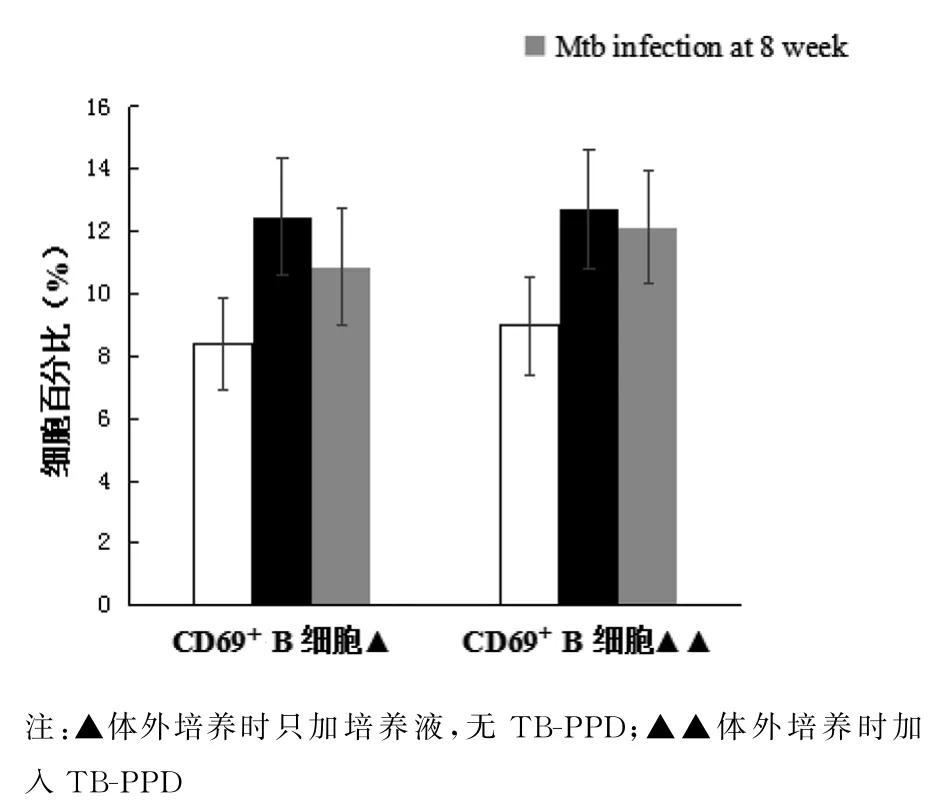
图5 Mtb感染小鼠与对照小鼠脾脏活化B细胞分析Fig.5 Analysis of splenic activated B cells of mice infected with Mtb and uninfected
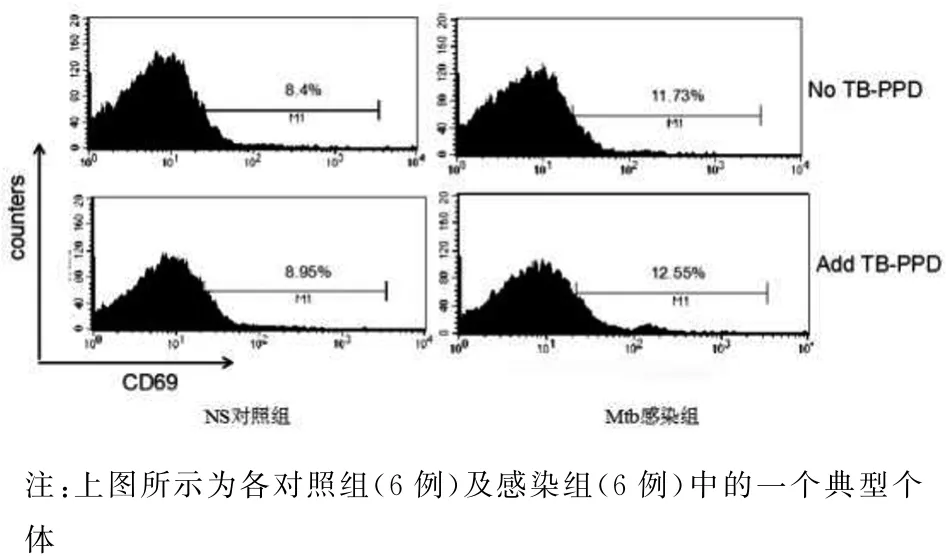
图6 感染4周时脾脏B细胞CD69分子的表达Fig.6 Expression of CD69 molecule on splenic B cells at 4 week of Mtb infection
2.4 Mtb感染促进了记忆性B细胞的产生 Mtb感染小鼠的脾脏细胞经CD45R-PE/CD27-APC/IgD-FITC染色,“gate”CD45R+细胞群,分析记忆性B细胞的分布.感染4周与8周时,Mtb感染小鼠与NS对照小鼠比较,脾脏记忆性B细胞(CD45R+CD27+IgD+/-)(4周:t=-4.203,P<0.05;8周:t=-5.280,P<0.05)、类 别转换记 忆 B 细胞(CD45R+CD27+IgD-)升高(4周:t=-4.217,P<0.05;8周:t=-4.661,P<0.05);Mtb感染8周与4周比较,脾脏记忆性B细胞(t=-4.312,P<0.05)及类别转换记忆B细胞升高(t=-3.821,P<0.05)(见图7、图8).
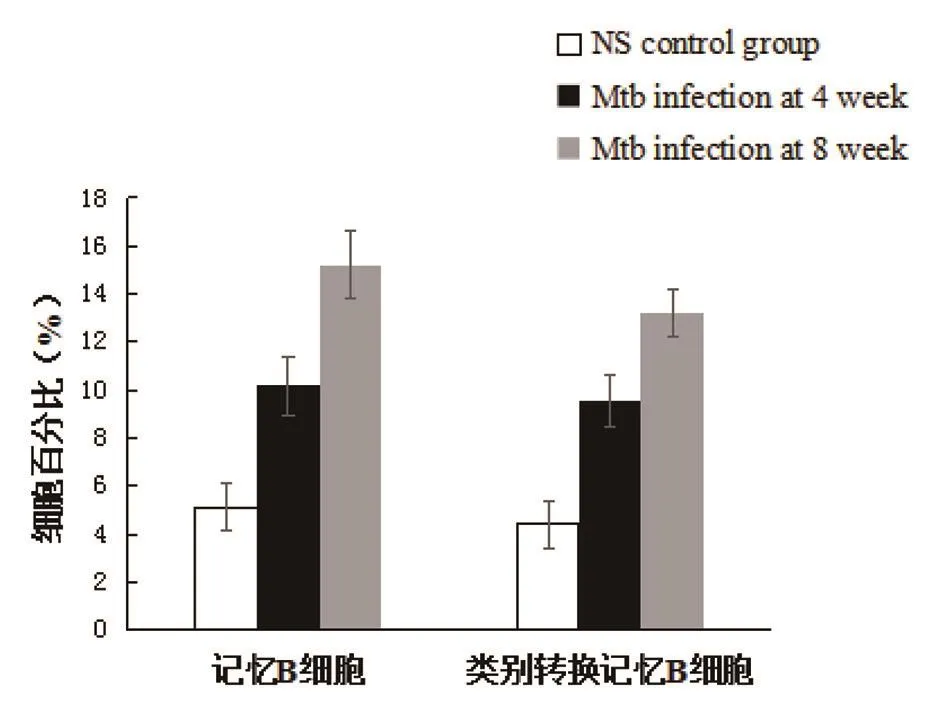
图7 Mtb感染小鼠与对照小鼠脾脏记忆性B细胞分析Fig.7 Analysis of memory B cells of mice infected with Mtb and uninfected
3 讨 论
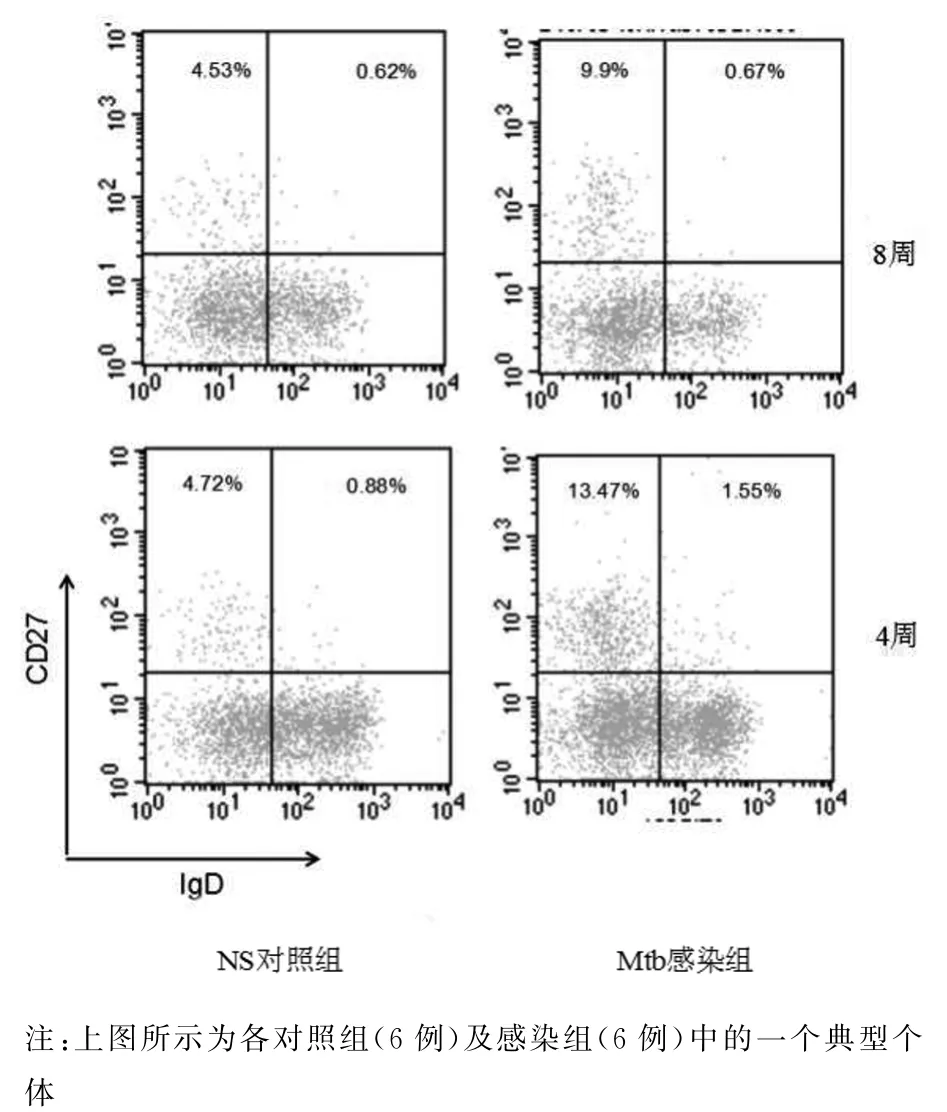
图8 感染早期及晚期脾脏记忆性B细胞的分布Fig.8 Distribution of memory splenic B cells at different infected stage in the BALB/c mice
在B细胞的分化发育进程中,一些表面分子的表达呈现规律性改变,据此可以将整个过程分为5个阶段[7],即pro-B、pre-B、未成熟B细胞、过渡B细胞(包括过渡型T1和过渡型T2细胞)和成熟B细胞,前3个阶段在骨髓进行,后2个阶段在脾脏中进行[8-9].未成熟B细胞被从骨髓运送到脾脏,在脾脏内,BCR信号促使未成熟B细胞继续发育,先形成过渡型T1和过渡型T2细胞,最后成熟主要定居于淋巴滤泡.成熟B细胞在受到抗原刺激后分化为记忆性B细胞和效应性B细胞(浆细胞)[9-10].近年来,随着免疫学的发展,新的细胞亚群的不断发现,B细胞在结核中的研究越来越受到重视,B细胞不仅是结核结节中数量最多的细胞,而且其在参与结核的保护性免疫中也发挥重要作用.在本实验中,在感染早期,骨髓B细胞与脾脏B细胞总量呈减少趋势.Mtb感染时,pro-B细胞、未成熟B细胞、T1 B细胞减少,而骨髓成熟B细胞与脾脏成熟B细胞增多,且感染晚期与早期相比,pro-B+pre-B细胞、未成熟B细胞、T2 B细胞及成熟B细胞均有所增加,提示Mtb感染促使B细胞向成熟细胞方向发育;另外,感染小鼠脾脏B细胞CD69分子的表达升高,经抗原(TB-PPD)刺激后CD69增加显著,即感染能促使活化B细胞增多,且在感染4周时,B细胞已得到充分活化,表现为感染4周和8周的活化B细胞比例相似;另外,小鼠的记忆性B细胞、类别转换记忆B细胞也增多,且晚期较早期增多得更为明显.上述结果提示,结核感染能影响B细胞的分化发育,促使B细胞向成熟细胞分化,并使B细胞活化增强,产生更多的记忆性B细胞,有利于抗Mtb作用.

