人乳头瘤病毒16型L1的表达、病毒样颗粒组装及其免疫原性研究
刘 微,郭明旸,纪莉婷,韩亚如,谢文静,王会岩
人乳头瘤病毒(Human papillomavirus,HPV)属于无包膜DNA病毒,病毒外壳呈二十面体,病毒基因组为闭合环状双链DNA.目前已发现200种以上的基因型,根据其致癌性分为高危型和低危型,高危型HPV的感染与宫颈癌发病密切相关[1-2],其中,50%以上的宫颈癌与HPV16感染有关,是致癌性最强的HPV型别.HPV的衣壳由结构蛋白L1和L2组成,单独的L1或L1与L2共表达后可组装成病毒样颗粒(Virus like particles,VLPs),VLPs的形态结构与天然病毒高度相似,可刺激机体产生高滴度的中和抗体[3-5],是预防性疫苗的理想形式[6-7].VLPs的最小结构单元是L1蛋白单体.正确折叠的L1蛋白单体能组装成五聚体,然后在适宜的条件下进一步自组装成含有72个5聚体的VLPs.对VLPs体外自组装研究已成为HPV疫苗分子设计的重要研究方向.目前已经上市的Gardasil 9、Gardasil和Cervarix 3种预防性HPV疫苗均由真核表达系统获得[8-9],为降低疫苗生产成本,本研究尝试以原核表达系统制备HPV16 L1,于体外组装VLPs,为预防性HPV疫苗的研究提供数据基础.
1 材料与方法
1.1 材料与仪器 BL21(DE3)和DH5感受态细胞购自北京全式金生物技术有限公司,293FT细胞由本 实 验 室 保 藏,p ET-28a、pcDNA3.1-Luc+和pShell16质粒由吉林大学艾滋病疫苗工程实验室提供.BALB/c小鼠由长春生物制品所提供.DMEM培养基购自美国Thermofisher公司,Ex Taq、XhoⅠ、XbaⅠ和T4连接酶购自日本TAKARA公司,HPV16 L1单克隆抗体购自英国Abcam公司,辣根酶标记的山羊抗小鼠IgG,ECL PLUS超敏发光液购自北京鼎国昌盛生物技术有限公司,质粒小量提取试剂盒和胶回收试剂盒购自北京天根生化科技有限公司,Bright-GloTMLuciferase Assay购自美国Promega公司,Zetasizer Nano ZS90粒径分析仪购自英Malvern公司,透射电子显微镜H-7650购自日本Hitachi公司,NGCQuestTM10蛋白纯化系统和GelDoc XR+凝胶成像系统购自美国Bio-Rad公司,His Trap HP预装镍柱购自美国GE公司,ELX-800多功能酶标仪购自美国Bio Tek公司,XPN-100超速离心机购自美国Beckman公司.
1.2 HPV16 L1基因的优化与合成 根据Gen-Bank数据库中HPV16L1(序列号:KU721788.1)的基因序列,自C端截短25个氨基酸残基,利用http://www.jcat.de/网站将序列优化成E.coli偏爱的密码子,合成HPV16L1△C25基因,由上海捷瑞生物工程有限公司完成.
1.3 p ET28a-16L1△C25质粒的构建 利用Primer Premier 5.0软件设计C端含有 His标签的HPV16L1△C25基因引物,如下:5′-CCGCTCGTGATGATGCCGTCTGAAGCGACC-3′,下游引物5′-ACGTCTAGATTAGTGATGGTGATGGTGATGAAATTTCGGTTTAGCTTTCAG-3′,HPV16 L1△C25基因两端带有XhoⅠ和XbaⅠ酶切位点,引物合成工作由上海捷瑞生物工程有限公司完成.PCR反应体系:模板DNA 2μL,上、下游引物各1μL,Ex Taq酶1μL,d NTP 4μL,10×PCR buffer 5μL,去离子水37μL.PCR反应条件:94℃预变性5 min;94℃变性45 s,55℃退火45 s,72℃延伸90 s;72℃终延伸10 min.PCR产物用1.0%琼脂糖凝胶电泳进行鉴定.将鉴定正确的PCR产物和p ET-28a同时用XhoⅠ和XbaⅠ双酶切,经胶回收后于16℃连接过夜,转化入DH5感受态细胞,挑取单克隆震荡培养过夜后提取质粒,双酶切鉴定后送测序.
1.4 HPV16 L1△C25蛋白的诱导表达及纯化 将测序正确的p ET28a-16L1△C25转入BL21(DE3)感受态细胞,挑取单克隆于37℃震荡培养过夜,次日按1∶50的比例将菌液接入含有K+抗性(40 μg/m L)的LB培养基中,当OD600值达到0.8时,加入IPTG(终浓度0.2 mmol/L)于16℃诱导过夜,4 000 r/min离心30 min收集菌体,以1/10培养基体积的缓冲液(50 mmol/L Tris,200 mmol/L NaCl p H=8.0)重悬并超声菌体,16 000 r/min离心30 min收集上清,经0.45μm孔径的滤膜过滤后在NGCQuestTM10型快速液相色谱仪上进行Ni SepharoseTM6 Fast Flow亲和色谱纯化,以含50 mmol/L、100 mmol/L、300 mmol/L和500 mmol/L咪唑的缓冲液进行梯度洗脱,收集各梯度洗脱组分,利用SDS-PAGE及Western blotting分析HPV16 L1△C25表达及纯化情况.
1.5 HPV16 VLPs的组装 在 HPV16 L1△C25纯化样品中加入DTT终浓度至10 mmol/L,于4℃充分作用2 h后,样品经Sephadex G-25凝胶过滤层析纯化,以组装液(50 mmol/L PBS,0.5 mol/L NaCl,2 mmol/L MgCl2)洗脱,收集蛋白洗脱组分于4℃充分作用72 h,组装VLPs.
1.6 HPV16 VLPs的形态学检测
1.6.1 粒 径 分 析 利 用 Malvern Zetasizer Nano ZS90粒径分析仪检测HPV16 VLPs的粒径大小,检测前用0.22μm的滤膜过滤样品,使用Zetasizer Software软件对数据进行处理和分析.
1.6.2 电镜观察 HPV16 VLPs经3%磷钨酸p H 7.0负染,固定于喷炭的铜网上.设定放大倍率为50 000倍,电压80 k V,在电镜下观察颗粒形态.
1.7 HPV16 VLPs的免疫原性检测
1.7.1 HPV16 VLPs的纯化 将重组装好的HPV16 VLPs置于40%(wt/wt)蔗糖/PBS层上,4℃25 000 r/min离心2.5 h,离心后的沉淀加入密度为1.29 g/m L CsCl溶液,32 000 r/min,4℃,离心20 h,收集备用.
1.7.2 免疫动物 将BALB/c小鼠随机分为2组,每组8只,使用纯化后的HPV16 VLPs进行腹腔免疫,同时免疫PBS作为阴性对照,以氢氧化铝为佐剂.免疫时间为第0、2和4周,分别在0、1、2、3、4、6周尾静脉取血,2 000 g离心5 min,吸取上层血清,放置于-80℃冰箱保存.
1.7.3 HPV16假病毒包装与纯化 将报告基因质粒pcDNA3.1-Luc+与结构基因质粒pShell6共同转染293FT细胞,48 h后收获细胞,细胞沉淀以1×108个/m L的浓度溶于细胞裂解液中,置于37℃培养箱中16 h,每隔4 h上下颠倒使裂解液混匀,冰浴环境加入NaCl(终浓度为850 mmol/L).随后置混合物于冰上10~20 min.4℃离心,收集备用,假病毒纯化方法参考1.7.1.
1.7.4 HPV16假病毒滴度检测 将293FT细胞铺于96孔细胞培养板中,每孔细胞数为2×104个/100μL,假病毒分别进行101,102,103,104,105,106倍稀释.在96孔细胞培养板中,每孔加入100μL假病毒稀释液,72 h后,每孔吸取70μL培养液,加入50μL Bright-GloTMLuciferase Assay试剂,反应时间2 min,使用多功能酶标仪检测荧光素酶活性值,以10倍空白对照组值为Cut off值,计算假病毒滴度(CCID50).
1.7.5 血清中和抗体检测 将293FT细胞铺于96孔细胞培养板中,每孔细胞数为2×104个/100μL,假病毒(600 CCID50/50μL)与免疫血清稀释液(连续10倍梯度稀释)等体积混合后,轻轻混匀,冰浴1 h,将混合物加到细胞培养板中,72 h后加入50μL Bright-GloTMLuciferase Assay试剂,反应时间为2 min,使用多功能酶标仪检测荧光素酶活性值,以10倍空白对照组值为cut off值,计算假病毒滴度CCID50(cell culture infective dose 50%)细胞培养半数感染量.
2 结 果
2.1 p ET28a-16L1△C25质粒的构建 重组质粒p ET28a-16L1△C25经XhoⅠ和XbaⅠ双酶切,得到369 bp和1 539 bp两条片段,质粒片段约3 500 bp左右,与预期结果一致(图1),将鉴定正确的质粒送DNA测序,结果显示序列完全正确.
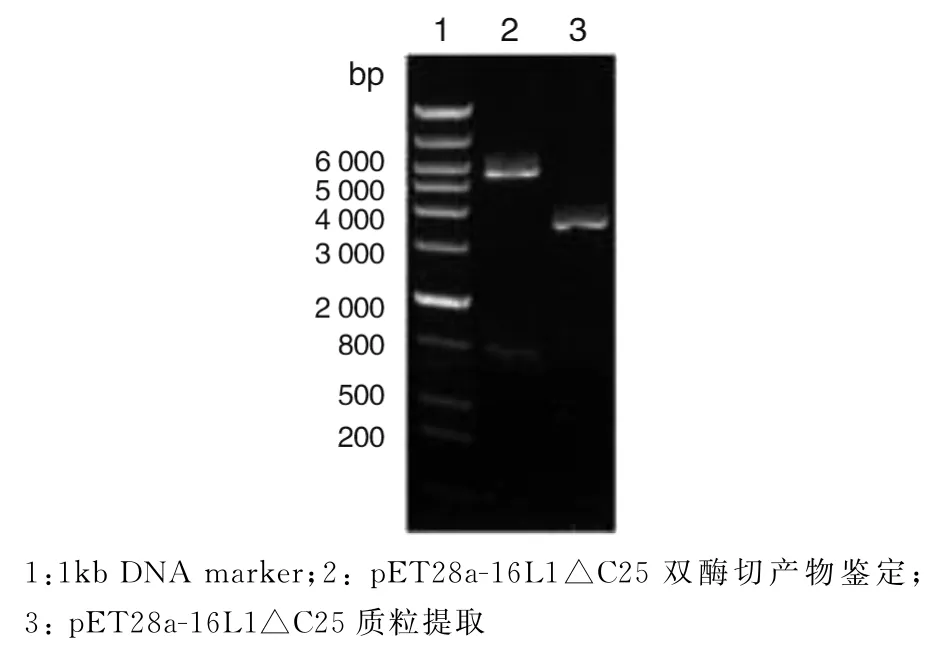
图1 重组表达载体pET28a-16L1△C25的构建及鉴定Fig.1 Construction and identification of recombinant plasmid pET28a-16L1△C25
2.2 HPV16 L1△C25蛋白的诱导表达及纯化 将重组质粒p ET28a-16L1△C25转化入BL21(DE3)感受态细胞中诱导表达,SDS-PAGE凝胶电泳分析显示,在55 k D处可见目的蛋白带(图2),同时进行Western blotting检测,在目标位置出现特异性条带(图3),表明成功表达HPV16 L1△C25蛋白.
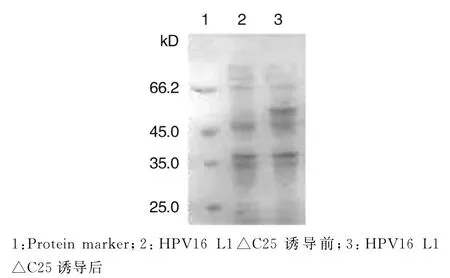
图2 IPTG诱导HPV16 L1△C25表达的SDS-PAGE分析Fig.2 SDS-PAGE analysis of HPV16 L1△C25 protein induced by IPTG
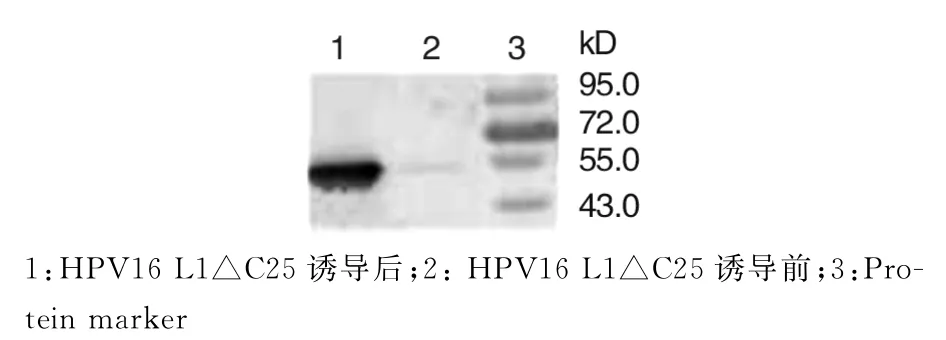
图3 IPTG诱导HPV16 L1△C25表达的Western blotting分析Fig.3 Western blotting analysis of HPV16 L1△C25 protein induced by IPTG
将筛选得到的高表达菌株大量表达,发现HPV16 L1△C25蛋白的表达存在两种形式,即包涵体表达和可溶性表达,且可溶性表达量更高,因此本研究以可溶性组分进行亲和层析纯化蛋白,发现300 mmol/L咪唑可洗脱下少量目标蛋白,500 mmol/L咪唑可将大量目标蛋白洗脱下来,纯度可达90%以上,可溶性良好.

图4 HPV16 L1△C25纯化的SDS-PAGE分析Fig.4 SDS-PAGE analysis of HPV16 L1△C25 protein purified
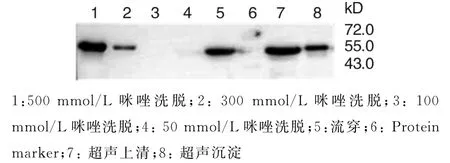
图5 HPV16 L1△C25纯化的Western blotting分析Fig.5 Western blotting analysis of HPV16 L1△C25 protein purified
2.3 HPV16 VLPs的形态学检测 将自组装72 h后的蛋白样品进行动态光散射和电镜检测.结果显示,组分中存在大量50 nm左右的球状颗粒,大小与HPV大小基本一致,说明我们原核表达的HPV16 L1△C25蛋白可以在体外自组装成天然VLPs.
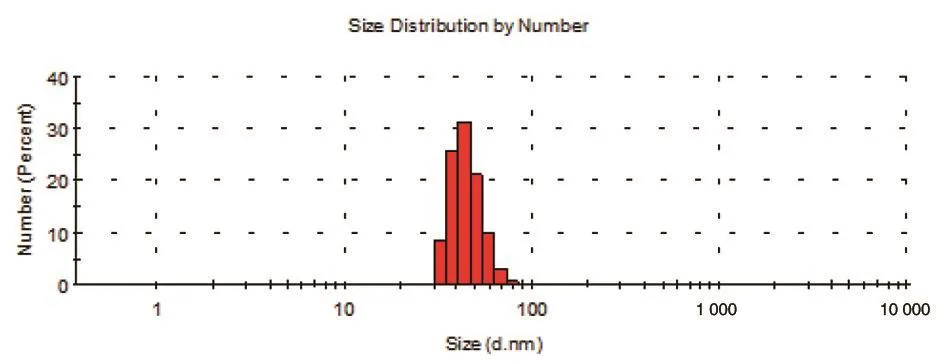
图6 HPV16 VLPs的动态光散射分析Fig.6 Dynamic light scattering analysis of HPV16 VLPs

图7 HPV16 VLPs的电镜分析Fig.7 Electron micrograph analysis of HPV16 VLPs
2.4 HPV16 VLPs的免疫原性检测 利用Reed-Muench方法计算HPV16 VLPs的CCID50为106.1/100μL,以600 CCID50/50μL假病毒接种量用于假病毒中和试验,初免后免疫组中和抗体滴度较低,Log10平均值约为3.14,经2次加强免疫,第6周小鼠血清中和抗体水平显著提高,Log10平均值达到4.43,PBS组小鼠没有阳性反应(图8).
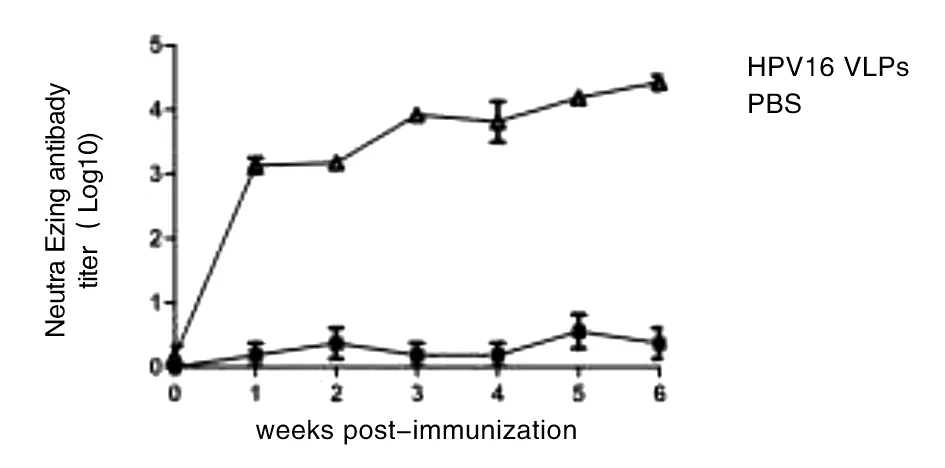
图8 假病毒中和试验检测HPV16 VLPs免疫后血清中和抗体Fig.8 Detection of serum neutralizing antibodies after HPV16 VLPs immunization by pseudovirus neutralization test
3 讨 论
世界卫生组织的统计资料表明,宫颈癌在全球女性最常见的癌症中居第2位,我国平均每年新发病例约13万左右,占世界宫颈癌新发病例总数的28.8%.HPV感染是诱发宫颈癌的主要病因[10],因此开发HPV疫苗是预防宫颈癌的最重要手段[11].
目前全球已经上市的预防性宫颈癌疫苗已经有3种,分别为Merck公司的HPV四价疫苗(Gardasil)、九价疫苗(Gardasil 9)以及GSK公司的二价疫苗(Cervarix),疫苗形式均为VLPs,含有能够诱导中和抗体所需的构象表位,可刺激机体产生高滴度的中和抗体,能够预防病毒对女性宫颈的感染.这3种疫苗均由真核表达系统所制备,其中Gardasil和Gardasil 9采用酿酒酵母表达系统[12-13],Cervarix采用昆虫-杆状病毒表达系统[14].虽然真核细胞所表达的VLPs在形态上更接近天然的病毒,且不需要体外解组装-重组装的步骤,但是真核表达系统的蛋白表达量低,生产成本高,使得疫苗的售价偏高,不能惠及发展中国家的女性.
原核表达系统是目前应用比较成熟的蛋白表达系统[15],在大肠杆菌中,病毒L1单体蛋白可大量表达并组装成五聚体,却不能进一步装配成天然形态的VLPs[16].但有研究表明包涵体L1通过体外变性、复性处理后可形成VLPs,但是变性蛋白的复性率较低,大部分L1蛋白无法组装成天然构象的VLPs,因此可溶性表达L1蛋白并于体外正确组装是原核系统在HPV疫苗生产过程的核心问题.本研究将L1蛋白C末端核定位信号部分去掉25个氨基酸并优化密码子,目的是增加其可溶性表达,低温诱导过夜发现可溶性L1表达量高于包涵体L1表达量,利用亲和层析的方法获得高纯度目标蛋白.天然的VLPs由72个L1五聚体组成,每个五聚体中L1单体C末端的H4螺旋都与邻近五聚体L1单体的H4螺旋以二硫键的形式相互作用,将五聚体连接在一起,形成VLP颗粒[17].为了保证本研究制备的重组VLPs颗粒的均一性,采用含有DTT的缓冲液处理蛋白样品,还原二硫键,使之从构象不正确的病毒颗粒形式解聚成五聚体形式,之后再在适宜的环境中缓慢组装成构象正确的VLPs,经动态光散射和电镜检测,表明得到的VLPs大小正确,颗粒均一,将纯化后的HPV16 VLPs免疫小鼠可产生高水平的病毒特异性中和抗体,说明我们利用原核表达系统获得的重组VLPs具有很好的免疫原性,以上研究为HPV预防性疫苗原核表达工艺的完善提供了数据基础.
——一道江苏高考题的奥秘解读和拓展

