酵母与芽孢杆菌在小麦粉基质中共培养的生长规律
李 欣,黄实宽,常 旭,姚 娟,李志军,陈向东
(1.武汉大学生命科学学院,湖北武汉430072;2.湖北工业大学教育部发酵工程重点实验室,工业微生物湖北省重点实验室,湖北省工业发酵协同创新中心,湖北武汉430068;3.湖北安琪酵母股份有限公司,湖北宜昌443003)
我国白酒发酵属于典型的开放型自然发酵过程,多种不同微生物参与发酵过程。因此,研究微生物之间的相互作用对于白酒酿造机制的认识和酿造技术的发展均具有重要作用,特别是对白酒主体成分酒精和重要风味物质的形成发挥重要作用的酵母与其他微生物之间的互作关系[1-3]。唐洁等研究了酿酒酵母(Saccharomyces cerevisiae)和异常毕赤酵母(Pichia anomala)以顺序接种混菌发酵方式的代谢特征,结果表明,混合发酵能够形成更多的酯类物质,总酸和高级醇含量却相对较低,有效改善了发酵液的风味特性[4]。凌杰等[5]发现酱香型白酒发酵中的酿酒酵母能够抑制地衣芽孢杆菌的生长。吴轩德等[6]在研究酿酒酵母与巴氏醋杆菌(Acetobacter pasteurianus)混合发酵时发现酵母在发酵早期对醋酸菌的生长有抑制作用,而在发酵后期受到醋酸菌的影响而加快衰亡。酱香型白酒酿造优势菌株拜耳接合酵母(Zygosaccharomyces bailii)与地衣芽孢杆菌共培养时受到温度依赖型的抑制作用,即37℃下地衣芽孢杆菌抑制拜耳接合酵母生长[7]。熊小毛等[8]将东方伊萨酵母菌Z1、酿酒酵母XG-1和解淀粉芽孢杆菌WB-1混合发酵时,2种酵母菌在发酵过程中始终占优势,而芽孢杆菌在发酵中后期明显受到抑制。可见,不同酵母菌株之间以及酵母与细菌在白酒液态共酵过程中存在生长互作关系。
为改善和提高白酒固态发酵品质,在发酵过程中添加纯种外源微生物已经成为一种广泛采用的丰富微生物群系和维持特定微生物细胞浓度的手段[9-13]。传统白酒酿造过程中有大量的微生物参与[14-16],这些微生物是否能用于白酒液态发酵生产工艺中,其生长适配性是关键。本研究以白酒酿造中常见的地衣芽孢杆菌、枯草芽孢杆菌、酿酒酵母、汉逊酵母、毕赤酵母和鲁氏接合酵母为研究对象,分析共酵条件下的细菌和酵母的生长规律,为芽孢杆菌与酵母多菌种纯种发酵应用提供理论和应用指导。
1 材料与方法
1.1 材料、试剂及仪器
菌株:地衣芽孢杆菌(Bacillus licheniformis)、枯草芽孢杆菌(Bacillus subtilis)。酿酒酵母(Saccharomyce cerevisiae)、汉逊酵母(Hansenula)、弗比恩毕赤酵母(Pichia fabianii)、鲁氏接合酵母(Zygosaccharomyces rouxii)均由湖北宜昌安琪酵母股份有限公司提供。
小麦粉,武汉市太阳行食品有限责任公司;蛋白胨(生化试剂),北京双旋微生物培养基制品厂;葡萄糖(食品级),山东祥瑞药业有限公司;体积分数95%酒精(医用级),武汉兴和达商贸有限公司。
YEPD培养基:酵母粉10 g,蛋白胨20 g,葡萄糖20 g,蒸馏水1000 mL,自然pH值,115℃灭菌20 min。
LB培养基:酵母粉5 g,蛋白胨10 g,氯化钠10 g,蒸馏水1000 mL,pH7.2~7.4,121 ℃灭菌20 min。
小麦粉培养基:5 g小麦粉中加入100 mL水,振荡混匀,自然pH值,121℃灭菌20 min。
仪器设备:CJ-2D无菌操作台,天津泰斯特仪器有限公司;BL-75A高压灭菌锅,上海博迅实业有限公司公司;HNY-211B恒温摇床,天津欧诺仪器仪表有限公司;ZSD-A1160A恒温培养箱,上海智城分析仪器制造有限公司;CT15RE离心机,日本日立公司;V-1100D可见分光光度计,上海美谱达仪器有限公司。
1.2 实验方法
1.2.1 芽孢杆菌发酵液的制备
从菌种保藏斜面挑取适量芽孢杆菌菌苔于LB培养基中,37℃、180 r/min振荡培养。待OD600达到2.5(枯草芽孢杆菌)或6.0(地衣芽孢杆菌)后结束活化。接种1%芽孢杆菌种子液至小麦粉培养基中,于30℃、180 r/min条件下发酵72 h。发酵液在10000 r/min条件下离心10 min,收集上清液,用于静态法分析中的培养基的配制。
1.2.2 种子的制备
从新活化的YEPD平皿上挑取酵母菌落至YEPD培养基中,于30℃、180 r/min条件下培养,待OD600至达到15(酿酒酵母、汉逊酵母和毕赤酵母)或3.0(鲁氏酵母)后,结束培养并作为种子液用于后续静态法和动态法分析实验。
从新活化的LB平皿上挑取芽孢杆菌菌落至LB培养基中,于37℃、180 r/min条件下培养,待OD600至达到1.0(枯草芽孢杆菌)或3.0(地衣芽孢杆菌)后,结束培养并作为种子液用于后续动态法分析实验。
1.2.3 静态法分析细菌对酵母细胞生长影响
静态法是在酵母细胞培养的初期提供一定浓度的营养物质,而在整个细胞培养周期中不再额外添加任何营养物质。选取葡萄糖、蛋白胨和芽孢杆菌发酵液作为组分,设计了6个培养基,如表1所示。取0.5 mL酵母种子液加入2 mL无菌离心管中,以8000 r/min离心10 min,去除上清液,并在沉淀中加入0.2 mL无菌水,混匀后全部接入50 mL酵母生长培养基中(接种量1%),于30℃、180 r/min条件下培养24 h,并测定生物量。
1.2.4 动态法分析细菌对酵母细胞生长影响
动态法利用芽孢杆菌水解淀粉的能力为单一芽孢杆菌和单一酵母混合培养提供持续性碳源。取1.0 mL酵母或0.5 mL芽孢杆菌种子液加入2 mL无菌离心管中,以8000 r/min离心10 min,去除上清液,并在沉淀中加入0.2 mL无菌水,混匀后全部接入50 mL小麦粉培养基中(酵母的接种量2%,芽孢杆菌接种量1%),于30℃、180 r/min条件下培养,每24 h取样用于测定菌数。
1.2.5 微生物菌数的检测
微生物菌数的检测采用经典的稀释涂布法。新鲜的发酵样品经过适当倍数的稀释后涂布在固体培养基上,于30℃(酵母)或37℃(细菌)培养至菌落可见。LB固体培养基用于芽孢杆菌的计数。含有终浓度为25µg/mL氯霉素的YEPD固体培养基用于酵母的计数。总微生物数和酵母比例的计算如下:
总微生物数(CFU/mL)=酵母细胞数(CFU/mL)+芽孢杆菌菌数(CFU/mL);
酵母比例(%)=(酵母细胞数(CFU/mL))/(总微生物数(CFU/mL))×100。
1.2.6 数据分析
每组实验3个平行。运用Excel计算平均值和方差,并运用Origin 8.6软件对数据作图。
2 结果与分析
2.1 芽孢杆菌发酵液组分分析
B.licheniformis离心发酵上清液中的还原糖浓度为(3.29±0.11)g/L,pH5.82±0.05。B.subtils离心发酵上清液中的还原糖浓度为(10.68±1.81)g/L,pH7.06±0.14。
为了清晰地显示芽孢杆菌发酵液对酵母生长的影响,后续研究设置2个对照样。由于芽孢杆菌在小麦粉发酵培养基中会水解淀粉形成一定浓度的游离葡萄糖,将只含有2%葡萄糖的培养基设置为对照1,用于判断酵母生长缺失是否是由于营养碳源不足所导致。将含有2%葡萄糖和0.2%蛋白胨的培养基设置为对照2,用于分析是否是氮源缺乏导致酵母无法生长。2个对照样有助于解析发酵液营养条件与酵母生长的关系。
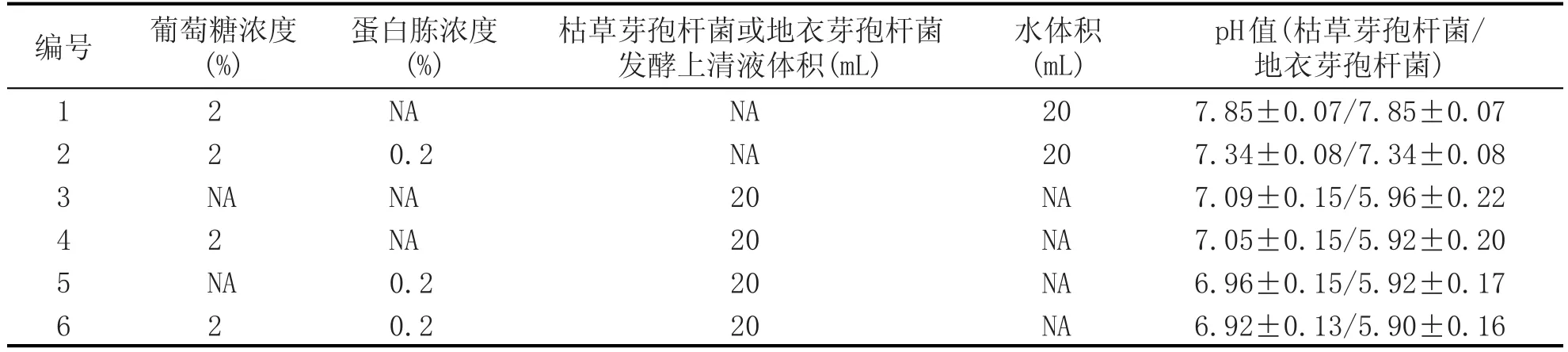
表1 6种酵母生长培养基
2.2 枯草芽孢杆菌发酵液对酵母生长的影响
图1展示了枯草芽孢杆菌发酵液对汉逊酵母、毕赤酵母、酿酒酵母和鲁氏结合酵母生长的影响。汉逊酵母在只含有葡萄糖的培养基中只有微弱的生长能力,但加入微量酵母浸粉后,其生长能力获得极大的促进,OD600值从0.342±0.08增加到4.852±0.44。枯草芽孢杆菌发酵液中的汉逊酵母生长水平最低,仅有0.088±0.02,添加葡萄糖和酵母浸粉后,其生长能力虽有所提升,但依然低于单一葡萄糖条件。可见,汉逊酵母的生长能力受到营养不足和芽孢杆菌发酵液抑制作用的双重影响。与汉逊酵母相似,毕赤酵母在只含有葡萄糖的培养基中也只有微弱的生长能力,但加入微量酵母浸粉后,其生长能力获得一定的促进,OD值增大了2.96倍。然而,只要存在枯草芽孢杆菌发酵液,无论是否加入葡萄糖和酵母浸粉,毕赤酵母生长能力都没有显著的变化,OD600均不超过0.2。可见,枯草芽孢杆菌发酵液不足以促进其的生长。与汉逊酵母和毕赤酵母相似,酿酒酵母在只含有葡萄糖的培养基中也只有微弱的生长能力,其OD600为0.411±0.20,但加入微量酵母浸粉后,其生长能力获得显著的增大,其OD600为3.198±0.38。酿酒酵母在枯草芽孢杆菌发酵液中的生长能力最差,其OD600为0.232±0.06,但葡萄糖或酵母浸粉对酿酒酵母的生长能力有微弱的回补作用。然而,同时补加葡萄糖和酵母浸粉后的效果依然无法与对照2等效。可见,碳源的不足是酿酒酵母在芽孢杆菌发酵液中生长差的原因之一。枯草芽孢杆菌发酵液中还存在抑制酿酒酵母生长的因子。鲁氏结合酵母在所有培养基中的生长水平都不高,且6种培养基之间没有巨大差异的出现,OD600分布在0.15~0.28之间,因此,无法就枯草芽孢杆菌对鲁氏结合酵母是否存在抑制作用得出明确的结论。这可能是鲁氏结合酵母自身的营养需求特性所决定。
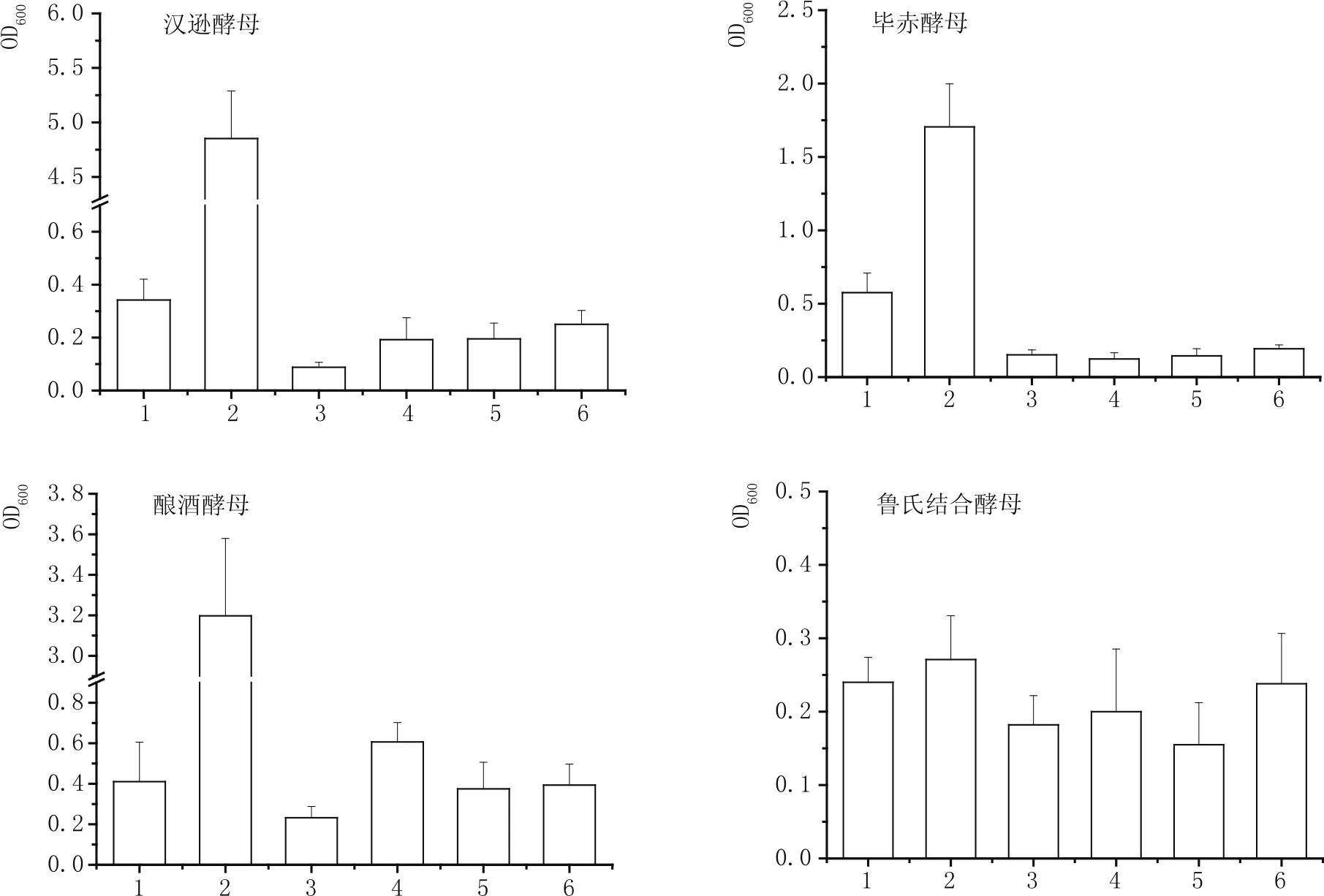
图1 4种酵母在含枯草芽孢杆菌发酵液的培养基中的生长比较
综上所述,枯草芽孢杆菌发酵液对4种酵母都有抑制效应,除鲁氏结合酵母外。一般而言,酵母的最适生长pH值在4~5之间。是否是由于pH值过高导致酵母无法生长呢?含有枯草芽孢杆菌发酵液的培养基的pH值均在7.0附近,而含有葡萄糖和酵母浸粉的培养基的pH值在7.3左右。除鲁氏结合酵母外,其余3种酵母在后一种培养基中的生长是所有条件中做好的,因此,pH值不应该被认为是酵母生长差的因素。
2.3 地衣芽孢杆菌发酵液对酵母生长的影响
图2展示了地衣芽孢杆菌发酵液对汉逊酵母、毕赤酵母、酿酒酵母和鲁氏结合酵母生长的影响。汉逊酵母在单一葡萄糖培养基中的生长是6种培养基中最弱的,其OD值只有0.34±0.08。在地衣芽孢杆菌发酵液中,汉逊酵母生长几乎不受影响,其OD值接近3.0。无论是单一葡萄糖培养基还是地衣芽孢杆菌发酵培养基,只要加入葡萄糖,汉逊酵母的生长都有显著的增长,分别比对照样提高了约16倍和1.9倍。当在地衣芽孢杆菌发酵液中添加酵母浸粉时,其促酵母生长效应比添加葡萄糖的更明显。最适培养基是在地衣芽孢杆菌发酵液中同时补加葡萄糖和酵母浸粉,其OD值为8.21±0.52。可见,地衣芽孢杆菌发酵液对汉逊酵母生长没有抑制作用,而且添加碳源和有机氮源对汉逊酵母均有促生长效果,但有机氮源对促进汉逊酵母的生长效果更强。毕赤酵母在单一葡萄糖培养基和单一地衣芽孢杆菌发酵液培养基中具有相似的OD值,分别为0.58±0.13和0.72±0.23。当葡萄糖中加入酵母浸粉后,毕赤酵母的生长得到显著提升,OD值超过1.5。而地衣芽孢杆菌发酵液中添加葡萄糖后,其OD值只增大了约0.2,但添加酵母浸粉后,其OD值增大到1.90±0.16。最佳的营养环境是在地衣芽孢杆菌发酵液中同时添加葡萄糖和酵母浸粉,其OD值为2.39±0.28。可见,毕赤酵母能够在地衣芽孢杆菌发酵液中生长,其生长能力不强的主要原因是缺乏氮源。在所有的营养条件下,酿酒酵母在只存在葡萄糖的培养基中的生长能力是最弱的,OD值为0.41±0.19,但添加少量的酵母浸粉后,其生长OD值超过3.0。在地衣芽孢杆菌发酵液中的生长OD值超过1.0,而且单一添加葡萄糖并不会促进酵母生长能力的提高,但是加入酵母浸粉能极大的提升酵母生长能力,OD值为3.30±0.40。可见,酿酒酵母在地衣芽孢杆菌中具有一定的生长能力,其生长能力不强的主要原因是氮源的缺乏,而非碳源。与前述的3种酵母明显不同,鲁氏结合酵母在单一葡萄糖培养基和地衣芽孢杆菌发酵液培养基中的生长能力都很弱,其OD值均未超过0.3。同时,在这两种基础培养基中单一添加葡萄糖或酵母浸粉,鲁氏结合酵母的生长也没有显著提升,OD值不超过0.4。最适的营养条件是在地衣芽孢杆菌发酵液中同时添加葡萄糖和酵母浸粉,其OD值是其他营养条件的3~4倍。可见,鲁氏结合酵母的生长同时需要足量的碳源和有机氮源,且碳源比有机氮源对鲁氏结合酵母更重要。综上所述,4种酵母在地衣芽孢杆菌发酵液中生长能力不强的主要原因在于发酵液中营养物组分和浓度不足。

图2 4种酵母在含地衣芽孢杆菌发酵液的培养基中的生长比较
2.4 枯草芽孢杆菌与酵母混培过程中的酵母细胞数的变化
枯草芽孢杆菌分别与4种酵母混培过程中的总菌数和酵母细胞数的变化如图3所示。4种酵母中,汉逊酵母和酿酒酵母与枯草芽孢杆菌混培时,发酵液中的总菌数都是持续性增加,在发酵终点达到最大,分别为2.39×109±2.76×109CFU/mL(汉逊酵母)和4.58×109±0.53××109CFU/mL(酿酒酵母)。毕赤酵母和鲁氏接合酵母分别与枯草芽孢杆菌混培时,总菌数分别在发酵第72 h(10.23×107±0.50×107CFU/mL)和144 h(34.20×108±0.62×108CFU/mL)积累至最大值,随后分别下降至 2.44×107±0.13×107CFU/mL(毕赤酵母)和30.40×108±0.85×108CFU/mL(鲁氏接合酵母)。除汉逊酵母和毕赤酵母外,其他2种混培条件下的酵母细胞数都呈现出持续下降过程,发酵结束时的酿酒酵母细胞数为2.33×102CFU/mL,而鲁氏接合酵母检测不到。与此对应的是,酵母比例随着发酵进行而逐渐下降。可见,枯草芽孢杆菌分别与酿酒酵母和鲁氏酵母混培过程中总菌数的变化主要反映的是枯草芽孢杆菌的菌数变化,也说明酿酒酵母和鲁氏接合酵母与枯草芽孢杆菌的适配性差。在混培体系中,汉逊酵母和毕赤酵母都能保持一段生长增殖阶段,最大酵母细胞数分别为5.30×108±0.54×108CFU/mL(汉逊酵母,72 h)和6.73×107±0.70×107CFU/mL(毕赤酵母,144 h),但酵母细胞数都无法维持。同时,汉逊酵母的细胞比例持续下降,只有毕赤酵母的细胞比例在发酵中后期上升并维持。

图3 4种酵母与枯草芽孢杆菌混培过程中酵母细胞数的变化
2.5 地衣芽孢杆菌与酵母混培过程中的酵母细胞数的变化
地衣芽孢杆菌分别与4种酵母混培过程中的总菌数和酵母细胞数的变化如图4所示。当地衣芽孢杆菌与酵母混培时,最高总微生物数均在发酵中期,分别为17.12×108±2.84×108CFU/mL(汉逊酵母,图4A)、8.33×108±0.26×108CFU/mL(毕赤酵母,图4B)、21.36×108±4.58××108CFU/mL(酿酒酵母,图4C)和31.27×108±1.68×108CFU/mL(鲁氏接合酵母,图4D)。在混培体系中,除汉逊酵母有明显的生长增殖过程(最大值为14.70×108±3.00×108CFU/mL),毕赤酵母和酿酒酵母的细胞数分别在0.22×108CFU/mL和0.70×108CFU/mL左右波动,而鲁氏接合酵母细胞数呈持续下降,发酵终点的细胞数只有3.67×102±0.47×102CFU/mL。相对应的,汉逊酵母细胞比例持续增大,而另外3种酵母的细胞比例持续下降。可见,这4种混酵体系中,除汉逊酵母与地衣芽孢杆菌的混酵过程以酵母细胞增殖为主,其他3种情况皆以地衣芽孢杆菌增殖为主。同时,汉逊酵母与地衣芽孢杆菌的适配性在这4种酵母中是最佳的。
3 结论与讨论
相比单菌种纯种发酵,多菌种纯种发酵有着更复杂的互作关系。不同种属和性状的微生物在生长和代谢之间的影响将对发酵产物产生巨大的影响。本研究采用的静态法(恒定的初始碳源)和动态法(持续供给碳源)相互补充,共同揭示了2种芽孢杆菌和4种酵母在生长上的相互影响。营养物浓度对酵母的生长繁殖能力起主要作用。同时,枯草芽孢杆菌对酵母有生长抑制效应,这种作用来自枯草芽孢杆菌合成的某种或某些代谢产物,但地衣芽孢杆菌对酵母的生长抑制作用微弱。与此相匹配,当有持续性的碳源提供时,汉逊酵母显著生长,而毕赤酵母或明显增殖(枯草芽孢杆菌中)或维持生长(地衣芽孢杆菌中),酿酒酵母或持续减少(枯草芽孢杆菌中)或维持生长(地衣芽孢杆菌中)。除汉逊酵母与地衣芽孢杆菌的混酵过程以酵母细胞增殖为主,其他培养过程均以芽孢杆菌增殖为主。同时,酵母与芽孢杆菌的适配性顺序为汉逊酵母>毕赤酵母>酿酒酵母>鲁氏酵母。

图4 4种酵母与枯草芽孢杆菌混培过程中菌数的变化
鲁氏酵母是4种酵母中受影响最大的。在恒定的初始碳源条件下,鲁氏酵母几乎不生长;持续供给碳源时,鲁氏酵母细胞数在两种芽孢杆菌中均持续性下降。这既与鲁氏酵母对营养需求的特殊性相联系,也与芽孢杆菌抑制效应有关。毕赤酵母也表现出一些有趣的现象。当枯草芽孢杆菌持续提供碳源时,毕赤酵母细胞比例持续升高,甚至出现抑制枯草芽孢杆菌的效应,而在静态法中,毕赤酵母几乎不生长;当地衣芽孢杆菌持续提供碳源时,毕赤酵母细胞比例下降,而在静态法中,毕赤酵母生长能力随营养丰度增加而提高。前者很可能与碳源不足有关,而后者可能是由于地衣芽孢杆菌在混培特定阶段产生抑制性代谢产物而引起。可见,多菌种纯种混培过程的微生物间生长关系复杂,它们之间的关系受到微生物菌种特性、营养环境和代谢产物等共同影响。

