高温大曲中高产四甲基吡嗪菌株的筛选及鉴定
陈梦圆,李志军,罗爱民
(1.四川大学轻纺与食品学院,四川成都610065;2.安琪酵母股份有限公司,湖北宜昌443000)
四甲基吡嗪,又名川芎嗪,是白酒中的健康因子以及主要功能性成分之一,赋予白酒有益健康的功能[1],因此,白酒中四甲基吡嗪的研究成为白酒健康因子方面研究的重要方向。四甲基吡嗪在不同香型白酒中普遍存在[2]。由于不同的酿造工艺,导致不同香型白酒中四甲基吡嗪含量差异较大[3]。其在酱香型白酒中含量较高,在其他香型白酒中偏低[4]。
高温制曲是酱香型白酒独特的工艺之一[5],也是导致酱香型白酒中四甲基吡嗪含量比其他香型白酒高的重要原因[6]。研究显示,制曲阶段所产生的四甲基吡嗪是白酒中四甲基吡嗪的主要来源之一[7],因此,高温大曲是影响白酒中四甲基吡嗪含量的主要因素,且高温大曲中产四甲基吡嗪能力较强的微生物主要是芽孢杆菌[8]。本研究从高温大曲中筛选高产四甲基吡嗪的菌株,为制备高产四甲基吡嗪的功能曲提供一定的理论支持,为提高白酒中四甲基吡嗪含量奠定基础。
1 材料与方法
1.1 材料、试剂及仪器
材料:高温大曲、稻壳、麸皮,均由某酒厂提供。
牛肉膏蛋白胨培养基(L):牛肉膏5 g,蛋白胨10 g,氯化钠5 g,琼脂20 g,pH 7.0~7.2,121 ℃ 灭菌30 min。
液体培养基(L):酵母膏5 g,蛋白胨10 g,氯化钠10 g,pH 7.0~7.2,121 ℃灭菌 20 min。
富集培养基(L):酵母膏3 g,蛋白胨10 g,淀粉3 g,MgSO4·7H2O 0.01 g,KH2PO40.2 g,Na2HPO42 g,pH7.8,121 ℃灭菌20 min。
麸皮培养基:麸皮过40目筛,稻壳过10目筛,按麸皮∶稻壳4∶1混合,常压下蒸30 min,使水分含量为36%。装入锥形瓶中用8层纱布封口,121℃灭菌30 min。
试剂:四甲基吡嗪标品(98%),北京盛世康普化工技术研究院;乙偶姻标品(98%),上海阿拉丁生化科技股份有限公司;甲醇、乙醇,色谱纯,成都金山化学试剂有限公司。
仪器设备:YXQ-LS-30SII立式压力蒸汽灭菌锅,上海博讯实业有限公司医疗设备;MJ-250型恒温培养箱,上海一恒科学仪器有限公司;WH-2型微型漩涡混合仪,上海沪西分析仪器厂有限公司;5810R台式冷冻离心机,德国Eppendorf公司;2720 thermal cycler聚合酶链式反应(Polymerase Chain Reaction,PCR)仪 Applied Biosysterms,上海赛默生物科技有限公司;DYCP-31 DNA电泳槽、DYY-5稳压电泳仪,北京六一仪器厂;FR980凝胶成像仪,上海复日科技仪器有限公司;7890A自动进样气相色谱仪,安捷伦科技有限公司;安捷伦1200高效液相色谱仪,配有紫外检测器、C18110A(250×4.60 mm)色谱柱;SW-CJ-ID双人单面超净工作台,江苏净化设备公司。
1.2 实验方法
1.2.1 高产四甲基吡嗪菌株分离与纯化
在无菌环境下称取10.00 g高温大曲粉碎样品到100 mL无菌水中,37℃、120 r/min振荡30 min。然后在85℃水浴锅中水浴30 min。取水浴后的上清液5.0 mL加入到95 mL的富集培养基中,37℃、140 r/min振荡富集培养24 h。将富集液进行梯度稀释,依次配成10-2、10-3、10-4、10-5、10-6、10-7的菌悬液。取10-3、10-4、10-5、10-6、10-7浓度的菌悬液各0.1mL,分别涂布平板,37℃条件下倒置培养24 h。获得的单菌落经多次平板划线和平板涂布交替进行的步骤得以纯化。将纯化后的细菌制片染色,观察菌落形态及细菌形态,去掉重复的细菌,将筛出的单菌分别保存。
1.2.2 高产四甲基吡嗪菌株的筛选
1.2.2.1 种子菌悬液的制备
将分离得到的单菌落分别接种到牛肉膏蛋白胨固体培养基上,37℃培养48 h。挑取1环菌落到液体培养基中,37℃,140 r/min培养48 h。培养完成后,在无菌条件下测摇匀后的液体培养基在600 nm条件下的OD值,用无菌水稀释使液体培养基的光密度OD值为0.7,使其菌浓度相等。
1.2.2.2 发酵样品的处理
称取25 g样品,加入0.25 g的无水氯化钙和57%vol的乙醇溶液50 mL,浸泡摇匀,在25℃条件下经超声波浸提20 min,10000 r/min离心10 min,上清液用0.22 μm滤膜过滤,每个样品做3个平行样,将得到的上清液合并,即得到待测样品。
1.2.2.3 四甲基吡嗪的测定
高效液相色谱条件[9]:色谱柱:Agilent TC-C18(2)(4.6 mm×250 mm,0.5 μm);检测器:VWD检测器;检测波长278 nm;流动相:水溶液(加0.05%三氟乙酸)∶甲醇=3∶7;流速1 mL/min。
四甲基吡嗪标准曲线的绘制:用57%vol的乙醇溶液将四甲基吡嗪标准品分别配制成5 mg/L、10 mg/L、20 mg/L、30 mg/L、40 mg/L的浓度,以浓度为横坐标,峰高为纵坐标绘制标准曲线。
1.2.2.4 挥发性产物测定
内标液:浓度17.54 mg/100 mL的乙酸正戊酯、18.15 mg/100 mL的2-乙基丁酸和15.8 mg/100 mL的叔戊醇。
色谱条件:色谱柱,ZB-Waxplux毛细柱(60 m×0.25 mm,0.25 μm);升温程序:40 ℃保持1 min,以4℃/min升至150℃,保持10 min,再以10℃/min升至210℃,保持18 min,最后以20℃/min升至230 ℃,保持5 min;载气(N2)流速1 mL/min,分流比20∶1。
1.2.2.5 高产四甲基吡嗪菌株的初筛
将种子菌悬液按质量分数1%接种到麸皮培养基中,混合均匀后37℃培养3 d(每天摇动2次麸皮培养基,使菌株在固体培养基中均匀发酵),按照1.2.2.2和1.2.2.3方法测定其中四甲基吡嗪含量。重复此步骤3次,筛出稳定高产四甲基吡嗪的菌株。
1.2.2.6 高产四甲基吡嗪菌株的复筛
将种子菌悬液按质量分数1%接种到麸皮培养基中,混合均匀后培养8 d,1~5 d温度为37℃,6~7 d温度为45℃,第8天的温度为60℃。发酵结束后,按照1.2.2.2和1.2.2.4测定其挥发性产物。
以上各题很容易,第一题心算即可;第二题用竖式加法;第三题长除法或者心算;最后一题心算.未知题目中所要求的几种新方法有何优越性?第四题本是简单的两位数加减;按照题目要求的方法来做,需要分别在数表中数30个小格,或者50个小格!这样一些原始的、繁琐笨拙的方法,居然堂而皇之地写进了教科书;令人无语.
1.2.3 高产四甲基吡嗪菌株的鉴定
1.2.3.1 形态鉴定
菌落形态观察:将菌株划线转接于牛肉膏蛋白胨培养基中,37℃条件下培养48 h后观察其在培养基上颜色、大小、质地、边缘整齐性、表面光滑性等菌落形态特征。
细胞形态观察:接种菌株到液体培养基中,在37℃、120 r/min条件下培养24 h。将活化后的菌株制片,在40倍显微镜下观察细胞形态。
1.2.3.2 细菌16S rDNA鉴定
采用细菌提取试剂盒提取细菌总DNA。引物采用27F 5-AGAGTTTGATCCTGGCTCAG-3,1492R 5-CTACGGCTACCTTGTTACGA-3[10]50 μL PCR扩增反应体系:基因组 DNA(20 ng/μL)1.0 μL、10×Buffer(含 2.5 mM Mg2+)5.0 μ L、Taq 聚合酶(5 u/μL)1.0 μL、dNTP(10 mM)1.0 μL、27F 引物(10 uM)1.5 μL、1492R 引物 (10 uM)1.5 μL、ddH2O 39.0 μL。PCR 反应程序:95℃预变性5 min,95℃变性30 s,58℃退火30 s,72 ℃ 延伸 1 min,72 ℃终延伸7 min,35个循环。PCR产物用AxyPrep DNA凝胶回收试剂盒回收纯化。纯化后的PCR产物,使用测序仪ABI3730-XL进行DNA测序。用NCBI Blast程序将拼接后的序列文件与NCBI16S数据库中的数据进行比对,用Neighbor-Joining法构建系统发育树。
2 结果与分析
2.1 高产四甲基吡嗪菌株的初筛(表1)
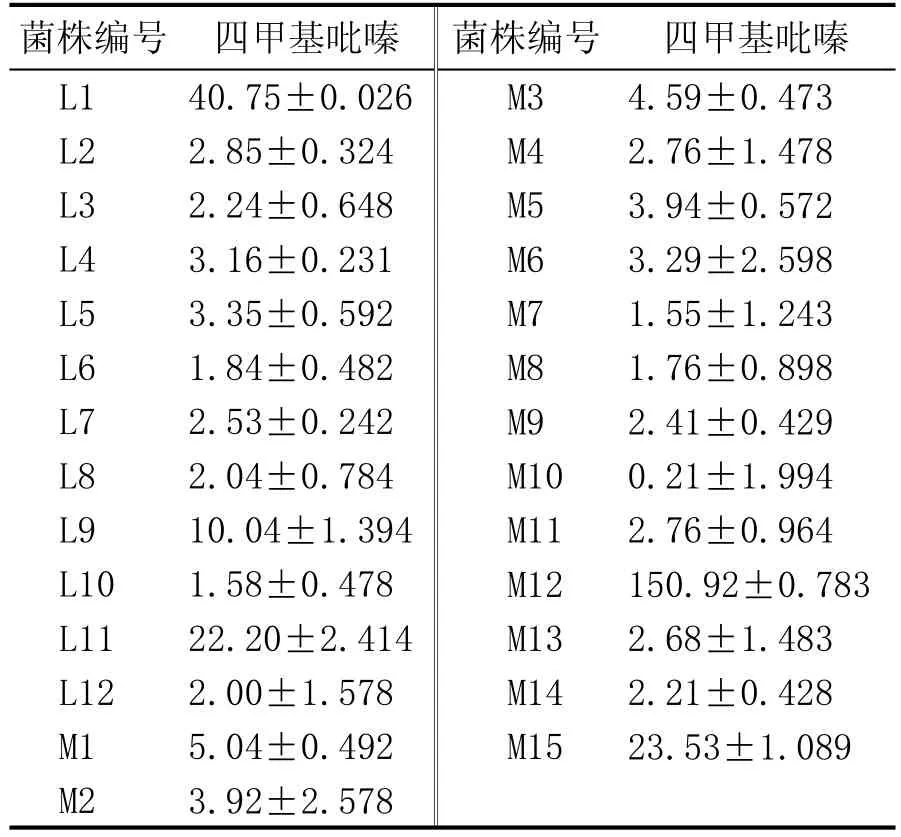
表1 不同菌株发酵物中四甲基吡嗪含量 (mg/L)
通过对高温大曲的分离纯化,共得到27株菌落和细胞形态不同细菌菌株。分别将其进行固态发酵初筛,测定其发酵产物中四甲基吡嗪的含量,筛选出高产四甲基吡嗪的菌株。由表1可知,L1、L11、M15、M12为高产四甲基吡嗪菌株,其中M12和L1四甲基吡嗪产量更为突出,分别为150.92 mg/L、40.75 mg/L。
2.2 高产四甲基吡嗪菌株的复筛(表2)
2.2.1 主成分分析
为了分析不同菌株的复筛发酵产物之间挥发性成分的差异,利用SIMCA-P 11.5软件对64种香气成分的含量进行主成分分析。主成分1的方差贡献率为64.91%,主成分2的贡献率为23.19%,两者累计贡献率已经达到88.10%,基本上能反映样品的挥发性成分信息,因此选取前2个主成分进行分析。

表2 不同菌株发酵物中香气成分及其含量 (mg/100 mL)

图1 挥发性成分主成分分析的得分散点图
由图1可知,4种菌株根据挥发性成分的得分明显分为3个区域,表明4种菌株在主成分上能分开,挥发性成分之间存在明显差异,其中L1和L11发酵产物的挥发性成分有一定的相似性。
2.2.2 不同产吡嗪菌株挥发性物质比较
分析不同产吡嗪菌株发酵物中挥发性物质含量差异,并利用SPSS软件进行差异性分析,结果见图2,结合表2和图2可知,M12和L1是产吡嗪较高的2株菌,其四甲基吡嗪的含量分别为18.90 mg/100 mL和5.53 mg/100 mL。M15和L11产吡嗪含量次之,且4株菌的吡嗪含量存在显著差异(p<0.05)。

图2 不同菌株挥发性物质含量比较
另外,在酯类方面,M12明显比另外3株酯类含量高,酯类含量为25.99 mg/100 mL,L1酯类含量次之,为10.75 mg/100 mL,且M15、L11在酯类含量上不存在差异显著(p>0.05)。在醛类方面,M12和L1醛含量稍高于其他3株菌,分别为5.29 mg/100 mL、5.28 mg/100 mL,M15、L11在醛含量上不存在差异显著(p>0.05)。4株菌在酚含量上都比较低,之间不存在差异显著(p>0.05)。此外,在高级醇方面,L11中高级醇含量最高,为5.74 mg/100 mL,M12和L1较低,分别为2.77 mg/100 mL、2.74 mg/100 mL。
2.2.3 复筛结果
M12、L1不仅产四甲基吡嗪能力较强,而且产酯能力也是较高的2株菌。酯类是白酒中种类和含量最多的挥发性物质[11],也是白酒香味成分中的主体成分和呈香成分[12],其含量对白酒的品质有重要影响。此外,在酚类、醛类上,M12、L1的含量较高。白酒中酚、醛主要来自于醇的转化[13],含量虽然很低,但对酒的品质有很大影响[14]。最后,M15、L11中高级醇比M12、L1高。高级醇是3个碳原子以上的一元醇类物质的总称[15],适量的高级醇可以使酒体丰富[16],当白酒中高级醇含量过高,不仅会导致辛辣苦涩,给酒带来不良影响,且对人体有危害作用,是引起饮后上头、口干的原因之一[17]。综合考虑,既保证四甲基吡嗪的产量,又可降低对其他挥发性物质的影响,最终选择M12、L1为目标菌株。
2.3 菌株鉴定
2.3.1 菌株的形态学观察
对筛选出的菌株M12、L1采用点接法接种于牛肉膏蛋白胨培养基上,观察其菌落形态特征,结果见图3。菌株M12菌落呈白色椭圆形,边缘不整齐,表面平整干燥,附着性强。经染色后,细胞形态为细长杆状。L1菌落为圆形,白色透明,边缘不整齐,表面呈突起的圆形,有黏性,湿润。经染色后,细胞形态为短粗杆状。

图3 菌株M12(a)和L1(b)的菌落形态以及M12(c)和L1(d)的细胞形态
2.3.2 菌株的分子鉴定
将菌株M12、L1的16 SrDNA进行PCR扩增,然后将扩增产物进行序列测序,将测序得到的序列在NCBI中比对分析,获得与测序菌株序列相近种、属的序列。通过Neighbor-Joining法构建系统发育树,结果如图4。菌株M12与Bacillus licheniformis相似性达99%,鉴定为Bacillus licheniformis。菌株L1与Bacillus siamensis相似性达99%,鉴定为Bacillus siamensis。

图4 菌株M12和L1 16S rDNA序列系统进化树
3 结论
通过固态发酵从高温大曲中筛选出4株高产四甲基吡嗪的细菌菌株,将其模拟大曲生产发酵,测定发酵产物中挥发性成分。气相色谱共检测到64种挥发性成分,经主成分分析,得到2个主成分,4种菌在主成分上可以明显的区分出来。其中M12和L1不仅产吡嗪能力较强,产酯能力也较另外2株菌强,而且M12、L1在酚类、醛类上的含量是最高的。此外M15、L11中高级醇含量都比M12、L1高。经多方面分析,故M12、L1更适合应用于工厂实践生产。经过形态学和分子鉴定,确定M12为Bacillus licheniformis,L1 为Bacillus siamensis。关于生产实践利用,则还需进行菌株发酵特性实验,作进一步的研究探讨。

