uPAR靶向性MRI探针的制备及其与乳腺癌细胞靶向结合的研究
杨 扬 孟 洁# 温 涛 陈 博 刘 飞 顾 宁 许海燕# 于 薇 刘 健#*
1(中国医学科学院基础医学研究所,北京协和医学院基础学院,北京 100005) 2(东南大学生物科学与医学工程学院,江苏省生物材料与器件重点实验室,南京 210096) 3(正大天晴药业集团股份有限公司,南京 210018) 4(首都医科大学附属北京安贞医院,北京 100029)
引言
乳腺癌是女性最常见的恶性肿瘤之一,是全球范围内引起女性死亡的第二大因素[1],仅排在肺癌之后。而国家癌症中心发布的《2017年中国肿瘤的现状和趋势》报告显示,中国乳腺癌发病率位列女性恶性肿瘤之首。开发特异性靶向分子影像探针,实现对原发性和继发性乳腺癌病灶的早期诊断,对于克服目前乳腺癌临床治疗所面临的侵袭转移及高复发率难题[2],提高患者的远期生存率具有重要的意义。
目前,针对分子影像学探针的研究主要集中在放射性核素成像、荧光成像及磁共振成像上[3-6]。一方面,基于放射性同位素标记的单光子发射计算机断层成像(single-photon emission computed tomography,SPECT)或正电子发射断层成像(positron emission tomography,PET)等技术尽管具有较高的灵敏度,但空间分辨率低,而且放射性探针带来的辐射性损伤、高成本及使用上的不便限制了其大范围推广应用[7];另一方面,基于光学成像技术的近红外荧光反射(near-infrared fluorescence reflectance,NIFR)或荧光分子断层扫描(fluorescence molecular tomography,FMT)等技术虽然具有较高的灵敏度和时间分辨率,但在组织穿透方面具有天生的缺陷[8]。相对而言,磁共振成像(magnetic resonance imaging,MRI)技术是一种安全、非侵入性的诊断方法,其空间分辨率高,没有电离辐射危险,还可以三维显示组织解剖细节,已广泛应用于肿瘤的成像中[9-11]。而超顺磁性氧化铁纳米颗粒(superparamagnetic iron oxide nanoparticles,SPIO)具有超顺磁性及良好的生物相容性,是一种有效的MRI对比剂[12]。特别是SPIO具有较大的比表面积,可通过化学偶联等手段导入不同的靶向配体,有助于实现疾病的靶向诊断,并提高微小病灶的检出率[13-14]。
尿激酶受体(urokinase-type plasminogen activator receptor,uPAR)属于Ly-6超家族,是一类高度糖基化的膜锚定蛋白[15],在大多数肿瘤如乳腺癌、前列腺癌等的生长、侵袭、血管生成过程中扮演着重要的角色[16-19]。不同于一般的肿瘤特异性抗原,uPAR不仅在肿瘤细胞上高表达,在肿瘤微环境中的肿瘤相关细胞如血管内皮细胞和炎性细胞(如中性粒细胞、巨噬细胞)上,其表达量也显著高于正常组织[20]。因此,以uPAR为靶点的分子影像学探针对于肿瘤的早期诊断具有重大的价值。
在本研究中,我们将uPAR的天然配体尿激酶(urokinase-type plasminogen activator,uPA)的氨基末端片段(amino-terminal fragment,ATF)偶联到SPIO上,制备了一种uPAR靶向的MRI探针(SPIO-ATF),对其物理化学性质进行了分析,并利用小鼠乳腺癌细胞系4T1对其肿瘤靶向性进行了评价,期望其能够提高乳腺癌早期影像学诊断的检出率。
1 材料和方法
1.1 材料与细胞
SPIO水溶液(铁浓度:24 mg/mL,颗粒核心为γ-Fe2O3,外层包被羧甲基化葡聚糖)由南京正大天晴药业集团股份有限公司制备。带有组氨酸标签(histidine tags,His tags)的小鼠来源ATF购自上海生工生物工程股份有限公司,纯度大于95%,浓度为2.16 mg/mL,分子量约为17 kDa,氨基酸序列为:MSVLGAPDESNCGCQNGGVCVSYKYFSRIRRCSCP RKFQGEHCEIDASKTCYHGNGDSYRGKANTDTKG RPCLAWNAPAVLQKPYNAHRPDAISLGLGKHNYC RNPDNQKRPWCYVQIGLRQFVQECMVHDCSLSKLE HHHHHH。实验中所用其他化学试剂均购自美国Sigma-Aldrich公司。
小鼠乳腺癌细胞系4T1购自中国医学科学院基础医学研究所细胞资源中心,并在含10%胎牛血清、100 U/mL青霉素与100 U/mL链霉素的RPMI 1640培养基中进行培养,培养箱温度为37 ℃,CO2浓度为5%。
1.2 SPIO-NTA的制备
取0.5 mL SPIO水溶液与4.5 mL活化缓冲液(0.05 M 2-(N-吗啉基)乙磺酸(2-(N-Morpholino) ethanesulfonic acid,MES),0.5 M NaCl,pH 6.0)混合,将2.1 mg 1-(3-二甲基氨基丙基)-3-乙基碳二亚胺(1-ethyl-3-(3-dimethylaminopropyl) carbodiimide,EDC)与6 mg N-羟基硫代琥珀酰亚胺(sulfo-N-hydroxysuccinimide,sulfo-NHS)溶解在0.5 mL活化缓冲液中。将上述两种溶液混合后在室温下磁力搅拌15 min,以活化SPIO表面的羧基,然后加入7.708 μL 2-巯基乙醇,室温下反应10 min以终止活化反应。
将75.3 mg氨基化次氮基三乙酸(amino-nitrilotriacetic acid,A-NTA)用5 mL磷酸钠缓冲液(0.1 M,pH 7.5)溶解后加入上述反应液中,室温条件下持续搅拌2 h,使SPIO表面活化的羧基与A-NTA的氨基进行反应,从而将A-NTA偶联到SPIO上。将反应液在50 000 r/min条件下超速离心2 h,收集沉淀,得到SPIO-NTA。
用10 mL双蒸水重悬SPIO-NTA,再加入68.2 mg NiCl2·6H2O,室温下磁力搅拌30 min,使Ni2+通过4个配位键与NTA相结合。反应液经过50 000 r/min超速离心2 h后,弃去上清,并用双蒸水洗涤2遍,以除去未反应的Ni2+。用5 mL双蒸水重悬终产物SPIO-NTA-Ni2+并保存于4 ℃备用。
1.3 SPIO-ATF的制备
取300 μL SPIO-NTA-Ni2+溶液,将其缓慢滴加到1 mL ATF溶液中,4 ℃振荡孵育2 h后放于4 ℃过夜,使ATF通过His tags与Ni2+形成2个配位键,从而偶联到SPIO上。反应液经过50 000 r/min超速离心1 h,收集沉淀,得到SPIO-ATF,经PBS洗涤2遍后用300 μL PBS重悬,保存于4 ℃备用。
1.4 ATF导入的验证
取30 μL SPIO-ATF溶液,100 ℃加热10 min,将ATF与SPIO分离,在50 000 r/min条件下超速离心1 h后,取上清浓缩后进行蛋白凝胶电泳和考马斯亮蓝染色。
1.5 SPIO-ATF物理性质的表征
利用透射电子显微镜(TEM,JEM-2100,Jeol,日本)对SPIO的γ-Fe2O3核心进行观察。利用动态光散射分析仪(DLS,Nano ZS90 Zetasizer,Malvern,英国)测定SPIO和SPIO-ATF的水合直径及Zeta电位。用双蒸水将SPIO和SPIO-ATF溶液分别稀释至铁浓度为0.1 mg/mL,然后取1 mL待测溶液放于比色皿中,测量温度设置为25 ℃,并在90°的测试角下进行测定,粒度计算模型设置为General Purpose。
1.6 SPIO-ATF与4T1细胞结合能力的评价
在24孔板底部预先放置玻片,按照5×104个/孔的密度接种4T1细胞,培养过夜,使细胞在玻片上贴壁。然后将细胞分别与铁浓度为50 μg/mL的SPIO、SPIO-ATF或PBS在37 ℃孵育4 h,或先与ATF(200 μg/mL)孵育30 min后再与SPIO-ATF孵育4 h。细胞经过PBS洗涤3遍后用4%多聚甲醛在室温下固定15 min并进行普鲁士蓝染色。具体操作为:将5%亚铁氰化钾水溶液和5%盐酸水溶液等体积混合,将其滴在细胞培养玻片上,室温放置1 h后用双蒸水洗涤,并加入伊红染液复染。染色后将玻片取出并在光学显微镜(TH4-200,Olympus,日本)下观察。
为了定量检测细胞结合的氧化铁纳米颗粒,按照上述操作接种细胞并与SPIO或SPIO-ATF孵育后,收集细胞并向其中加入200 μL 6 M HCl以溶解氧化铁纳米颗粒。将细胞悬液在12 000转/min条件下离心10 min后,取出100 μL上清置于新离心管中,用5% NaOH溶液调节pH至5~7,然后依次加入100 μL 10%盐酸羟胺溶液,200 μL 0.15%邻二氮菲溶液及500 μL 1 M醋酸钠溶液,混匀后室温放置10 min,通过酶标仪(BioTek Synergy 4,BioTek,美国)检测其在510 nm波长处的吸光值。利用已知铁浓度的系列氯化铁溶液(0、2、4、6、8、10 μg/mL)绘制标准曲线。
为了进一步探究SPIO-ATF和细胞的结合量与细胞中uPAR表达量的关系,首先将4T1细胞分别在含有10 μM SB203580[21]或10 ng/mL PMA[22]的培养基中培养24 h。之后通过蛋白质印迹法检测4T1细胞中uPAR的表达量,或将细胞与铁浓度为50 μg/mL的SPIO-ATF继续孵育4 h,经过4%多聚甲醛固定后进行普鲁士蓝染色,并通过邻二氮菲法定量测定细胞结合的SPIO-ATF。
1.7 SPIO-ATF的细胞毒性检测
将4T1细胞按照1×104个/孔的密度种于96孔板中,培养过夜,使细胞贴壁。然后将细胞与不同铁浓度(5、12.5、25、50、100 μg/mL)的SPIO或SPIO-ATF溶液在37 ℃孵育24 h或48 h后弃掉培养基。用PBS将细胞洗涤2遍后,向每孔中加入含10% CCK-8反应试剂(Dojindo Molecular Technologies,日本)的新鲜培养基120 μL并继续孵育1.5 h。之后通过酶标仪检测上清液在450 nm波长处的吸光值。每个实验条件设置4个复孔,未孵育材料的细胞作为阳性对照。
1.8 4T1细胞对SPIO-ATF的摄取
按照1.0×105个/孔的细胞密度将4T1细胞接种到12孔板,培养过夜。然后将细胞与不同铁浓度(0、5、12.5、25、50、100 μg/mL)的SPIO-ATF溶液孵育24 h,弃掉培养基并用PBS洗涤3遍。细胞经4%多聚甲醛固定后进行普鲁士蓝染色,并通过邻二氮菲法测定细胞内的铁含量,具体操作同上。
1.9 统计分析
实验数据以均值±标准差表示,采用SPSS 17.0统计分析软件对实验数据进行统计分析,组间差异通过单因素方差分析(ANOVA)进行分析,P<0.05表示差异具有显著性。
2 结果
2.1 SPIO-ATF的制备和表征
本研究中用到的SPIO核心为γ-Fe2O3,外层包被羧甲基化葡聚糖,TEM照片显示γ-Fe2O3核心的直径小于10 nm(见图1(a))。DLS测得SPIO的平均水合直径为 (67.13±1.43) nm,偶联ATF后平均水合直径增加为 (76.59±1.67) nm(见图1(c))。SPIO和SPIO-ATF的Zeta电位分别为 (-37.13±2.54) mV和 (-13.00±1.55) mV,Zeta电位的变化可能是由ATF的电荷屏蔽效应引起的。
为了验证ATF是否偶联到了SPIO上,将SPIO-ATF经100 ℃加热处理及离心后得到的上清进行了蛋白凝胶电泳和考马斯亮蓝染色。结果显示,在分子量约17 kDa处能够观察到明显的蛋白条带(见图1(b),最右侧泳道),而未偶联的ATF条带也出现在相同的位置上(见图1(b),中间泳道),这表明ATF已被成功导入到SPIO上,并且未发生降解或团聚。

图1 SPIO-ATF的理化学性质表征。(a)SPIO的TEM照片;(b)通过蛋白凝胶电泳及考马斯亮蓝染色检测与SPIO偶联的ATF;(c)SPIO与SPIO-ATF的水合直径分布Fig.1 Physicochemical characterization of SPIO-ATF. (a) TEM micrograph of SPIO; (b) The introduction of ATF to SPIO was confirmed by protein gel electrophoresis with Coomassie brilliant blue staining; (c) The hydrodynamic diameters of SPIO and SPIO-ATF
2.2 SPIO-ATF与4T1细胞结合能力的评价
图2(a)是4T1细胞与SPIO或SPIO-ATF孵育4 h,或先经过ATF预孵育后再与SPIO-ATF孵育4 h后的普鲁士蓝染色照片,结果显示,SPIO组仅有少量蓝染铁颗粒可见,且主要分布于细胞外间隙;而SPIO-ATF组可见大量蓝染铁颗粒分布在细胞膜上,这表明SPIO-ATF更易于与细胞结合。而当细胞经过ATF预孵育处理后,视野中的蓝染铁颗粒明显减少,表明ATF预处理可以显著抑制SPIO-ATF与4T1细胞的结合,提示SPIO-ATF是通过细胞表面的uPAR结合到细胞上的,从而在细胞水平上证明了SPIO-ATF良好的靶向性。而对细胞结合的氧化铁纳米颗粒的定量测定也进一步验证了这个结果(见图2(b))。

图2 SPIO和SPIO-ATF与4T1细胞的结合能力。(a)4T1细胞分别与PBS、SPIO和SPIO-ATF孵育后,或经ATF预处理的4T1细胞与SPIO-ATF孵育后的普鲁士蓝染色结果(标尺:50 μm);(b)邻二氮菲法定量测定与4T1细胞结合的氧化铁纳米颗粒(*P<0.05)Fig.2 Binding capability of SPIO and SPIO-ATF with 4T1 cells. (a) 4T1 cells assessed by Prussian blue staining after the incubation with PBS, SPIO, SPIO-ATF, or SPIO-ATF with pre-treatment of ATF (scale bar: 50 μm); (b) Quantitative analysis of iron oxide nanoparticles bound with 4T1 cells determined by the o-phenanthroline method (*P<0.05)

图3 4T1细胞uPAR表达量对其与SPIO-ATF结合量的影响。(a)4T1细胞与10 μM SB203580或10 ng/mL PMA孵育24 h后,用蛋白质印迹法检测uPAR的表达量;(b)经过SB203580或PMA处理的4T1细胞与SPIO-ATF孵育4 h后的普鲁士蓝染色结果(标尺:50 μm);(c)经过SB203580或PMA处理的4T1细胞与SPIO-ATF孵育4 h后,邻二氮菲法定量测定4T1细胞结合的SPIO-ATF(* P<0.05);(d)SPIO-ATF与细胞的结合量与uPAR相对表达量的相关性分析Fig.3 The influence of expression level of uPAR on the binding capability of SPIO-ATF with 4T1 cells. (a) Western blot analysis of the uPAR expression in 4T1 cells after treated with 10 μM SB203580 or 10 ng/mL PMA for 24 h; (b) Prussian blue staining of 4T1 cells after the incubation with SPIO-ATF for 4 h with the pre-treatment of SB203580 or PMA (scale bar: 50 μm); (c) Quantitative analysis of SPIO-ATF bound with 4T1 cells suffered different pre-treatments (* P<0.05); (d) The correlation between the amount of SPIO-ATF bound with cells and the relative expression level of uPAR
由蛋白质印迹结果可知,4T1细胞经10 μM SB203580处理24 h后,uPAR的表达量下降;而经10 ng/mL PMA处理24 h后,uPAR的表达量上升(见图3(a))。将经过这两种处理的细胞与SPIO-ATF孵育4 h后,进行多聚甲醛固定及普鲁士蓝染色,结果显示,经过PMA处理的细胞结合的蓝染铁颗粒最多,而经过SB203580处理的细胞结合的蓝染铁颗粒最少(见图3(b))。用邻二氮菲法对细胞结合的SPIO-ATF的定量测定也显示了同样的结果(见图3(c))。而且,SPIO-ATF与细胞的结合量与uPAR的相对表达量显示出了高度的相关性(见图3(d)),从而进一步表明SPIO-ATF与细胞的结合是由ATF与细胞上uPAR的相互作用介导的。
2.3 SPIO、SPIO-ATF对4T1细胞活性的影响
图4显示了4T1细胞在与SPIO或SPIO-ATF孵育24 h或48 h后的相对细胞活性。结果表明,在实验浓度下,SPIO和SPIO-ATF均未表现出明显的细胞毒性。
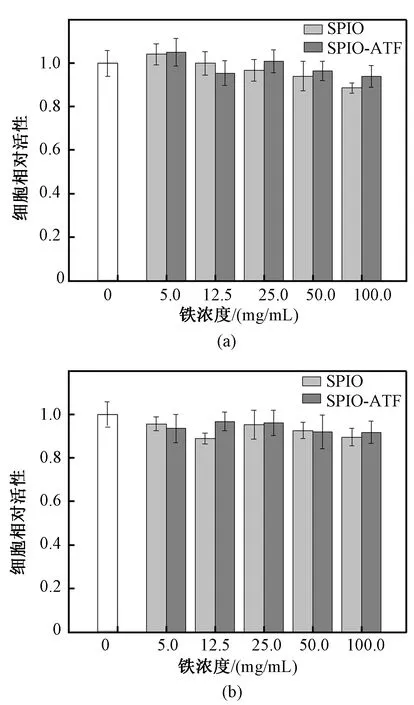
图4 不同孵育时间SPIO和SPIO-ATF对4T1细胞活性的影响。(a)24 h;(b)48 hFig.4 Cell viability of 4T1 cells after the incubation with SPIO or SPIO-ATF for different incubating times. (a) 24 h; (b) 48 h
2.4 4T1细胞对SPIO-ATF的摄取
将4T1细胞分别与不同铁浓度的SPIO-ATF孵育24 h后进行普鲁士蓝染色。结果显示,随着铁浓度的增大,4T1细胞对SPIO-ATF的摄取也逐渐增大,表现出一定的浓度依赖性(见图5(a))。通过邻二氮菲法对细胞中铁含量的检测也进一步验证了这个结果(见图5(b))。
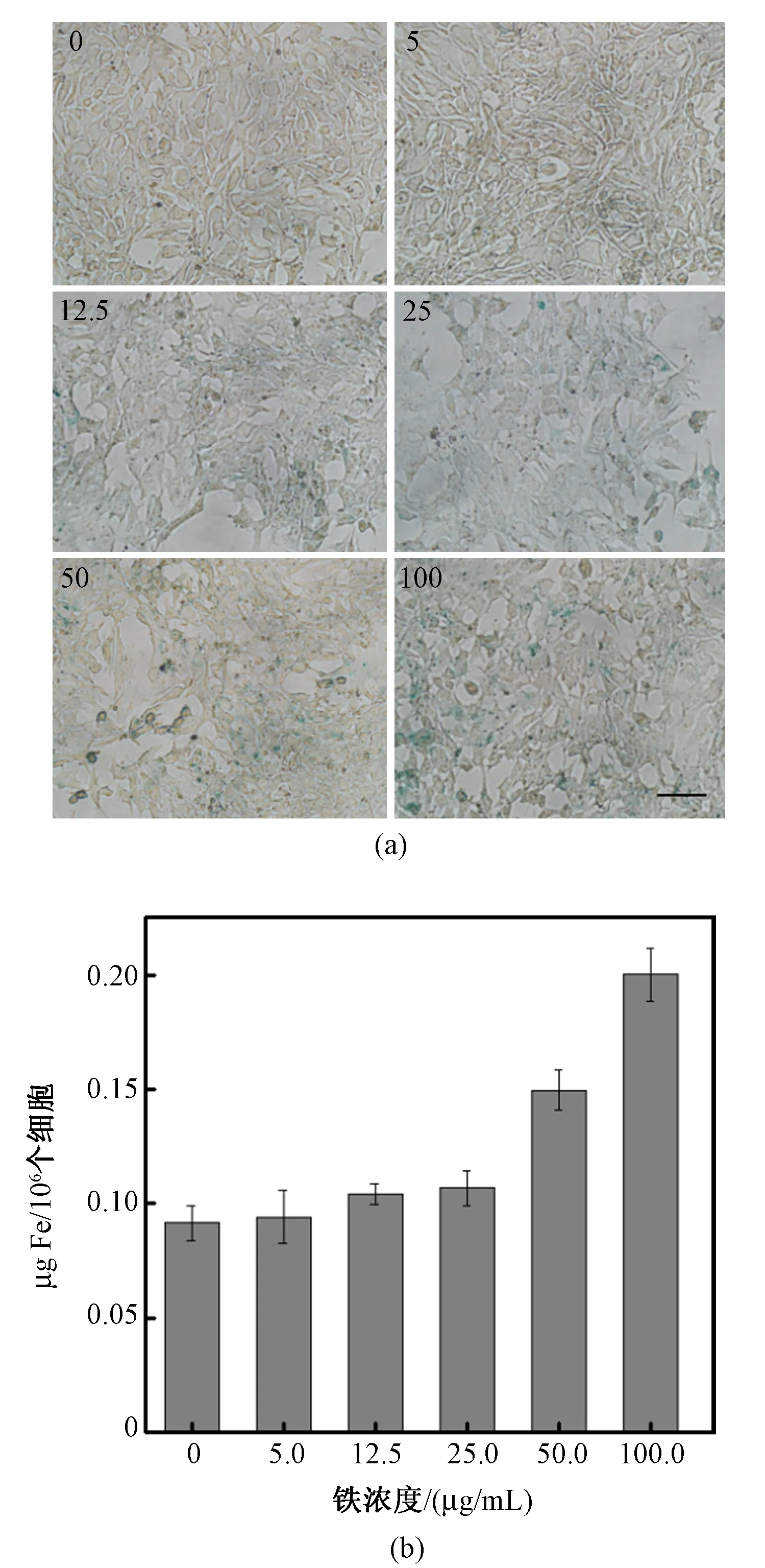
图5 4T1细胞对SPIO-ATF的摄取。(a)4T1细胞与不同铁浓度的SPIO-ATF孵育24 h后进行普鲁士蓝染色(浓度单位: μg/mL,标尺:50 μm);(b)邻二氮菲法定量测定被4T1细胞摄取的SPIO-ATFFig.5 Cellular uptake of SPIO-ATF. (a) 4T1 cells assessed by Prussian blue staining after the incubation with different iron concentrations of SPIO-ATF for 24 h (concentration unit: μg/mL, scale bar: 50 μm); (b) Quantitative analysis of SPIO-ATF taken in by 4T1 cells using the o-phenanthroline method
3 讨论
在SPIO上导入ATF后,结合到4T1细胞表面的氧化铁纳米颗粒明显增多,而且SPIO-ATF与4T1细胞的结合量与细胞中uPAR的表达水平正相关。此外,用ATF提前处理细胞后,细胞结合SPIO-ATF的能力显著下降。这些结果表明,SPIO-ATF可以特异性结合到4T1细胞上,而这种结合是通过ATF与uPAR的相互作用介导的。因此,利用SPIO-ATF能够实现对高表达uPAR细胞的靶向成像。
与一般的肿瘤特异性抗原不同,uPAR不仅在肿瘤细胞上高表达,也在肿瘤微环境中的肿瘤相关细胞如血管内皮细胞、中性粒细胞、巨噬细胞上高表达[20]。这使得以uPAR为靶点的分子影像学探针有望实现对肿瘤微环境的靶向,从而大大增加其在肿瘤部位的聚集,使得对肿瘤微小病灶的识别成为可能,从而有望为原位肿瘤或转移肿瘤的早期诊断提供一种新策略。而ATF包含uPAR的天然配体uPA氨基末端片段的135个氨基酸残基,与uPA相比,ATF分子量小、成本低,更适合用于制备靶向探针。
在通常情况下,大部分靶向探针的构建都是基于化学偶联或生物素-亲和素的方式[23-25]。化学偶联通常需要利用蛋白或多肽中的氨基或羧基等与载体发生反应,有可能会影响蛋白或多肽的生理活性,而且难以满足在使用前根据需要自由更换靶向探针,从而提高载体的通用性的需求。尽管生物素-亲和素系统可以为探针的组装提供高度的自由性,但这一体系的成本偏高,而且亲和素分子量较大(约为68 kDa),使得连接靶向分子后的显影探针特别是小分子探针的尺寸变大,更容易被单核巨噬细胞系统所截留,从而缩短血液循环时间,不利于靶向成像的实现。His tags以及NTA-His tags系统已经广泛应用于各种蛋白的纯化中[26-27]。其成本低廉,且对探针尺寸的改变很小。因此,在本研究中,利用NTA-His tags系统构建了一种通用的磁共振成像模块(SPIO-NTA)。它可以偶联各种含有His tags的蛋白或多肽,进而构建不同的靶向显影探针,从而应用于各种疾病的诊断。
4 结论
本研究成功构建了一种具有uPAR靶向性的MRI探针——SPIO-ATF。通过ATF与uPAR的相互作用,SPIO-ATF可以与乳腺癌细胞4T1特异性结合并被其摄取,展现出了良好的特异性靶向能力,从而有望实现对乳腺癌肿瘤微小病灶的早期MRI诊断。

